名校
1 . 反应: ,在密闭容器中达到平衡时
,在密闭容器中达到平衡时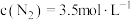 ,
,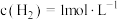 ,
,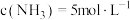 ,求:
,求:
(1) 和
和 的起始浓度
的起始浓度_________ 。
(2) 的转化率
的转化率_________ 。
(3)平衡时压强为开始时压强的百分之几_________ 。
(4)平衡时 占总体积的体积分数
占总体积的体积分数_________ 。
 ,在密闭容器中达到平衡时
,在密闭容器中达到平衡时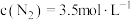 ,
,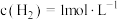 ,
,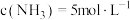 ,求:
,求:(1)
 和
和 的起始浓度
的起始浓度(2)
 的转化率
的转化率(3)平衡时压强为开始时压强的百分之几
(4)平衡时
 占总体积的体积分数
占总体积的体积分数
您最近一年使用:0次
名校
2 .  与
与 在高温下发生反应:
在高温下发生反应: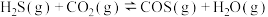
 。在
。在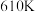 时,将
时,将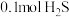 与
与 充入
充入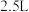 的空钢瓶中,经过
的空钢瓶中,经过 ,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
(1)求 的平衡转化率
的平衡转化率_______ 。
(2)求该温度下的反应平衡常数_______ 。
 与
与 在高温下发生反应:
在高温下发生反应: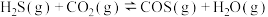
 。在
。在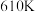 时,将
时,将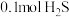 与
与 充入
充入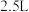 的空钢瓶中,经过
的空钢瓶中,经过 ,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。(1)求
 的平衡转化率
的平衡转化率(2)求该温度下的反应平衡常数
您最近一年使用:0次
3 . 一定温度下,在10L密闭容器中加入5molSO2和3molO2,发生反应:2SO2(g)+O2(g) 2SO3(g),10min时,反应达到平衡状态,此时有3molSO2发生了反应。
2SO3(g),10min时,反应达到平衡状态,此时有3molSO2发生了反应。
(1)反应生成了____ molSO3,v(SO2)=____ 。
(2)平衡时SO3的浓度是____ ,SO2的转化率是____ 。
(3)平衡时容器内气体的总物质的量为___ mol。
(4)物质的浓度不再改变标志着该反应已达平衡,下列还可以说明该反应已达平衡的是___ (填序号)。
①体系内压强不再改变
②容器内气体的密度不再改变
③混合气体的平均相对分子质量不再改变
④v正(SO3)=2v逆(O2)
⑤n(SO3):n(O2):n(SO2)=2:1:2
(5)该温度下,SO3(g) SO2(g)+
SO2(g)+ O2(g)的平衡常数K=
O2(g)的平衡常数K=___ 。
 2SO3(g),10min时,反应达到平衡状态,此时有3molSO2发生了反应。
2SO3(g),10min时,反应达到平衡状态,此时有3molSO2发生了反应。(1)反应生成了
(2)平衡时SO3的浓度是
(3)平衡时容器内气体的总物质的量为
(4)物质的浓度不再改变标志着该反应已达平衡,下列还可以说明该反应已达平衡的是
①体系内压强不再改变
②容器内气体的密度不再改变
③混合气体的平均相对分子质量不再改变
④v正(SO3)=2v逆(O2)
⑤n(SO3):n(O2):n(SO2)=2:1:2
(5)该温度下,SO3(g)
 SO2(g)+
SO2(g)+ O2(g)的平衡常数K=
O2(g)的平衡常数K=
您最近一年使用:0次
2022-04-11更新
|
532次组卷
|
2卷引用:广东省揭阳华侨高级中学2021-2022学年高二上学期第一次阶段考试化学试题
4 . 回答下列问题:
消除含氮、硫等化合物对大气的污染,对建设美丽家乡、打造宜居环境具有重要意义。
(1)容积均恒定为1 L的甲、乙两个容器,其中甲为绝热容器,乙为恒温容器。相同温度下,分别充入0.2 mol的NO2,发生反应:2NO2(g) ⇌N2O4 ΔH<0,甲中NO2的相关量随时间变化如图所示。
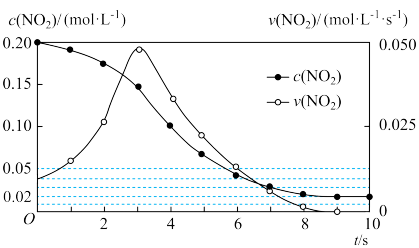
① 0~3 s内,甲容器中NO2的反应速率增大的原因是___________ 。
② 甲达到平衡时,温度若为T ℃,此温度下的平衡常数K=___________ 。(不用注明单位)
③ 平衡时,p甲___________ p乙(填“>”、“<”或“=”,下同),原因是:___________ 。
④平衡时,K甲___________ K乙
(2)汽车尾气中CO与H2O(g)在一定条件下可以发生反应:CO(g)+ H2O(g)⇌CO2(g)+H2(g) ΔH2<0.820℃ 时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0.
平衡时,甲容器中CO的转化率是___________ (填“>”、“=”、“<”或“无法判断”);丙容器中n(CO)为___________ mol。
消除含氮、硫等化合物对大气的污染,对建设美丽家乡、打造宜居环境具有重要意义。
(1)容积均恒定为1 L的甲、乙两个容器,其中甲为绝热容器,乙为恒温容器。相同温度下,分别充入0.2 mol的NO2,发生反应:2NO2(g) ⇌N2O4 ΔH<0,甲中NO2的相关量随时间变化如图所示。

① 0~3 s内,甲容器中NO2的反应速率增大的原因是
② 甲达到平衡时,温度若为T ℃,此温度下的平衡常数K=
③ 平衡时,p甲
④平衡时,K甲
(2)汽车尾气中CO与H2O(g)在一定条件下可以发生反应:CO(g)+ H2O(g)⇌CO2(g)+H2(g) ΔH2<0.820℃ 时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0.
| 起始物质的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
您最近一年使用:0次
名校
5 . 把7 molA气体和5 molB气体混合放入2 L密闭容器中,在一定条件下发生反应:3A(g)+B(g)⇌2C(s)+xD(g),经5min达到平衡,此时生成2 mol C,测得D的平均反应速率为0.2 mol·(L·min)-1,求:
(1)B的转化率_______
(2)x的值_______
(3)平衡时压强与初始时压强之比_______
(4)该温度下此反应的平衡常数_______
(1)B的转化率
(2)x的值
(3)平衡时压强与初始时压强之比
(4)该温度下此反应的平衡常数
您最近一年使用:0次
2021-01-06更新
|
1427次组卷
|
6卷引用:广东省雷州市第二中学2020-2021学年高二上学期期中考试化学试题
广东省雷州市第二中学2020-2021学年高二上学期期中考试化学试题吉林省长春市第二十九中学2021-2022学年高二上学期第一学程考试化学试题(已下线)2.2.2 化学平衡常数(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)2.2.1 化学平衡常数-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)山西运城盐湖五中2022-2023学年高二上学期阶段性测试化学试题(已下线)专题04 可逆反应、化学平衡状态、化学平衡常数【考题猜想】(5大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)
名校
解题方法
6 . 氮氧化物是空气的主要污染物之一,研究氮氧化物的性质对于防治空气污染有重要意义。
温度为T1时,在三个容积均为1L的密闭容器中发生反应:2NO(g)+O2(g) 2NO2(g)ΔH<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。回答下列问题:
2NO2(g)ΔH<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。回答下列问题:
(1)温度为T1时, =
=__ ;当温度升高为T2时,k正、k逆分别增大m倍和n倍,则m__ n(填“>”、“<“或“=”)。
(2)若容器Ⅱ中达到平衡时 =1,则NO的转化率为
=1,则NO的转化率为__ 。
(3)容器Ⅲ中起始时v正__ v逆(填“>”、“<”或“=”),理由是__ 。
(4)T1时,在1L密闭容器中按照一定比例充入NO(g)和O2(g),达到平衡时NO2(g)的体积分数Φ(NO2)随 的变化如图所示,则A、B、C三点中NO的转化率最大的是
的变化如图所示,则A、B、C三点中NO的转化率最大的是__ ;当 =2.3时,达到平衡时Φ(NO2)可能是D、E、F三点中的
=2.3时,达到平衡时Φ(NO2)可能是D、E、F三点中的__ 。

温度为T1时,在三个容积均为1L的密闭容器中发生反应:2NO(g)+O2(g)
 2NO2(g)ΔH<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。回答下列问题:
2NO2(g)ΔH<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。回答下列问题:| 容器编号 | 物质的起始浓度/mol·L−1 | 物质的平衡浓度/mol·L−1 | ||
| c(NO) | c(O2) | c(NO2) | c(O2) | |
| Ⅰ | 0.6 | 0.3 | 0 | 0.2 |
| Ⅱ | 0.5 | x | 0.3 | |
| Ⅲ | 0.3 | 0.25 | 0.2 | |
 =
=(2)若容器Ⅱ中达到平衡时
 =1,则NO的转化率为
=1,则NO的转化率为(3)容器Ⅲ中起始时v正
(4)T1时,在1L密闭容器中按照一定比例充入NO(g)和O2(g),达到平衡时NO2(g)的体积分数Φ(NO2)随
 的变化如图所示,则A、B、C三点中NO的转化率最大的是
的变化如图所示,则A、B、C三点中NO的转化率最大的是 =2.3时,达到平衡时Φ(NO2)可能是D、E、F三点中的
=2.3时,达到平衡时Φ(NO2)可能是D、E、F三点中的
您最近一年使用:0次
2020-11-09更新
|
318次组卷
|
2卷引用:广东华侨中学2022-2023学年高二上学期期中考试化学试题
名校
7 . CO可用于合成甲醇,化学方程式为CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
(1)如图是反应CO(g)+2H2(g) CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变ΔH________ 0 (填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______ K2 (填“>”、“<”或“=”)。在T1温度下,往体积为1 L的密闭容器中,充入1 mol CO和2 mol H2,经测得CO和CH3OH(g)的浓度随时间变化如图所示。则该反应的平衡常数为______________ 。
③若容器容积不变,下列措施可增加CO转化率的是________ (填字母)。
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(2)在容积为1 L的恒容容器中,分别研究在230 ℃、250 ℃和270 ℃三种温度下合成甲醇的规律。如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线z对应的温度是________ ℃;曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为________________ 。
 CH3OH(g)。
CH3OH(g)。(1)如图是反应CO(g)+2H2(g)
 CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
①该反应的焓变ΔH
②T1和T2温度下的平衡常数大小关系是K1
③若容器容积不变,下列措施可增加CO转化率的是
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(2)在容积为1 L的恒容容器中,分别研究在230 ℃、250 ℃和270 ℃三种温度下合成甲醇的规律。如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线z对应的温度是
您最近一年使用:0次
2019-11-15更新
|
434次组卷
|
3卷引用:广东省揭西县河婆中学2019-2020学年高二上学期期中考试化学试题
8 . 将HI(g)置于密闭容器中,某温度下发生下列变化:2HI(g)⇌H2(g)+I2(g) △H<0
(1)该反应平衡常数的表达式为K=___ 。
(2)当反应达到平衡时c(I2)=0.5mol/L,c(HI)=4mol/L,则c(H2)为____ ,HI的分解率为____ 。
(3)若该反应800℃时达到平衡状态,且平衡常数为1.0,某时刻,测得容器内各物质的溶度分别为c(HI)=2.0mol/L,c(I2)=1.0mol/L,c(H2)=1.0mol/L,则该时刻,反应向____ (填“正向”或“逆向”,下同)进行。
(1)该反应平衡常数的表达式为K=
(2)当反应达到平衡时c(I2)=0.5mol/L,c(HI)=4mol/L,则c(H2)为
(3)若该反应800℃时达到平衡状态,且平衡常数为1.0,某时刻,测得容器内各物质的溶度分别为c(HI)=2.0mol/L,c(I2)=1.0mol/L,c(H2)=1.0mol/L,则该时刻,反应向
您最近一年使用:0次
名校
9 . 800K时,将0.1 mo A(g)和0.2 molB(g)充人体积为1 L的固定容积反应器中,发生如下反应:A(g)+2B(g)⇌2 C(g)+D(g),达到平衡时A的物质的量分数为20%。
(1)求达平衡时B的转化率α(B)___________ ;
(2)求该温度下的平衡常数K___________ ;
(3)若起始A的分压为10 kPa,求Kp___________ 。
(4)若在体积固定的某容器中充入0.2 mol A、0.1 mol B、0.1 mol C、0.5 mol D,则此时是否为平衡状态,请计算说明___________ 。
(1)求达平衡时B的转化率α(B)
(2)求该温度下的平衡常数K
(3)若起始A的分压为10 kPa,求Kp
(4)若在体积固定的某容器中充入0.2 mol A、0.1 mol B、0.1 mol C、0.5 mol D,则此时是否为平衡状态,请计算说明
您最近一年使用:0次
10 . 工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60 mol H2(g),2min在某温度下达到平衡,此时NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。请计算(写出计算过程):
2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60 mol H2(g),2min在某温度下达到平衡,此时NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。请计算(写出计算过程):
(1)2min内N2的平均速率;
(2)该条件下此反应的平衡常数K。
 2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60 mol H2(g),2min在某温度下达到平衡,此时NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。请计算(写出计算过程):
2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60 mol H2(g),2min在某温度下达到平衡,此时NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。请计算(写出计算过程):(1)2min内N2的平均速率;
(2)该条件下此反应的平衡常数K。
您最近一年使用:0次
2017-01-18更新
|
348次组卷
|
3卷引用:2016-2017学年广东省肇庆市高二上学期期末化学试卷



