1 . (1)反应Fe(s)+CO2(g)⇌FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)⇌FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1、K2的值如下表:
①反应CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH,平衡常数为K,则ΔH=_______ (用ΔH1和ΔH2表示),K=_______ (用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)⇌CO(g)+H2O(g)是_______ 反应(填“吸热”或“放热”)。
②能判断CO2(g)+H2(g)⇌CO(g)+H2O(g)达到化学平衡状态的依据是_______ (填字母)。
A.容器中压强不变 B.混合气体中c(CO)不变 C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应:Fe(s)+CO2(g)⇌ FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
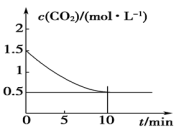
①该条件下反应的平衡常数为___ ;若铁粉足量,CO2的起始浓度为2.0mol·L-1,10分钟达到平衡,则平衡时CO2的浓度为____ mol·L-1,v(CO)为____ 。
②下列措施中能使平衡时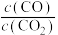 增大的是
增大的是___ (填字母)。
A.升高温度 B.增大压强 C.充入一定量的CO2 D.再加入一定量铁粉
700℃ | 900℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH,平衡常数为K,则ΔH=
②能判断CO2(g)+H2(g)⇌CO(g)+H2O(g)达到化学平衡状态的依据是
A.容器中压强不变 B.混合气体中c(CO)不变 C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应:Fe(s)+CO2(g)⇌ FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。

①该条件下反应的平衡常数为
②下列措施中能使平衡时
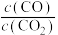 增大的是
增大的是A.升高温度 B.增大压强 C.充入一定量的CO2 D.再加入一定量铁粉
您最近一年使用:0次
名校
2 . 化学科学家采用丙烯歧化法制取乙烯和丁烯的反应原理为2C3H6(g) C2H4(g)+C4H8(g) ∆H。回答下列问题:
C2H4(g)+C4H8(g) ∆H。回答下列问题:
(1)向恒温恒容反应器中加入一定量的C3H6,生成C2H4的物质的量与时间的关系如表所示:
①a=_______ ,p初始:p5min=_______ 。
②其他条件不变,若缩小反应器的体积,则C3H6转化率_______ (填“增大”“减小”或“不变”)。
(2)将2 mol C3H6置于体积为1 L的恒容反应器中,反应进行15min时丙烯的转化率与温度的关系如图所示:
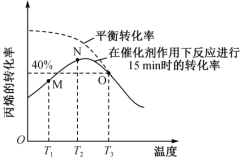
①N点_______ (填“有”或“没有”)达到平衡状态,原因是_______ 。
②M→N过程中C3H6转化率升高的原因是_______ 。
③T3时Kc=_______ ,若其他条件不变,往反应器中再加入2 mol C3H6,反应重新达到平衡时混合体系中乙烯的体积分数为_______ 。
 C2H4(g)+C4H8(g) ∆H。回答下列问题:
C2H4(g)+C4H8(g) ∆H。回答下列问题:(1)向恒温恒容反应器中加入一定量的C3H6,生成C2H4的物质的量与时间的关系如表所示:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| C2H4的物质的量/mol | 0 | 0.8 | 1.2 | 1.5 | a | 1.5 |
①a=
②其他条件不变,若缩小反应器的体积,则C3H6转化率
(2)将2 mol C3H6置于体积为1 L的恒容反应器中,反应进行15min时丙烯的转化率与温度的关系如图所示:

①N点
②M→N过程中C3H6转化率升高的原因是
③T3时Kc=
您最近一年使用:0次
2021-03-21更新
|
212次组卷
|
3卷引用:广西北海市2020-2021学年高二下学期期末教学质量检测化学试题



