解题方法
1 . 回答下列问题:
(1)合成气(CO、H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途。工业上用CO和H2合成CH3OH: △H。则该反应的平衡常数表达式为
△H。则该反应的平衡常数表达式为_______ ;
(2)测得不同温度下反应的平衡常数 如下表:
如下表:
下列说法错误的是_______。
(3)工业上,利用水煤气法制取合成气,其中发生的一步反应为:CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知
CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知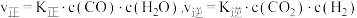 (k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数
(k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数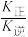 =
=_______ 。
(4)以天然气为原料生产合成气也有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g) 2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
①T℃下,该反应的平衡常数K=_______ 。
②实验1中,CO的平衡体积分数为_______ %(保留三位有效数字)。
③V1:V2=_______ 。
(1)合成气(CO、H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途。工业上用CO和H2合成CH3OH:
 △H。则该反应的平衡常数表达式为
△H。则该反应的平衡常数表达式为(2)测得不同温度下反应的平衡常数
 如下表:
如下表:| 温度/℃ | T1 | 100 | T2 | 200 | 300 |
| 平衡常数K | 100 | 13 | 1 | 1.9×10-2 | 2.4×10-4 |
| A.△H<0 |
| B.该反应的ΔS<0 |
| C.T2时,某时刻1L容器中含0.1mol CO、0.2mol H2和0.3mol CH3OH,此时v正>v逆 |
| D.T1时,向1L密闭容器中投入0.1mol CO和0.2mol H2,平衡时CO转化率为50% |
 CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知
CO2(g)+H2(g) △H=-41.2kJ·mol-1。已知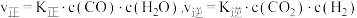 (k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数
(k正、k逆为化学反应速率常数,只与温度有关,与浓度、压强无关)。830℃时,体积为2L的恒容密闭容器中,投入2molCO(g)和2molH2O(g)。5min达到平衡,测得H2的平均生成速率为0.1mol∙L-1∙min-1,则反应达到平衡后,速率常数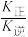 =
=(4)以天然气为原料生产合成气也有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
2CO(g)+2H2(g) △H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:| 实验编号 | 容器体积 | 物质浓度/mol·L-1 | ||
| CH4 | CO2 | CO | ||
| 1 | V1 | 0.02 | 0.02 | 0.10 |
| 2 | V2 | x | x | 0.05 |
②实验1中,CO的平衡体积分数为
③V1:V2=
您最近一年使用:0次
2 . 一氧化氮可用作人造丝的漂白剂及丙烯和二甲醚的安定剂。一定温度下,在2L恒容密闭容器中充入1molNO、1mol ,发生反应
,发生反应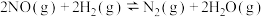 ,起始时体系压强为aMPa,tmin时反应达到平衡,此时测得
,起始时体系压强为aMPa,tmin时反应达到平衡,此时测得 的物质的量分数为25%。
的物质的量分数为25%。
(1)平衡时,体系压强p=___________ MPa。
(2)平衡时,
___________ 。
(3)该反应平衡常数表达式为___________ ,该温度下时,平衡常数K=___________ 。
 ,发生反应
,发生反应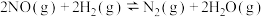 ,起始时体系压强为aMPa,tmin时反应达到平衡,此时测得
,起始时体系压强为aMPa,tmin时反应达到平衡,此时测得 的物质的量分数为25%。
的物质的量分数为25%。(1)平衡时,体系压强p=
(2)平衡时,

(3)该反应平衡常数表达式为
您最近一年使用:0次
名校
解题方法
3 . 依据水溶液中的平衡相关原理,回答下列问题:
(1)已知某温度下,Kw=1×10-13,在该温度下0.1 mol∙L-1HA溶液的pH=3
①该溶液中由水电离出的H+浓度是___________ mol∙L-1。
②计算此温度下HA的电离平衡常数Ka约为___________ 。
(2)已知25℃时部分弱电解质的电离平衡常数数据如表所示:
以下说法正确的是___________。(填选项)
(3)已知t℃,KW=1×10-13,在t℃时将pH=11的NaOH溶液aL与pH=2的H2SO4的溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a∶b=___________ 。
(4)Na2CO3俗称纯碱,是因为其水溶液呈碱性,用离子方程式表示纯碱溶液呈碱性的主要原因是___________ 。在纯碱溶液中下列关系成立的是___________
A.c(H+)+c(Na+)=c( )+c(
)+c( )+c(OH-)
)+c(OH-)
B.c( )>c(
)>c( )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
C.c(OH-)-c(H+)= c( )+2c(H2CO3)
)+2c(H2CO3)
D.c(Na+)=c( )+c(
)+c( )+c(H2CO3)
)+c(H2CO3)
(1)已知某温度下,Kw=1×10-13,在该温度下0.1 mol∙L-1HA溶液的pH=3
①该溶液中由水电离出的H+浓度是
②计算此温度下HA的电离平衡常数Ka约为
(2)已知25℃时部分弱电解质的电离平衡常数数据如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.75×10-5 | Ka1=4.5×10-7 Ka2=4.7×10-11 | Ka=4.0×10-8 |
以下说法正确的是___________。(填选项)
| A.向弱酸溶液中加入少量NaOH溶液,电离平衡常数变大 |
| B.25℃时NaClO的水解平衡常数约为2.5×10-7 |
| C.表中三种酸,酸性最强的是CH3COOH |
D.向NaClO溶液中通入少量CO2气体,可以发生反应:2ClO-+H2O+CO2==2HClO+ |
(4)Na2CO3俗称纯碱,是因为其水溶液呈碱性,用离子方程式表示纯碱溶液呈碱性的主要原因是
A.c(H+)+c(Na+)=c(
 )+c(
)+c( )+c(OH-)
)+c(OH-) B.c(
 )>c(
)>c( )>c(OH-)>c(H+)
)>c(OH-)>c(H+)C.c(OH-)-c(H+)= c(
 )+2c(H2CO3)
)+2c(H2CO3)D.c(Na+)=c(
 )+c(
)+c( )+c(H2CO3)
)+c(H2CO3)
您最近一年使用:0次
4 . 运用化学反应原理研究合成氨反应有重要意义,请完成下列探究。
(1)生产氢气,将水蒸气通过红热的炭即产生水煤气:C(s)+H2O(g) H2(g)+CO(g) ΔH=+131.3kJ•mol-1,写出该反应的平衡常数表达式
H2(g)+CO(g) ΔH=+131.3kJ•mol-1,写出该反应的平衡常数表达式______ 。
(2)已知在400℃时,N2(g)+3H2(g) 2NH3(g)的K=0.5。
2NH3(g)的K=0.5。
①400℃时,2NH3(g) N2(g)+3H2(g)的K'=
N2(g)+3H2(g)的K'=______ (填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正______ v(N2)逆(填“>”“<”“=”或“不能确定”)。
③若在恒温下将容器的容积缩小到原来的二分之一,则合成氨反应的平衡______ 移动(填“向左”、“向右”或“不”);反应的∆H______ (填“增大”、“减小”或“不变”)。
(3)水煤气转化反应CO(g)+H2O(g) CO2(g)+H2(g)在一定温度下达到化学平衡。现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如表两组数据:
CO2(g)+H2(g)在一定温度下达到化学平衡。现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如表两组数据:
①平衡常数K(650℃)______ K(900℃)(填“大于”,“小于”或“等于”)
②若将实验2中CO和H2O的物质的量加倍,则平衡时H2的物质的量浓度为______ 。
(1)生产氢气,将水蒸气通过红热的炭即产生水煤气:C(s)+H2O(g)
 H2(g)+CO(g) ΔH=+131.3kJ•mol-1,写出该反应的平衡常数表达式
H2(g)+CO(g) ΔH=+131.3kJ•mol-1,写出该反应的平衡常数表达式(2)已知在400℃时,N2(g)+3H2(g)
 2NH3(g)的K=0.5。
2NH3(g)的K=0.5。①400℃时,2NH3(g)
 N2(g)+3H2(g)的K'=
N2(g)+3H2(g)的K'=②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正
③若在恒温下将容器的容积缩小到原来的二分之一,则合成氨反应的平衡
(3)水煤气转化反应CO(g)+H2O(g)
 CO2(g)+H2(g)在一定温度下达到化学平衡。现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如表两组数据:
CO2(g)+H2(g)在一定温度下达到化学平衡。现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如表两组数据:| 实验编号 | 温度/℃ | 起始量)/mol | 平衡量)/mol | 达到平衡所需时间)/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 5 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
①平衡常数K(650℃)
②若将实验2中CO和H2O的物质的量加倍,则平衡时H2的物质的量浓度为
您最近一年使用:0次
名校
5 . 在一定温度下,在某4L恒容容器内发生气体M和气体N的转化反应。它们的物质的量随时间变化的曲线如图所示。

(1)该反应的化学方程式为_________ (需要标注M、N的物质状态,且系数化成最简整数)。
(2)比较t2时刻,正、逆反应速率大小:v(正)_________ v(逆)(填“>”“=”或“<”)。
(3)若t2=2min,反应开始至t2时刻,M的平均化学反应速率v(M)_________ mol·L-1·min-1。
(4)该反应的化学平衡常数K=_________ 。
(5)若维持其他条件不变,在t3时升高温度,M的浓度降低,则该反应△H_________ 0(填“>”“=”或“<”)。

(1)该反应的化学方程式为
(2)比较t2时刻,正、逆反应速率大小:v(正)
(3)若t2=2min,反应开始至t2时刻,M的平均化学反应速率v(M)
(4)该反应的化学平衡常数K=
(5)若维持其他条件不变,在t3时升高温度,M的浓度降低,则该反应△H
您最近一年使用:0次
名校
解题方法
6 . 化学平衡常数和化学平衡计算
(1)已知在448℃时,反应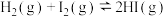 的平衡常数K为49,则该温度下反应
的平衡常数K为49,则该温度下反应 的平衡常数K′为
的平衡常数K′为_______ 。(用分数表示)
(2)某温度下,若把10mol 与30mol
与30mol 置于体积为10L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的
置于体积为10L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的
_______ 。(用分数表示)
(3)恒温恒压下,在一容积可变的容器中, 达到平衡状态时,
达到平衡状态时, 、
、 、
、 各1mol,若此时再充入3mol
各1mol,若此时再充入3mol ,则平衡
,则平衡_______ 移动(填“正向”、“逆向”或“不”)
(4)以水煤气为原料合成甲醇: ,容器为恒温、恒压
,容器为恒温、恒压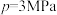 ,充入1mol
,充入1mol 和2mol
和2mol 达到平衡时
达到平衡时 的转化率为75%,平衡常数Kp=
的转化率为75%,平衡常数Kp=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(5)在1L真空密闭容器中加入amol 固体,t℃时发生如下反应:
固体,t℃时发生如下反应:
 ①
①
 ②
②
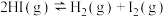 ③
③
达平衡时,体系中 ,
, ,
, ,则t°C时反应①的平衡常数K值为
,则t°C时反应①的平衡常数K值为_______ (用字母表示)
(6)查阅资料知 的反应历程分两步:
的反应历程分两步:
Ⅰ.
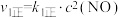 ;
;
Ⅱ. ;
; ;
;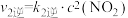
一定温度下,反应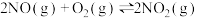 达到平衡状态,请写出用
达到平衡状态,请写出用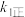 、
、 、
、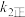 、
、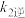 表示的平衡常数表达式
表示的平衡常数表达式
_______ 。
(1)已知在448℃时,反应
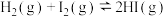 的平衡常数K为49,则该温度下反应
的平衡常数K为49,则该温度下反应 的平衡常数K′为
的平衡常数K′为(2)某温度下,若把10mol
 与30mol
与30mol 置于体积为10L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的
置于体积为10L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的
(3)恒温恒压下,在一容积可变的容器中,
 达到平衡状态时,
达到平衡状态时, 、
、 、
、 各1mol,若此时再充入3mol
各1mol,若此时再充入3mol ,则平衡
,则平衡(4)以水煤气为原料合成甲醇:
 ,容器为恒温、恒压
,容器为恒温、恒压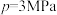 ,充入1mol
,充入1mol 和2mol
和2mol 达到平衡时
达到平衡时 的转化率为75%,平衡常数Kp=
的转化率为75%,平衡常数Kp=(5)在1L真空密闭容器中加入amol
 固体,t℃时发生如下反应:
固体,t℃时发生如下反应: ①
① ②
②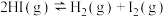 ③
③达平衡时,体系中
 ,
, ,
, ,则t°C时反应①的平衡常数K值为
,则t°C时反应①的平衡常数K值为(6)查阅资料知
 的反应历程分两步:
的反应历程分两步:Ⅰ.

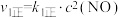 ;
;
Ⅱ.
 ;
; ;
;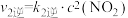
一定温度下,反应
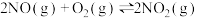 达到平衡状态,请写出用
达到平衡状态,请写出用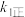 、
、 、
、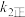 、
、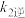 表示的平衡常数表达式
表示的平衡常数表达式
您最近一年使用:0次
名校
解题方法
7 . 氯铂酸钡 固体加热时部分分解为
固体加热时部分分解为 、Pt和
、Pt和 ,376.8℃时平衡常数
,376.8℃时平衡常数 ,在一硬质玻璃烧瓶中加入过量
,在一硬质玻璃烧瓶中加入过量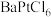 ,抽真空后,通过一支管通入碘蒸气(然后将支管封闭),在376.8℃,碘蒸气初始压强为20.0kPa。376.8℃平衡时,测得烧瓶中压强为32.5kPa,则
,抽真空后,通过一支管通入碘蒸气(然后将支管封闭),在376.8℃,碘蒸气初始压强为20.0kPa。376.8℃平衡时,测得烧瓶中压强为32.5kPa,则
___________ kPa,反应 的平衡常数K=
的平衡常数K=___________ (保留两位有效数字)。
 固体加热时部分分解为
固体加热时部分分解为 、Pt和
、Pt和 ,376.8℃时平衡常数
,376.8℃时平衡常数 ,在一硬质玻璃烧瓶中加入过量
,在一硬质玻璃烧瓶中加入过量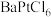 ,抽真空后,通过一支管通入碘蒸气(然后将支管封闭),在376.8℃,碘蒸气初始压强为20.0kPa。376.8℃平衡时,测得烧瓶中压强为32.5kPa,则
,抽真空后,通过一支管通入碘蒸气(然后将支管封闭),在376.8℃,碘蒸气初始压强为20.0kPa。376.8℃平衡时,测得烧瓶中压强为32.5kPa,则
 的平衡常数K=
的平衡常数K=
您最近一年使用:0次
解题方法
8 . 完成下列填空
(1)将CoFe2O4负载在Al2O3上,产氧温度在1 200 ℃,产氢温度在1 000 ℃时,可顺利实现水的分解,氢气产量高且没有明显的烧结现象。循环机理如下,过程如图1所示,不考虑温度变化对反应ΔH的影响。
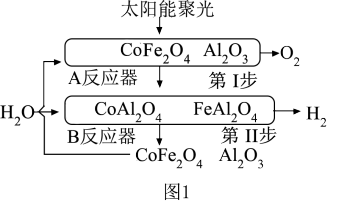
第Ⅰ步:CoFe2O4(s)+3Al2O3(s) CoAl2O4(s)+2FeAl2O4(s)+
CoAl2O4(s)+2FeAl2O4(s)+ O2(g) ΔH=a kJ·mol-1
O2(g) ΔH=a kJ·mol-1
第Ⅱ步:CoAl2O4(s)+2FeAl2O4(s)+H2O(g) CoFe2O4(s)+3Al2O3(s)+H2(g) ΔH=b kJ·mol-1
CoFe2O4(s)+3Al2O3(s)+H2(g) ΔH=b kJ·mol-1
第Ⅱ步反应的v正=k正·c(H2O),v逆=k逆·c(H2),k正、k逆分别为正、逆反应速率常数,仅与温度有关。1 000 ℃时,在体积为1 L的B反应器中加入2 mol H2O发生上述反应,测得H2O(g)和H2物质的量浓度随时间的变化如图2所示,则60 min内,v(CoFe2O4)=_______ g·min-1(保留2位小数)。a点时,v正∶v逆=_______ (填最简整数比)。

(2)在T2 K、1.0×104 kPa下,等物质的量的CO与CH4混合气体发生如下反应:CO(g)+CH4(g) CH3CHO(g)。反应速率v正-v逆=k正p(CO)·p(CH4)-k逆·p(CH3CHO),k正、k逆分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5,则CO转化率为20%时,
CH3CHO(g)。反应速率v正-v逆=k正p(CO)·p(CH4)-k逆·p(CH3CHO),k正、k逆分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5,则CO转化率为20%时, =
=_______ 。
(1)将CoFe2O4负载在Al2O3上,产氧温度在1 200 ℃,产氢温度在1 000 ℃时,可顺利实现水的分解,氢气产量高且没有明显的烧结现象。循环机理如下,过程如图1所示,不考虑温度变化对反应ΔH的影响。

第Ⅰ步:CoFe2O4(s)+3Al2O3(s)
 CoAl2O4(s)+2FeAl2O4(s)+
CoAl2O4(s)+2FeAl2O4(s)+ O2(g) ΔH=a kJ·mol-1
O2(g) ΔH=a kJ·mol-1第Ⅱ步:CoAl2O4(s)+2FeAl2O4(s)+H2O(g)
 CoFe2O4(s)+3Al2O3(s)+H2(g) ΔH=b kJ·mol-1
CoFe2O4(s)+3Al2O3(s)+H2(g) ΔH=b kJ·mol-1第Ⅱ步反应的v正=k正·c(H2O),v逆=k逆·c(H2),k正、k逆分别为正、逆反应速率常数,仅与温度有关。1 000 ℃时,在体积为1 L的B反应器中加入2 mol H2O发生上述反应,测得H2O(g)和H2物质的量浓度随时间的变化如图2所示,则60 min内,v(CoFe2O4)=

(2)在T2 K、1.0×104 kPa下,等物质的量的CO与CH4混合气体发生如下反应:CO(g)+CH4(g)
 CH3CHO(g)。反应速率v正-v逆=k正p(CO)·p(CH4)-k逆·p(CH3CHO),k正、k逆分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5,则CO转化率为20%时,
CH3CHO(g)。反应速率v正-v逆=k正p(CO)·p(CH4)-k逆·p(CH3CHO),k正、k逆分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5,则CO转化率为20%时, =
=
您最近一年使用:0次
名校
解题方法
9 . 回答下列问题
(1)在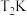 、
、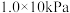 下,等物质的量的CO与
下,等物质的量的CO与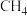 混合气体发生如下反应:
混合气体发生如下反应: 。反应速率
。反应速率 ,
, 、
、 分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压
分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压 体积分数)。用气体分压表示的平衡常数
体积分数)。用气体分压表示的平衡常数 ,则CO转化率为20%时,
,则CO转化率为20%时,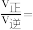
_______ 。
(2)探索氮氧化合物反应的特征及机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:
 可发生二聚反应生成
可发生二聚反应生成 ,化学方程式为
,化学方程式为 ,上述反应达到平衡后,升高温度可使体系颜色加深。已知该反应的正反应速率方程为
,上述反应达到平衡后,升高温度可使体系颜色加深。已知该反应的正反应速率方程为 ,逆反应速率方程为
,逆反应速率方程为 ,其中
,其中 、
、 分别为正、逆反应的速率常数。则图lgk表示速率常数的对数;图中A、B、C、D点的纵坐标分别为
分别为正、逆反应的速率常数。则图lgk表示速率常数的对数;图中A、B、C、D点的纵坐标分别为 、
、 ,
, ,
,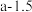 ,则温度T1时化学平衡常数K=
,则温度T1时化学平衡常数K=_______  。上述反应达到平衡后,继续通入一定量的
。上述反应达到平衡后,继续通入一定量的 ,则
,则 的平衡转化率将
的平衡转化率将_______ , 的体积分数将
的体积分数将_______ (填“增大”“减小”或“不变”)。

(3)反应 的反应机理如下:
的反应机理如下:
①第一步: (快速平衡)
(快速平衡)
第二步: (快速平衡)
(快速平衡)
第三步: (慢反应)
(慢反应)
②只需一步完成的反应称为基元反应,基元反应如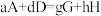 的速率方程,
的速率方程,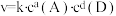 ,k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。
,k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。 与
与 反应生成
反应生成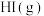 的速率方程为v=
的速率方程为v=_______  (用含
(用含 、
、 、
、 …的代数式表示)。
…的代数式表示)。
(4)硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是 的,催化氧化:
的,催化氧化:
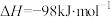 。将组成(物质的量分数)为2m%
。将组成(物质的量分数)为2m%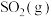 、m%
、m% 和q%
和q% 的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若
的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若 转化率为
转化率为 ,则
,则 压强为
压强为_______ ,平衡常数
_______ (以分压表示,分压=总压×物质的量分数)
(1)在
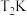 、
、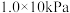 下,等物质的量的CO与
下,等物质的量的CO与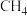 混合气体发生如下反应:
混合气体发生如下反应: 。反应速率
。反应速率 ,
, 、
、 分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压
分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压 体积分数)。用气体分压表示的平衡常数
体积分数)。用气体分压表示的平衡常数 ,则CO转化率为20%时,
,则CO转化率为20%时,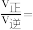
(2)探索氮氧化合物反应的特征及机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:
 可发生二聚反应生成
可发生二聚反应生成 ,化学方程式为
,化学方程式为 ,上述反应达到平衡后,升高温度可使体系颜色加深。已知该反应的正反应速率方程为
,上述反应达到平衡后,升高温度可使体系颜色加深。已知该反应的正反应速率方程为 ,逆反应速率方程为
,逆反应速率方程为 ,其中
,其中 、
、 分别为正、逆反应的速率常数。则图lgk表示速率常数的对数;图中A、B、C、D点的纵坐标分别为
分别为正、逆反应的速率常数。则图lgk表示速率常数的对数;图中A、B、C、D点的纵坐标分别为 、
、 ,
, ,
,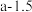 ,则温度T1时化学平衡常数K=
,则温度T1时化学平衡常数K= 。上述反应达到平衡后,继续通入一定量的
。上述反应达到平衡后,继续通入一定量的 ,则
,则 的平衡转化率将
的平衡转化率将 的体积分数将
的体积分数将
(3)反应
 的反应机理如下:
的反应机理如下:①第一步:
 (快速平衡)
(快速平衡)第二步:
 (快速平衡)
(快速平衡)第三步:
 (慢反应)
(慢反应)②只需一步完成的反应称为基元反应,基元反应如
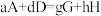 的速率方程,
的速率方程,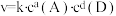 ,k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。
,k为常数;非基元反应由多个基元反应组成,非基元反应的速率方程可由反应机理推定。 与
与 反应生成
反应生成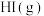 的速率方程为v=
的速率方程为v= (用含
(用含 、
、 、
、 …的代数式表示)。
…的代数式表示)。(4)硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是
 的,催化氧化:
的,催化氧化:
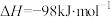 。将组成(物质的量分数)为2m%
。将组成(物质的量分数)为2m%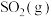 、m%
、m% 和q%
和q% 的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若
的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若 转化率为
转化率为 ,则
,则 压强为
压强为
您最近一年使用:0次
名校
解题方法
10 .  超干重整
超干重整 技术可得到富含CO的化工原料。
技术可得到富含CO的化工原料。
(1)其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应 进行相同时间后,
进行相同时间后, 的转化率随反应温度的变化如图所示。
的转化率随反应温度的变化如图所示。

a点所代表的状态_______ (填“是”或“不是”)平衡状态;b点 的转化率高于c点,原因是
的转化率高于c点,原因是_______ 。
(2)恒温恒容刚性密闭容器中, 和
和 的分压分别为20kPa、25kPa,加入
的分压分别为20kPa、25kPa,加入 催化剂使其发生反应
催化剂使其发生反应 。
。
①研究表明CO的生成速率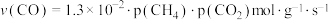 ,某时刻测得
,某时刻测得 ,则
,则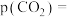
_______ kPa,
_______  。
。
②达到平衡后测得体系压强是起始时的1.8倍,则该反应的平衡常数的计算式 为
_______  。(用各物质的分压代替物质的量浓度计算)
。(用各物质的分压代替物质的量浓度计算)
 超干重整
超干重整 技术可得到富含CO的化工原料。
技术可得到富含CO的化工原料。(1)其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应
 进行相同时间后,
进行相同时间后, 的转化率随反应温度的变化如图所示。
的转化率随反应温度的变化如图所示。
a点所代表的状态
 的转化率高于c点,原因是
的转化率高于c点,原因是(2)恒温恒容刚性密闭容器中,
 和
和 的分压分别为20kPa、25kPa,加入
的分压分别为20kPa、25kPa,加入 催化剂使其发生反应
催化剂使其发生反应 。
。①研究表明CO的生成速率
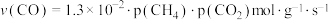 ,某时刻测得
,某时刻测得 ,则
,则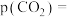

 。
。②达到平衡后测得体系压强是起始时的1.8倍,则该反应的平衡常数的

 。(用各物质的分压代替物质的量浓度计算)
。(用各物质的分压代替物质的量浓度计算)
您最近一年使用:0次
2022-10-09更新
|
320次组卷
|
2卷引用:湖南省常德市临澧县第一中学2022-2023学年高二上学期第一次阶段性考试化学试题



