1 . 氨的合成反应是一个可逆反应:N2(g)+3H2(g) 2NH3(g)。已知298K时:∆H=-92.2kJ·mol-1,∆S=-198.2J·K·mol-1。
2NH3(g)。已知298K时:∆H=-92.2kJ·mol-1,∆S=-198.2J·K·mol-1。
请与同学们交流研讨:
(1)根据反应的焓变和熵变分析298K下氨的合成反应能否正向自发进行____ 。
(2)利用化学平衡移动的知识分析什么条件有利于氨的合成____ 。
 2NH3(g)。已知298K时:∆H=-92.2kJ·mol-1,∆S=-198.2J·K·mol-1。
2NH3(g)。已知298K时:∆H=-92.2kJ·mol-1,∆S=-198.2J·K·mol-1。请与同学们交流研讨:
(1)根据反应的焓变和熵变分析298K下氨的合成反应能否正向自发进行
(2)利用化学平衡移动的知识分析什么条件有利于氨的合成
您最近一年使用:0次
解题方法
2 . 【情境问题思考】
请观察下列反应,思考以下问题。
①2H2O2(aq)=2H2O(l)+O2(g)
②NH4HCO3(s)+CH3COOH(aq)=CO2(g)+CH3COONH4(aq)+H2O(l)
③C(s,石墨)+H2O(g)=CO(g)+H2(g)
④CaCO3(s) CaO(s)+CO2(g)
CaO(s)+CO2(g)
⑤2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s) ΔS=-39.4J·mol-1·K-1
(1)判断①~④的ΔS是的正负,并解释理由____ 。
(2)熵增反应一定能自发进行吗____ ?熵减反应一定不能自发进行吗____ ?
(3)判断熵变ΔS与能否自发进行的关系____ ?
请观察下列反应,思考以下问题。
①2H2O2(aq)=2H2O(l)+O2(g)
②NH4HCO3(s)+CH3COOH(aq)=CO2(g)+CH3COONH4(aq)+H2O(l)
③C(s,石墨)+H2O(g)=CO(g)+H2(g)
④CaCO3(s)
 CaO(s)+CO2(g)
CaO(s)+CO2(g)⑤2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s) ΔS=-39.4J·mol-1·K-1
(1)判断①~④的ΔS是的正负,并解释理由
(2)熵增反应一定能自发进行吗
(3)判断熵变ΔS与能否自发进行的关系
您最近一年使用:0次
3 . 碘盐不断受热受潮易发生反应 ,下列判断正确的是
,下列判断正确的是
 ,下列判断正确的是
,下列判断正确的是A.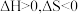 | B. | C. | D. |
您最近一年使用:0次
2022-01-21更新
|
297次组卷
|
4卷引用:化学反应速率与化学平衡——课时6化学反应的方向
(已下线)化学反应速率与化学平衡——课时6化学反应的方向山西省吕梁市2021-2022学年高二上学期期末考试化学试题广东省湛江市2021-2022学年高二上学期期末调研考试化学试题河南省许平汝联盟2021-2022学年高二下学期开学考试化学试题
名校
解题方法
4 . 在图甲中的A、B两容器里,分别收集着两种互不作用的理想气体。若将中间活塞打开(如图乙所示),两种气体分子立即都分布在两个容器中。这是一个不伴随能量变化的自发过程。关于此过程的下列说法不正确的是。
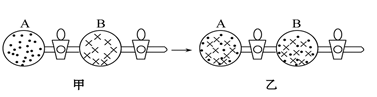

| A.此过程为混乱程度小向混乱程度大的方向的变化过程,即熵增大的过程 |
| B.此过程为自发过程,而且没有热量的吸收或放出 |
| C.此过程从有序到无序,混乱度增大 |
| D.此过程是自发可逆的 |
您最近一年使用:0次
2022-01-17更新
|
315次组卷
|
24卷引用:同步君 选修4 第2章 第4节 化学反应进行的方向
(已下线)同步君 选修4 第2章 第4节 化学反应进行的方向(已下线)2.2.1 化学反应的方向(基础练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第1节 化学反应的方向高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第三节 化学反应的方向鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第1节 化学反应的方向人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第三节 化学反应的方向选择性必修1(SJ)专题2第二单元课时1 化学反应的方向选择性必修1 专题2 第二单元 课时1 化学反应的方向(已下线)2.3 化学反应的方向(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)2.2.1化学反应的方向 课中2014-2015学年湖北省枣阳市高级中学高二下学期期末化学试卷高中化学人教版 选修四 第二章 化学反应速率和化学平衡 第四节 化学反应进行的方向 化学反应进行的方向(已下线)2018年9月26日《每日一题》人教选修4-化学反应方向的判断人教版高二化学选修4 第二章 第四节 化学反应进行的方向练习题辽宁省联合校2020-2021学年高二上学期第一次月考化学试题新疆生产建设兵团第四师第一中学2020-2021学年高二上学期期中考试化学试题辽宁省大连市普兰店区第三十八中学2020-2021学年高二上学期期末考试化学试题(已下线)作业05 化学反应的方向-2021年高二化学暑假作业(人教版2019)湖北省部分高中联考协作体2021-2022学年高二上学期期中考试化学试题(已下线)第05练 化学反应的方向-2022年【寒假分层作业】高二化学(人教版2019选择性必修1)(已下线)2.2.1 化学反应的方向(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)山东省德州市2020-2021学年高二上学期反应原理月考(A)化学试题(已下线)2.1 化学反应的方向-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)云南省文山州第一中学2021-2022学年高二下学期3月份考试化学试题
2021高二·全国·专题练习
5 . 工业上用赤铁矿生产铁,可以选择的还原剂有C和H2.根据所学知识判断:哪一种还原剂可使反应自发进行的温度较低?___________
已知:Fe2O3(s)+ C(s)=2Fe(s)+
C(s)=2Fe(s)+ CO2(g) ΔH=233.8 kJ·mol-1,ΔS=0.279 kJ·mol-1·K-1
CO2(g) ΔH=233.8 kJ·mol-1,ΔS=0.279 kJ·mol-1·K-1
Fe2O3(s)+3H2(g)=2Fe(s)+3H2O(g) ΔH=98 kJ·mol-1,ΔS=0.144 2 kJ·mol-1·K-1
已知:Fe2O3(s)+
 C(s)=2Fe(s)+
C(s)=2Fe(s)+ CO2(g) ΔH=233.8 kJ·mol-1,ΔS=0.279 kJ·mol-1·K-1
CO2(g) ΔH=233.8 kJ·mol-1,ΔS=0.279 kJ·mol-1·K-1Fe2O3(s)+3H2(g)=2Fe(s)+3H2O(g) ΔH=98 kJ·mol-1,ΔS=0.144 2 kJ·mol-1·K-1
您最近一年使用:0次
6 . 工业上,以煤炭为原料,通入一定比例的空气和水蒸气,经过系列反应可以得到满足不同需求的原料气。请回答:
(1)在C和O2的反应体系中:
反应1:C(s)+O2(g)=CO2(g) ΔH1=-394kJ·mol-1
反应2:2CO(g)+O2(g)=2CO2(g) ΔH2=-566kJ·mol-1
反应3:2C(s)+O2(g)=2CO(g) ΔH3。
① 设y=ΔH-TΔS,反应1、2和3的y随温度的变化关系如图1所示。图中对应于反应3的线条是______ 。

②一定压强下,随着温度的升高,气体中CO与CO2的物质的量之比______ 。
A.不变 B.增大 C.减小 D.无法判断
(2)水煤气反应:C(s)+H2O(g)=CO(g)+H2(g) ΔH=131kJ·mol-1。工业生产水煤气时,通常交替通入 合适量的空气和水蒸气与煤炭反应,其理由是________ 。
(3)一氧化碳变换反应:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41kJ·mol-1。
①一定温度下,反应后测得各组分的平衡压强(即组分的物质的量分数×总压):p(CO)=0.25MPa、p(H2O)=0.25MPa、p(CO2)=0.75MPa和p(H2)=0.75MPa,则反应的平衡常数K的数值为________ 。
②维持与题①相同的温度和总压,提高水蒸气的比例,使CO的平衡转化率提高到90%,则原料气中水蒸气和CO的物质的量之比为________ 。
③生产过程中,为了提高变换反应的速率,下列措施中合适的是________ 。
A.反应温度愈高愈好 B.适当提高反应物压强
C.选择合适的催化剂 D.通入一定量的氮气
④以固体催化剂M催化变换反应,若水蒸气分子首先被催化剂的活性表面吸附而解离,能量-反应过程如图2所示。

用两个化学方程式表示该催化反应历程(反应机理):步骤Ⅰ:________ ;步骤Ⅱ:________ 。
(1)在C和O2的反应体系中:
反应1:C(s)+O2(g)=CO2(g) ΔH1=-394kJ·mol-1
反应2:2CO(g)+O2(g)=2CO2(g) ΔH2=-566kJ·mol-1
反应3:2C(s)+O2(g)=2CO(g) ΔH3。
① 设y=ΔH-TΔS,反应1、2和3的y随温度的变化关系如图1所示。图中对应于反应3的线条是

②一定压强下,随着温度的升高,气体中CO与CO2的物质的量之比
A.不变 B.增大 C.减小 D.无法判断
(2)水煤气反应:C(s)+H2O(g)=CO(g)+H2(g) ΔH=131kJ·mol-1。工业生产水煤气时,通常
(3)一氧化碳变换反应:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41kJ·mol-1。
①一定温度下,反应后测得各组分的平衡压强(即组分的物质的量分数×总压):p(CO)=0.25MPa、p(H2O)=0.25MPa、p(CO2)=0.75MPa和p(H2)=0.75MPa,则反应的平衡常数K的数值为
②维持与题①相同的温度和总压,提高水蒸气的比例,使CO的平衡转化率提高到90%,则原料气中水蒸气和CO的物质的量之比为
③生产过程中,为了提高变换反应的速率,下列措施中合适的是
A.反应温度愈高愈好 B.适当提高反应物压强
C.选择合适的催化剂 D.通入一定量的氮气
④以固体催化剂M催化变换反应,若水蒸气分子首先被催化剂的活性表面吸附而解离,能量-反应过程如图2所示。

用两个化学方程式表示该催化反应历程(反应机理):步骤Ⅰ:
您最近一年使用:0次
2022-01-12更新
|
9407次组卷
|
11卷引用:章末检测卷(二) 化学反应速率与化学平衡
章末检测卷(二) 化学反应速率与化学平衡河南省许昌市建安区第一高级中学2023-2024学年高二上学期10月月考化学试题2022 年1月浙江省普通高校招生选考科目考试化学试题(已下线)回归教材重难点09 化学反应原理综合-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)2022年浙江1月高考真题变式题(26-31)(已下线)考点23 化学平衡常数-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)易错点22 化学反应平衡和移动-备战2023年高考化学考试易错题湖南省岳阳市华容县普通高中2023届高三新高考适应性考试化学试题(已下线)专题17 原理综合题(已下线)专题17 原理综合题河南省濮阳市油田第一中学2024届高三第四次考试理科综合化学试题
7 . AB型强电解质在水中的溶解(可视作特殊的化学反应)表示为AB(s)=An+(aq)+Bn-(aq),其焓变和熵变分别为ΔH和ΔS。对于不同组成的AB型强电解质,下列说法正确的是
| A.ΔH和ΔS均大于零 |
| B.ΔH和ΔS均小于零 |
| C.ΔH可能大于零或小于零,ΔS大于零 |
| D.ΔH和ΔS均可能大于零或小于零 |
您最近一年使用:0次
2022-01-12更新
|
4570次组卷
|
11卷引用:模块综合检测卷2
模块综合检测卷2第二章 化学反应速率与化学平衡 第三节 化学反应的方向上海市吴淞中学2023-2024学年高二上学期期中考试化学试题2022 年1月浙江省普通高校招生选考科目考试化学试题(已下线)2022年浙江1月高考真题变式题(11-20)(已下线)考点24 化学反应的方向-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第28练 化学反应的方向-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第20讲 化学平衡常数及转化率的计算(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)考点24 化学反应的方向(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第5讲 化学反应的调控(已下线)化学反应的方向及其调控
21-22高二·全国·课后作业
名校
8 . 以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应: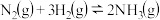 ∆H<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则平衡时c(N2)=
∆H<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则平衡时c(N2)=_______ 。平衡时H2的转化率为_______ %。
(2)平衡后,若提高H2的转化率,可以采取的措施有_______。
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应: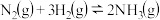 ∆H<0,其化学平衡常数K与温度T的关系如表所示:
∆H<0,其化学平衡常数K与温度T的关系如表所示:
请完成下列问题:
①写出化学平衡常数K的表达式_______ 。
②试比较K1、K2的大小,K1_______ K2(填“>”、“<”或“=”);
③400℃时,反应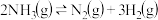 的化学平衡常数为
的化学平衡常数为_______ 。当测得NH3、N2和H2物质的量分别为3mol、2mol和2mol时,则该反应的v(N2)正_______ v(N2)逆(填“>”、“<”或“=”)。
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应:
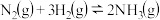 ∆H<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则平衡时c(N2)=
∆H<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则平衡时c(N2)=(2)平衡后,若提高H2的转化率,可以采取的措施有_______。
| A.加了催化剂 | B.增大容器体积 |
| C.降低反应体系的温度 | D.加入一定量N2 |
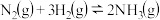 ∆H<0,其化学平衡常数K与温度T的关系如表所示:
∆H<0,其化学平衡常数K与温度T的关系如表所示:| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①写出化学平衡常数K的表达式
②试比较K1、K2的大小,K1
③400℃时,反应
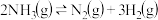 的化学平衡常数为
的化学平衡常数为
您最近一年使用:0次
2021-12-26更新
|
1511次组卷
|
6卷引用:2.4 化学反应的调控(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)
(已下线)2.4 化学反应的调控(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)甘肃省张掖市第二中学2021-2022学年高二上学期期末考试化学试题西藏拉萨市第二高级中学2021-2022学年高二上学期期中考试化学试题(已下线)第二章 化学反应速率与化学平衡(B卷·能力提升练)【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)四川省成都市第八中学校2022-2023学年高二上学期11月期中考试化学试题四川省达州外国语学校2023-2024学年高二上学期12月月考化学试题
名校
解题方法
9 . 下列对化学反应预测正确的是
| 选项 | 化学方程式 | 已知条件 | 预测 |
| A |  | 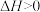 | 它是非自发反应 |
| B | 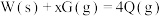 | 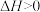 ,自发反应 ,自发反应 | x可能等于1、2、3 |
| C |  | 能自发反应 |  一定小于0 一定小于0 |
| D |  | 常温下,自发进行 | 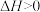 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-12-21更新
|
171次组卷
|
4卷引用:化学反应速率与化学平衡——课时6化学反应的方向
(已下线)化学反应速率与化学平衡——课时6化学反应的方向重庆市万州第二高级中学2021-2022学年高二上学期期中考试化学试题浙江省金华市东阳市2022届高三下学期5月模拟考试化学试题(已下线)考点24 化学反应的方向(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
解题方法
10 . 研究化学反应进行的方向对于反应设计等具有重要意义,下列说法正确的是
A. 、 、 的反应在温度低时不能自发进行 的反应在温度低时不能自发进行 |
| B.在其他外界条件不变的情况下,汽车排气管中使用催化剂,可以改变产生尾气的反应的方向 |
C.反应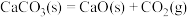 在室温下不能自发进行,说明该反应的 在室温下不能自发进行,说明该反应的 |
D.高温下, 反应能自发进行,则其 反应能自发进行,则其 、 、 |
您最近一年使用:0次
2021-12-21更新
|
352次组卷
|
14卷引用:选择性必修1(SJ)专题2第二单元课时1 化学反应的方向
选择性必修1(SJ)专题2第二单元课时1 化学反应的方向2.2.1化学反应的方向 课后章末检测卷(二)化学反应的方向、限度与速率甘肃省庆阳市第六中学2020-2021学年高二上学期期中考试化学(理)试题吉林省长春市农安县五校联考2020-2021学年高二上学期期末考试化学试题吉林省长春外国语学校2021-2022学年高二上学期第一次月考化学试题甘肃省民乐县第一中学2021--2022学年高二上学期期中考试化学试题(已下线)专题2 综合评价(2)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)天津市实验中学滨海学校2021-2022学年高二上学期期中质量监测化学试题湖南省常德市西洞庭管理区第一中学2022-2023学年高二上学期第二次月考化学试题山西大学附属中学校2022-2023学年高二上学期11月期中考试化学试题海南省三亚第一中学2023-2024学年高二上学期第一次月考化学试题 福建省福清西山学校2023-2024学年高二上学期12月月考化学试题河北省石家庄市第二中学2019-2020学年高一下学期期末考试化学试题



