解题方法
1 . 回答下列问题
(1)已知 (次磷酸)的水溶液中存在
(次磷酸)的水溶液中存在 分子。
分子。 与足量
与足量 溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为
溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为___________ 。
(2)常温下,用 溶液吸收
溶液吸收 得到
得到 的
的 溶液,吸收过程中水的电离平衡
溶液,吸收过程中水的电离平衡___________ (填“向左”、“向右”或“不”)移动。试计算该溶液中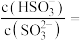
___________ (常温下 的电离平衡常数
的电离平衡常数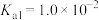 ,
, )。
)。
(3)保险粉样品中 的纯度(质量分数)可通过氧化还原滴定法来测定,反应的离子方程式为
的纯度(质量分数)可通过氧化还原滴定法来测定,反应的离子方程式为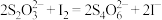 。准确称取
。准确称取 样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用
样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用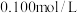 碘的标准溶液进行滴定,判断达到滴定终点的操作和现象是
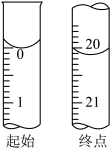
碘的标准溶液进行滴定,判断达到滴定终点的操作和现象是___________ 。滴定起始和终点的液面位置如图所示。则样品的纯度为___________ 。(设 的摩尔质量为
的摩尔质量为 )
)
(4)化工生产中常用 作沉淀剂除去工业废水中的
作沉淀剂除去工业废水中的 ,其反应原理为
,其反应原理为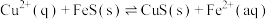 。下列有关叙述正确的是
。下列有关叙述正确的是___________ 。
a、
b、达到平衡时
c、该反应平衡常数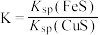
(1)已知
 (次磷酸)的水溶液中存在
(次磷酸)的水溶液中存在 分子。
分子。 与足量
与足量 溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为
溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为(2)常温下,用
 溶液吸收
溶液吸收 得到
得到 的
的 溶液,吸收过程中水的电离平衡
溶液,吸收过程中水的电离平衡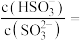
 的电离平衡常数
的电离平衡常数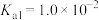 ,
, )。
)。(3)保险粉样品中
 的纯度(质量分数)可通过氧化还原滴定法来测定,反应的离子方程式为
的纯度(质量分数)可通过氧化还原滴定法来测定,反应的离子方程式为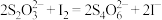 。准确称取
。准确称取 样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用
样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用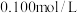 碘的标准溶液进行滴定,判断达到滴定终点的操作和现象是
碘的标准溶液进行滴定,判断达到滴定终点的操作和现象是 的摩尔质量为
的摩尔质量为 )
)
(4)化工生产中常用
 作沉淀剂除去工业废水中的
作沉淀剂除去工业废水中的 ,其反应原理为
,其反应原理为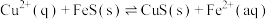 。下列有关叙述正确的是
。下列有关叙述正确的是a、

b、达到平衡时

c、该反应平衡常数
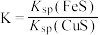
您最近一年使用:0次
2 . 已知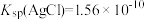 ,
,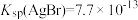 ,
, 。某溶液中含有
。某溶液中含有 、
、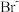 和
和 ,浓度均为0.010
,浓度均为0.010 ,向该溶液中逐滴加入0.010
,向该溶液中逐滴加入0.010 的
的 溶液时,三种阴离子产生沉淀的先后顺序为
溶液时,三种阴离子产生沉淀的先后顺序为
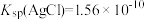 ,
,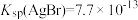 ,
, 。某溶液中含有
。某溶液中含有 、
、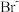 和
和 ,浓度均为0.010
,浓度均为0.010 ,向该溶液中逐滴加入0.010
,向该溶液中逐滴加入0.010 的
的 溶液时,三种阴离子产生沉淀的先后顺序为
溶液时,三种阴离子产生沉淀的先后顺序为A. | B. |
C. | D.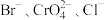 |
您最近一年使用:0次
2023-12-31更新
|
248次组卷
|
100卷引用:湖南省长沙市明德中学2022-2023学年高二上学期期中考试化学试题
湖南省长沙市明德中学2022-2023学年高二上学期期中考试化学试题(已下线)2013-2014学年湖南省常德市一中高二上学期第二次检测理科化学试卷2015-2016学年湖南省株洲十八中高二上学期期末理化学试卷四川省绵阳市盐亭中学2021-2022学年高二下学期4月月考化学试题四川省遂宁市第二中学校2021-2022学年高二下学期半期考试化学试题(已下线)考点29 沉淀溶解平衡-备战2023年高考化学一轮复习考点帮(全国通用)第四节 沉淀溶解平衡 第2课时 沉淀溶解平衡的应用(已下线)3.4.1 沉淀溶解平衡-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)四川省成都市第七中学2023届高三上学期零诊模拟考试化学试题广东省江门市第一中学2022-2023学年高二上学期第二次月考化学试题(已下线)3.4 沉淀溶解平衡-同步学习必备知识河北省邯郸市永年区第二中学2022-2023学年高二上学期12月月考化学试题黑龙江省伊春市伊美区第二中学2022-2023学年高二上学期期中化学试题广东番禺中学2022-2023学年高二上学期期末测试化学试题2013年全国普通高等学校招生统一考试理科综合能力测试化学(新课标Ⅰ卷)(已下线)2013-2014重庆市重庆八中下学期高二期中考试化学试卷(已下线)2013-2014福建省安溪八中高二下学期期末考试化学试卷2014-2015河南省濮阳市一中高二上学期第三次质量检测化学试卷2014-2015河南省濮阳市一中高二上学期第三次月考化学试卷2014-2015湖北省武汉华中师大附高二上学期期末化学试卷2014-2015广西桂林市第十八中学高二下学期期中考试化学试卷2015-2016学年山西省太原五中高二上12月月考化学试卷12015-2016学年山西省太原五中高二上12月月考化学试卷22015-2016学年黑龙江省哈尔滨三中高二上期末化学试卷2015-2016学年贵州省凯里一中高二上学期期末化学试卷2015-2016学年宁夏育才中学高二上期末考试化学试卷2016届山东省寿光现代中学高三下学期开学检测化学试卷2016届山东省青岛市高三上学期期末考试化学试卷2015-2016学年福建省龙海市程溪中学高二下学期期中化学试卷2015-2016学年广西桂林十八学高二下期中化学试卷2016-2017学年河北省邯郸一中高二上期中化学卷2016-2017学年宁夏育才中学高二上月考二化学卷22016-2017学年西藏拉萨中学高二上期末化学试卷2016-2017学年河北省张家口市高二上学期期末考试化学试卷2016-2017学年河北省邯郸市高二上学期期末考试化学试卷广西桂林市桂林中学2016-2017学年高二下学期期中考试化学试题四川省成都市双流中学2016-2017学年高二5月月考化学试题内蒙古北京八中乌兰察布分校2016-2017学年高二下学期期末考试化学试题2018版化学(苏教版)高考总复习专题八对接高考精练--难溶电解质的沉淀溶解平衡福建省福州市第八中学2016-2017学年高二下学期期末考试(理)化学试题河北省定州中学2017-2018学年高二上学期开学考试化学试题贵州省遵义航天高级中学2017-2018学年高二上学期第三次月考理综(理)化学试题天津市静海县第一中学2017-2018学年高二12月学生学业能力调研考试化学试题山西省大同市第一中学2017-2018学年高二上学期期末考试化学试题(已下线)2018年11月15日 《每日一题》人教选修4-溶度积的应用【全国百强校】甘肃省天水市一中2018-2019学年高二(理)上学期第二学段考试化学试题安徽省滁州市定远县民族中学2018-2019学年高二上学期12月月考化学试题内蒙古集宁一中西校区2017-2018学年高二上学期期中考试化学试题云南省保山市第一中学2018-2019学年高二下学期期末化学试题安徽省太和第一中学2019-2020学年高二上学期第一次月考(飞越班)化学试题(已下线)2019年11月14日 《每日一题》人教版(选修4)——溶度积的应用夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——溶度积常数及相关计算(强化练习)重庆市凤鸣山中学2018-2019学年高二上学期期中考试化学试题湖北省黄冈市黄梅国际育才高级中学2019-2020学年高二上学期10月月考化学试题鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡 课时1 沉淀溶解平衡及其应用鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 课时1 溶解平衡及其应用(已下线)第03章 物质在水溶液中的行为 (B卷能力提升卷) -2020-2021学年高二化学选择性必修1同步单元AB卷(新教材鲁科版)内蒙古通辽市开鲁县第一中学2021届高三上学期第一次月考化学试题人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 方法帮黑龙江省鹤岗市第一中学2020-2021学年高二10月月考化学试题黑龙江绥化市第一中学2020-2021学年高二上学期第一次月考化学试题 (已下线)第03章 水溶液中的离子反应与平衡(B卷能力提高篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)(已下线)易错17 难溶电解质的溶解平衡及应用-备战2021年高考化学一轮复习易错题(已下线)第28讲 难溶电解质的溶解平衡 (精练)-2021年高考化学一轮复习讲练测重庆市万州第三中学2020-2021学年高二上学期期中考试化学试题(已下线)3.4 难溶电解质的溶解平衡(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)吉林省长春市第二十九中学2020-2021学年高二上学期期末考试化学试题(已下线)练习14 难溶电解质的沉淀溶解平衡-2020-2021学年【补习教材·寒假作业】高二化学(苏教版)吉林省长春市清蒲中学2020-2021学年度高二上学期期末化学试题甘肃省民勤县第一中学2020-2021学年高二下学期(理)开学考试化学试题山西省潞城第一中学2020-2021学年高二下学期3月月考化学试卷题江苏省盐城市阜宁中学2020-2021学年高二下学期期中考试化学试题云南省玉溪市华宁二中2020-2021学年高二下学期期中考试化学试题四川省绵阳市2020-2021学年高二下学期期末考试化学试题(已下线)考点26 难溶电解质的溶解平衡-备战2022年高考化学一轮复习考点帮(全国通用)云南省陆良县2019届高三毕业班第二次教学质量摸底考化学试题(已下线)课时45 难溶电解质的溶解平衡-2022年高考化学一轮复习小题多维练(全国通用)江西省靖安中学2020-2021学年高二上学期第二次月考化学试题(已下线)第24讲 沉淀溶解平衡(练) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第5讲 沉淀溶解平衡-【微专题·大素养】备战2022年高考化学核心突破(水溶液中的离子反应与平衡)山东省德州市2020-2021学年高二上学期反应原理月考(B)化学试题山东省淄博市桓台第二中学2021-2022学年高一9月月考化学试题黑龙江省双鸭山市第一中学2022-2023学年高二下学期开学考试化学试题吉林省洮南市第一中学2022-2023学年高二上学期期末考试化学试题四川省内江市第六中学2022-2023学年高二下学期第一次月考(创新班)化学试题(已下线)考点巩固卷09 水溶液中的离子反应与平衡(4大考点62题)-2024年高考化学一轮复习考点通关卷(新高考通用)第2课时 沉淀的溶解与生成、转化及应用第1课时 沉淀溶解平衡与溶度积河南省郑州市宇华实验学校2023-2024学年高三上学期开学(摸底)考试化学试题第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 第2课时 沉淀溶解平衡的应用新疆奎屯市第一高级中学2023-2024学年高二上学期期中考试化学试题(已下线)寒假作业07 沉淀溶解平衡-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)四川省泸州市合江县马街中学校2023-2024学年高二上学期11月期中化学试题(已下线)专题06 沉淀溶解平衡-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)陕西省咸阳市武功县普集高级中学2023-2024学年高二上学期12月月考化学试题陕西省汉中市西乡县第一中学2023-2024学年高二上学期12月月考化学试题宁夏石嘴山市第三中学2023-2024学年高二上学期第二次月考化学试题四川省眉山市仁寿县2023-2024学年高二上学期12月联考化学试题河北省衡水市安平中学2023-2024学年高二下学期开学考试化学试题
名校
3 . 下列有关化学用语的说法错误的是
A.用碳酸钠溶液浸泡锅炉水垢的原理: |
B. 溶液水解离子方程式: 溶液水解离子方程式: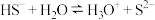 |
C.碳酸氢钠在水中的电离方程式为: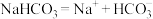 |
D.防蛀剂 微溶于水,其溶解平衡表达式为: 微溶于水,其溶解平衡表达式为: |
您最近一年使用:0次
4 . 已知:Ksp(AgCl)=1.8×10-10 ,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
| A.AgCl>AgI>Ag2CrO4 | B.AgCl>Ag2CrO4>AgI |
| C.Ag2CrO4>AgCl>AgI | D.Ag2CrO4>AgI>AgCl |
您最近一年使用:0次
2023-08-14更新
|
1006次组卷
|
54卷引用:湖南省长沙市宁乡市四校联考2022-2023学年高二上学期11月月考化学试题
湖南省长沙市宁乡市四校联考2022-2023学年高二上学期11月月考化学试题2014-2015湖南省怀化市中小学课改高二上学期期末化学试卷2015-2016学年湖南省衡阳县高二上学期期末统考化学试卷湖南省雅礼中学2019-2020学年高二上学期第一次月考化学试题湖南省长郡中学2020-2021学年高二上学期期中考试化学试题黑龙江省大庆中学2021-2022学年高二上学期期末考试化学试题(已下线)第33练 沉淀溶解平衡-2023年高考化学一轮复习小题多维练(全国通用)河南省新乡市第一中学2022-2023学年高二上学期第一次月考化学试题2010年普通高等学校招生全国统一考试化学试题(海南卷)2010年高考化学试题分项专题十 电解质溶液(已下线)2010年北京五中高二下学期期末考试化学试题(已下线)2010—2011学年山西省大同一中高二上学期期末考试化学试卷(已下线)2011-2012学年湖北省襄阳市四校高二上学期期中考试化学试卷(已下线)2011-2012学年江西省九江一中高二上学期第二次月考化学试卷(已下线)2011-2012学年江苏省南京三中高二下学期期末考试化学选修试卷(已下线)2011-2012学年河北省元氏一中高二上学期期中考试化学试卷(已下线)2012-2013学年山东省济宁市泗水一中高二12月质量检测化学试卷(已下线)2012-2013学年福建省南安一中高二上学期期末考试化学试卷(已下线)2013-2014学年湖北省恩施高中高二12月月考化学试卷2014-2015河北省隆化县存瑞中学高二下学期期中考试化学试卷2015-2016学年湖北省武汉三十九中高二上学期期末化学试卷2015-2016学年青海师大附属二中高二下4月月考化学试卷2015-2016学年福建师大附中高二下期中化学试卷2017届湖北省枣阳市高级中学高三上学期8月月考化学试卷2017届内蒙古赤峰二中高三上第二次月考化学试卷广西陆川县中学2017-2018学年高二上学期期中考试化学试题河北省衡水市安平中学2017-2018学年高二上学期期中考试化学试题高中化学人教版 选修四 第三章 水溶液中的离子反应 第四节 难溶电解质的溶解平衡 难溶电解质的溶解平衡内蒙古包头市第四中学2017-2018学年高二上学期期末考试化学试题(已下线)2018年11月15日 《每日一题》人教选修4-溶度积的应用【全国百强校】贵州省铜仁市第一中学2018-2019学年高二下学期开学考试化学试题步步为赢 高二化学暑假作业:作业十 水溶液中的离子平衡陕西省吴起高级中学2019-2020学年高二上学期期中考试化学(基础卷)试题(已下线)2019年11月13日 《每日一题》人教版(选修4)——溶度积的有关计算黑龙江省哈尔滨市第三中学2019-2020学年高二上学期期中考试化学(理)试题陕西省咸阳市西藏民族大学附属中学2019-2020学年高二上学期第二次月考化学试题2019年秋高三化学复习强化练习—— 与浓度积的相关计算(强化练)吉林省通化市梅河口市博文学校2019-2020学年高二上学期第二次月考化学试题(已下线)山东省邹城市2018-2019学年高二上学期12月月考化学试卷湖北省恩施州清江外国语学校2020-2021学年高二上学期10月月考化学试题河北省石家庄市辛集市第一中学2019-2020学年高二第二次考试(二)化学试题鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡(已下线)练习14 难溶电解质的沉淀溶解平衡-2020-2021学年【补习教材·寒假作业】高二化学(苏教版)贵州省蟠龙高级中学2020-2021学年高二上学期第二次月考化学试题云南省楚雄天人中学2021-2022学年高二上学期12月月考化学试题(B卷)湖北省罗田县第一中学2021-2022学年高二上学期12月月考化学试题山西省太原市英才学校2021-2022学年高二上学期第二次月考化学试题山东省潍坊第一中学2022-2023学年高二上学期期末考试化学试题(已下线)考点巩固卷09 水溶液中的离子反应与平衡(4大考点62题)-2024年高考化学一轮复习考点通关卷(新高考通用)第1课时 沉淀溶解平衡与溶度积作业(二十一) 沉淀溶解平衡与溶度积天津市第一中学2023-2024学年高二上学期期末考试化学试卷山东师大附中幸福柳分校2023-2024学年高二上学期12月份化学学科阶段性测试
解题方法
5 . 下列实验操作和现象与所得实验结论一致的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向 溶液中滴入几滴浓 溶液中滴入几滴浓 ,溶液橙色加深 ,溶液橙色加深 |  转化为 转化为 |
| B | 向含有少量 的 的 溶液中加入足量MgO粉末,搅拌一段时间后过滤 溶液中加入足量MgO粉末,搅拌一段时间后过滤 | 可除去 溶液中少量 溶液中少量 |
| C | 分别测定浓度均为 的 的 和 和 溶液的pH,后者大于前者 溶液的pH,后者大于前者 | 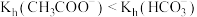 |
| D | 向2mL浓度均为 的NaCl、NaI的混合溶液中滴入2mL 的NaCl、NaI的混合溶液中滴入2mL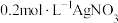 溶液,有黄色沉淀生成 溶液,有黄色沉淀生成 |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
6 . 自然界中,各种原生铜的硫化物经氧化,淋滤作用后可变成 溶液,并向深部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),便慢慢转变为铜蓝(CuS),发生的反应有
溶液,并向深部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),便慢慢转变为铜蓝(CuS),发生的反应有
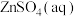 。下列说法不正确的是
。下列说法不正确的是
已知:常温下, ,
, ,
,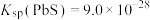
 溶液,并向深部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),便慢慢转变为铜蓝(CuS),发生的反应有
溶液,并向深部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),便慢慢转变为铜蓝(CuS),发生的反应有
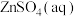 。下列说法不正确的是
。下列说法不正确的是已知:常温下,
 ,
, ,
,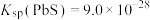
A.该反应达到平衡时, |
B.向含 、 、 、 、 均为 均为 的溶液中通入 的溶液中通入 气体,产生沉淀的顺序依次为CuS、PbS、ZnS 气体,产生沉淀的顺序依次为CuS、PbS、ZnS |
C.饱和PbS溶液中,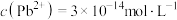 |
D.CuS溶解的条件是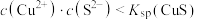 |
您最近一年使用:0次
名校
解题方法
7 . 下列实验能达到预期目的是
A.向含有酚酞的 溶液中加入少量 溶液中加入少量 固体,溶液红色变浅,证明 固体,溶液红色变浅,证明 溶液中存在水解平衡 溶液中存在水解平衡 |
B.室温下,用pH试纸测定浓度为0.1mol/LNaClO溶液和 溶液的pH,比较HClO和 溶液的pH,比较HClO和 的酸性强弱 的酸性强弱 |
C.等体积 的HX和HY两种酸分别与足量的锌粒反应,排水法收集气体,HX反应结束后放出的氢气多且反应过程中反应速率快,证明HX酸性比HY强 的HX和HY两种酸分别与足量的锌粒反应,排水法收集气体,HX反应结束后放出的氢气多且反应过程中反应速率快,证明HX酸性比HY强 |
D.向10mL0.2mol/LNaOH溶液中滴加2滴 溶液,产生白色沉淀后,再滴加2滴 溶液,产生白色沉淀后,再滴加2滴 溶液,又生成红褐色沉淀,证明在相同温度下Ksp: 溶液,又生成红褐色沉淀,证明在相同温度下Ksp: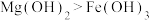 |
您最近一年使用:0次
2023-06-21更新
|
131次组卷
|
16卷引用:湖南省吉首市泸溪一中2022届高三第三次联合检测化学试题
湖南省吉首市泸溪一中2022届高三第三次联合检测化学试题湖南省长沙市南雅中学2022-2023学年高二上学期第三次月考化学试题广东省梅州市2021-2022学年高二上学期期末考试化学试题河南省南乐县第一高级中学2021-2022学年高二下学期3月月考化学试题江苏省泰州中学2021-2022学年高二下学期期中考试化学试题宁夏回族自治区银川一中2022-2023学年高二上学期期末考试化学试题山西省长治市第二中学2019-2020学年高二上学期第一次月考化学试题鲁科版(2019)选择性必修1 模块综合测评人教版(2019)高二选择性必修第一册 模块综合测评河南省安阳市第一中学2020-2021学年高二上学期期末考试化学试题江苏省南通市海安李堡中学2021-2022学年高二上学期期中考试化学试题江苏省徐州市沛县2022-2023学年高二下学期5月月考化学试题广西南宁市2022-2023学年高二下学期开学考试化学试题四川省遂宁市射洪中学校2023-2024学年高二上学期(强基班)11月月考化学试题新疆石河子第一中学2023-2024学年高二上学期12月月考化学试题安徽省合肥市第一中学2023-2024学年高二上学期12月月考化学试题
名校
解题方法
8 . 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、 (橙红色)、
(橙红色)、 (黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,K2Cr2O7溶液中存在如下平衡:
(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,K2Cr2O7溶液中存在如下平衡: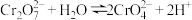
回答下列问题:
(1)探究外界因素对该平衡的影响。取三支相同(标号1,2,3)试管盛有相同体积 溶液进行实验,完成下列表格中的填空。
溶液进行实验,完成下列表格中的填空。
(2)利用(1)中所得溶液A、B探究pH对 溶液的氧化性强弱的影响。完成表格中的填空。
溶液的氧化性强弱的影响。完成表格中的填空。
(3)在化学分析中采用 为指示剂,以
为指示剂,以 标准溶液滴定溶液中的
标准溶液滴定溶液中的 ,利用
,利用 与
与 生成砖红色沉淀,指示到达滴定终点。滴定终点时,溶液中
生成砖红色沉淀,指示到达滴定终点。滴定终点时,溶液中 时,此时溶液中
时,此时溶液中 等于
等于_______  。[已知
。[已知 ]
]
 (橙红色)、
(橙红色)、 (黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,K2Cr2O7溶液中存在如下平衡:
(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,K2Cr2O7溶液中存在如下平衡: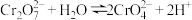
回答下列问题:
(1)探究外界因素对该平衡的影响。取三支相同(标号1,2,3)试管盛有相同体积
 溶液进行实验,完成下列表格中的填空。
溶液进行实验,完成下列表格中的填空。| 实验操作 | 实验现象 | 实验结论 |
| 向试管1中加入几滴浓NaOH溶液,得溶液A | 溶液变为① | 其他条件不变时,减小② |
| 向试管2中加入几滴较浓H2SO4溶液,得溶液B | 溶液变为④ | 其他条件不变时,增大生成物浓度,平衡向逆反应方向移动 |
| 向试管2中加入FeSO4,再加入适量NaOH溶液 | 先形成蓝紫色溶液,加入NaOH溶液后产生红褐色沉淀和⑤ | K2Cr2O7溶液具有氧化性,产物不溶于适量NaOH溶液 |
 溶液的氧化性强弱的影响。完成表格中的填空。
溶液的氧化性强弱的影响。完成表格中的填空。| 实验操作 | 实验现象 | 实验结论 |
| 相同量的溶液A、B中分别加入相同量甲醇溶液 | 向溶液A无明显现象,溶液B形成蓝紫色溶液 |
 为指示剂,以
为指示剂,以 标准溶液滴定溶液中的
标准溶液滴定溶液中的 ,利用
,利用 与
与 生成砖红色沉淀,指示到达滴定终点。滴定终点时,溶液中
生成砖红色沉淀,指示到达滴定终点。滴定终点时,溶液中 时,此时溶液中
时,此时溶液中 等于
等于 。[已知
。[已知 ]
]
您最近一年使用:0次
名校
9 . 根据下列实验操作和现象所得到的结论正确的是
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 将少量醋酸滴入 溶液中 溶液中 | 未产生明显气泡 | 酸性: |
| B | 向盛有相同体积、浓度的 溶液的两支试管中分别滴加 溶液的两支试管中分别滴加 和 和 HI溶液,观察出现棕黄色现象的时间 HI溶液,观察出现棕黄色现象的时间 | 后者出现棕黄色时间短 | 其他条件不变时,一般浓度越大,该反应化学反应速率越快 |
| C | 将装有相同质量 和 和 的混合气的两支烧瓶分别置于热水、冰水中 的混合气的两支烧瓶分别置于热水、冰水中 | 浸泡在热水中的烧瓶红棕色更深 |   |
| D | 向盛有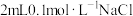 溶液滴加2滴等浓度 溶液滴加2滴等浓度 溶液,悬浊液静置,取上层清液,滴入少量稀NaI溶液 溶液,悬浊液静置,取上层清液,滴入少量稀NaI溶液 | 出现黄色沉淀 |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
10 . 某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A=H++HA-,HA- H++A2-。据此回答下列问题。
H++A2-。据此回答下列问题。
(1)Na2A溶液显______ (选填“酸性”、“碱性”、“中性”或“无法确定”)。
(2)在0.1mol/L的Na2A溶液中,下列粒子浓度关系式正确的是______ 。
(3)室温下,pH=10的氨水与pH=4的NH4C1溶液中,由水电离出的c(H+)之比为______ 。
(4)①NH4Al(SO4)2可作净水剂,其理由是______ 。(用必要的化学用语和相关文字说明)。
②相同条件下,0.1mol·L-1NH4Al(SO4)2溶液中c(NH )
)______ (填“等于”“大于”或“小于”)0.1mol·L-1NH4HSO4溶液中c(NH )。
)。
(5)已知Ksp(BaCO3)=2.6×l0-9,Ksp(BaSO4)=1.1×10-10。
①现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为____ mol/L。
②向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中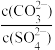 =
=______ (保留三位有效数字)。
 H++A2-。据此回答下列问题。
H++A2-。据此回答下列问题。(1)Na2A溶液显
(2)在0.1mol/L的Na2A溶液中,下列粒子浓度关系式正确的是
| A.0.1mol/L=c(HA-)+c(A2-)+c(H2A) |
| B.c(Na+)+c(OH-)=c(HA-)+c(H+) |
| C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-) |
| D.c(Na+)=2c(HA-)+2c(A2-) |
(4)①NH4Al(SO4)2可作净水剂,其理由是
②相同条件下,0.1mol·L-1NH4Al(SO4)2溶液中c(NH
 )
) )。
)。(5)已知Ksp(BaCO3)=2.6×l0-9,Ksp(BaSO4)=1.1×10-10。
①现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为
②向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中
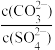 =
=
您最近一年使用:0次



