解题方法
1 . 磷化镉(Cd3P2)常用作杀虫剂。一种以镉铁矿(主要成分为CdO2,Fe2O3、FeO,还有少量的Al2O3和SiO2)为原料制备Cd3P2的工艺流程如图:
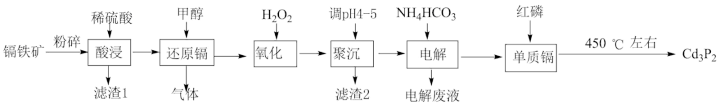
已知:25℃时,0.1mol·L-1相关金属离子形成氢氧化物沉淀的pH范围如表:
回答下列问题:
(1)镉铁矿“粉碎”的目的是_______ 。
(2)“还原镉”时,产生能使澄清石灰水变浑浊的气体,发生反应的离子方程式为_______ 。
(3)加入H2O2溶液的目的是_______ 。
(4)“滤渣2”所含物质的化学式是_______ 。
(5)工业生产中,有时采用阳离子交换树脂法来测定“聚沉”后溶液中Cd2+的含量,其原理是:Cd2++2NaR=2Na++CdR2,其中NaR为阳离子交换树脂。常温下,将“聚沉”后的溶液经过阳离子交换树脂后,测得溶液中的Na+比交换前增加了0.0048mol·L-1,若该条件下Cd(OH)2的Ksp=2.4×10-15,此时“聚沉”后溶液的pH=_______ 。
(6)电解制取Cd,Cd在_______ (填“阳极”或“阴极”)析出,阳极反应式为_______ 。

已知:25℃时,0.1mol·L-1相关金属离子形成氢氧化物沉淀的pH范围如表:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Cd2+ |
| 开始沉淀的pH | 1.7 | 6.3 | 3.1 | >7.0 |
| 沉淀完全的pH | 3.3 | 8.3 | 4.7 |
回答下列问题:
(1)镉铁矿“粉碎”的目的是
(2)“还原镉”时,产生能使澄清石灰水变浑浊的气体,发生反应的离子方程式为
(3)加入H2O2溶液的目的是
(4)“滤渣2”所含物质的化学式是
(5)工业生产中,有时采用阳离子交换树脂法来测定“聚沉”后溶液中Cd2+的含量,其原理是:Cd2++2NaR=2Na++CdR2,其中NaR为阳离子交换树脂。常温下,将“聚沉”后的溶液经过阳离子交换树脂后,测得溶液中的Na+比交换前增加了0.0048mol·L-1,若该条件下Cd(OH)2的Ksp=2.4×10-15,此时“聚沉”后溶液的pH=
(6)电解制取Cd,Cd在
您最近一年使用:0次
2 . 以印刷线路板的酸性蚀刻废液(主要成分为CuCl2、HCl)为原料可制备CuCl等产品,反应过程如图所示。已知CuCl难溶于水和乙醇,易溶于浓的NaCl溶液,原理为:CuCl(s)+Cl-(aq)
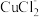 (aq),潮湿时易被空气氧化。
(aq),潮湿时易被空气氧化。
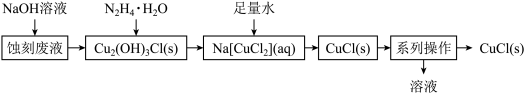
下列说法正确的是

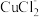 (aq),潮湿时易被空气氧化。
(aq),潮湿时易被空气氧化。
下列说法正确的是
A.加入N2H4•H2O的反应:2Cu(OH)3Cl+N2H4•H2O+2H++6Cl-=4 +N2↑+7H2O +N2↑+7H2O |
| B.加入足量水是为了溶解CuCl(s) |
| C.“系列操作”可以是:过滤、用蒸馏水洗涤固体、干燥固体 |
| D.蚀刻废液中可能存在[CuCl4]2- |
您最近一年使用:0次
3 . 废旧铅蓄电池会导致铅污染,RSR工艺回收铅的化工流程如图所示。
ii.Ksp(PbSO4)=1.6×10-8、Ksp(PbCO3)=7.4×10-14。
下列有关说法错误的是
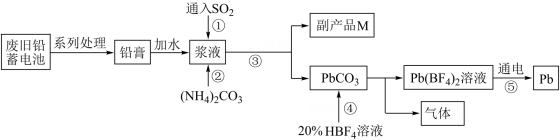
ii.Ksp(PbSO4)=1.6×10-8、Ksp(PbCO3)=7.4×10-14。
下列有关说法错误的是
A.步骤②中反应PbSO4(s)+ (aq)⇌PbCO3(s)+ (aq)⇌PbCO3(s)+ (aq)的化学平衡常数K约为2.2×105 (aq)的化学平衡常数K约为2.2×105 |
| B.操作③需要用的玻璃仪器有烧杯、漏斗、玻璃棒 |
| C.步骤④发生反应的离子方程式为PbCO3+2H+=Pb2++CO2↑+H2O |
| D.副产品M的主要成分是(NH4)2SO3 |
您最近一年使用:0次
2022-09-27更新
|
1918次组卷
|
6卷引用:湖南省永州市2023届高考第一次适应性考试化学试题
湖南省永州市2023届高考第一次适应性考试化学试题江苏省靖江市2022-2023学年高三上学期调研测试化学试题(已下线)专题三 离子反应-实战高考·二轮复习核心突破(已下线)2023年湖南卷高考真题变式题(选择题6-10)山东省青岛市第二中学2022-2023学年高二5月月考化学试题(已下线)选择题6-10
4 . 下表是五种银盐的溶度积常数(25℃),下列有关说法错误的是
| 化学式 | AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 溶度积 | 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 5.0×10-13 | 8.3×10-17 |
| A.五种物质在常温下溶解度最大的是Ag2SO4 |
| B.向AgCl的悬浊液中加入0.1mol/LNa2S溶液,则可以生成黑色的Ag2S沉淀 |
| C.外界条件改变时,沉淀溶解平衡也会发生移动 |
| D.常温下,向AgI的悬浊液中加入0.1mol/LNaCl溶液,黄色沉淀变成白色沉淀 |
您最近一年使用:0次
2022-09-26更新
|
212次组卷
|
2卷引用:湖南省邵阳邵东市第四中学2022-2023学年高二上学期期中考试化学试题
5 . 下列变化中属于吸热反应的是
| A.氢气与氧气点燃形成水 | B.灼热的炭与二氧化碳生成一氧化碳 |
| C.冰融化 | D.NH4NO3(s) NH NH (aq)+NO (aq)+NO (aq) (aq) |
您最近一年使用:0次
名校
解题方法
6 . 三氧化二铬(Cr2O3)可用作着色剂、分析试剂、催化剂等。一种利用铬铁矿(主要成分为FeO·Cr2O3,还含有Al2O3、SiO2等杂质)清洁生产Cr2O3的工艺流程如下:
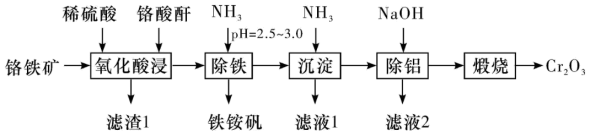
已知:
①金属离子开始沉淀与完全沉淀的pH如下:
②铬酸酐(CrO3)常用作氧化剂;
③铁铵矾的化学式为NH4Fe(SO4)2·12H2O,在pH=3时完全沉淀。
回答下列问题:
(1)“氧化酸浸”前,常将铬铁矿粉碎,目的是_______ ,滤渣1的成分是_______ 。
(2)铬酸酐的作用是_______ ,“氧化酸浸”时FeO·Cr2O3反应的化学方程式是_______ 。
(3)“沉淀”时,应调节pH不低于_______ ,滤液1的成分主要是_______ (填化学式)。
(4)“除铝”一步的离子方程式是_______ 。

已知:
①金属离子开始沉淀与完全沉淀的pH如下:
| 金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ |
| 开始沉淀的pH | 2.7 | 3.4 | 5.0 | 7.5 |
| 完全沉淀的pH | 3.7 | 4.9 | 5.9 | 9.7 |
③铁铵矾的化学式为NH4Fe(SO4)2·12H2O,在pH=3时完全沉淀。
回答下列问题:
(1)“氧化酸浸”前,常将铬铁矿粉碎,目的是
(2)铬酸酐的作用是
(3)“沉淀”时,应调节pH不低于
(4)“除铝”一步的离子方程式是
您最近一年使用:0次
名校
7 . 以废镍触媒(含NiO、MgO、CaO、Al2O3、Fe2O3及SiO2)为原料制备硫酸镍的工艺流程如图:
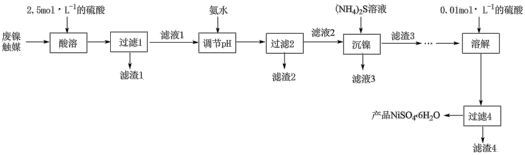
已知:①NiS不溶于水或稀硫酸;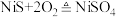 。
。
②该工艺流程条件下,有关金属离子开始沉淀和完全沉淀时的pH见下表:
回答下列问题:
(1)“酸溶”时,Al2O3溶解的化学方程式为_______ 。
(2)“滤渣1”的成分是SiO2和_______ (填化学式)。
(3)“滤液1”的pH约为1.8,在“调节pH”时用氨水逐步调节pH至6.3,依次析出的是_______ (填化学式)。
(4)从“沉镍”到“溶解”还需经过的操作是_______ ,“溶解”时用0.01mol·L-1的硫酸而不用水的原因是_______ 。
(5)“滤渣4”并入滤渣_______ (填“1”、“2”或“3”)可实现再利用。
(6)某工厂用2t该废镍触媒(NiO含量为75%)制备硫酸镍,设整个流程中Ni的损耗率为20%,最终得到NiSO4·6H2O的质量为_______ t。

已知:①NiS不溶于水或稀硫酸;
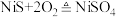 。
。②该工艺流程条件下,有关金属离子开始沉淀和完全沉淀时的pH见下表:
| 金属离子 | Ni+ | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀时的pH | 6.4 | 2.2 | 4.1 | 9.6 |
| 完全沉淀时的pH | 8.4 | 3.5 | 5.4 | 11.6 |
回答下列问题:
(1)“酸溶”时,Al2O3溶解的化学方程式为
(2)“滤渣1”的成分是SiO2和
(3)“滤液1”的pH约为1.8,在“调节pH”时用氨水逐步调节pH至6.3,依次析出的是
(4)从“沉镍”到“溶解”还需经过的操作是
(5)“滤渣4”并入滤渣
(6)某工厂用2t该废镍触媒(NiO含量为75%)制备硫酸镍,设整个流程中Ni的损耗率为20%,最终得到NiSO4·6H2O的质量为
您最近一年使用:0次
名校
8 . 金属钇是稀土元素中含量最丰富的元素之一,主要存在于硅铍钇矿等矿石中。我国蕴藏着丰富的硅铍钇矿(Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下:
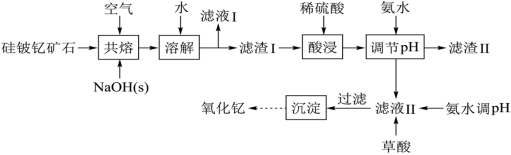
已知:①钇(Y)的常见化合价为+3;
②铍(Be)与铝化学性质相似;
③25℃时,相关金属离子形成氢氧化物沉淀的pH范围如下表:
(假设表中金属离子初始浓度co(Mn+)=0.01mol/L,当溶液中某种离子浓度c≤1.0×10-5mol/L时,可认为该离子沉淀完全)。
请回答下列问题:
(1)用氧化物形式表示硅铍钇矿石组成的化学式_______ 。写出Be的氧化物与氢氧化钠“共熔”时的化学方程式_______ 。
(2)“共熔”时,可选择的容器是_______ (填“石英”、“氧化铝耐高温”或“生铁”)坩埚。“滤液I ”中溶质的主要成分除过量的NaOH外,还有_______ (填化学式)。
(3)沉钇。往“滤液Ⅱ”中先加氨水调节pH = 8.2,此时Y3+转化为Y(OH)3,此时溶液中c(Y3+)为_______ mol • L-1。
(4)实验室洗涤过滤所得Y(OH)3沉淀的操作是_______ 。
(5)滤液I经过一系列处理后,得到无水BeCl2。某同学拟用得到的无水BeCl2制取单质Be,设计用石墨棒和铜棒作两极,通过电解NaCl-BeCl2混合熔融盐来制备Be同时得到副产物Cl2,则铜棒上发生的电极反应式为_______ 。(已知:混熔时发生反应2NaCl+BeCl2=Na2[BeCl4])

已知:①钇(Y)的常见化合价为+3;
②铍(Be)与铝化学性质相似;
③25℃时,相关金属离子形成氢氧化物沉淀的pH范围如下表:
(假设表中金属离子初始浓度co(Mn+)=0.01mol/L,当溶液中某种离子浓度c≤1.0×10-5mol/L时,可认为该离子沉淀完全)。
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.1 | 3.1 |
| Y3+ | 6.5 | 7.5 |
请回答下列问题:
(1)用氧化物形式表示硅铍钇矿石组成的化学式
(2)“共熔”时,可选择的容器是
(3)沉钇。往“滤液Ⅱ”中先加氨水调节pH = 8.2,此时Y3+转化为Y(OH)3,此时溶液中c(Y3+)为
(4)实验室洗涤过滤所得Y(OH)3沉淀的操作是
(5)滤液I经过一系列处理后,得到无水BeCl2。某同学拟用得到的无水BeCl2制取单质Be,设计用石墨棒和铜棒作两极,通过电解NaCl-BeCl2混合熔融盐来制备Be同时得到副产物Cl2,则铜棒上发生的电极反应式为
您最近一年使用:0次
2022-09-15更新
|
168次组卷
|
2卷引用:湖南省长沙市宁乡市2022届高三下学期5月模拟考试化学试题
名校
9 . 下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
| 选项 | 实验 | 现象 | 结论 |
| A | 将稀硝酸中加入少量铁粉,充分反应后滴加KSCN溶液 | 有气体生成,产生血红色沉淀 | 稀硝酸将Fe氧化为Fe3+ |
| B | 将铜粉加入1.0mol·L-1 Fe2(SO4)3溶液中 | 溶液变蓝、有黑色固体出现 | 金属铁比铜活泼 |
| C | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点较低 |
| D | 将0.1mol·L-1 MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol·L-1 CuSO4溶液 | 先有白色沉淀生成,后变为浅蓝色沉淀 | Cu(OH)2的溶度积比Mg(OH)2的小 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-09-14更新
|
404次组卷
|
3卷引用:湖南省长沙市湖南师范大学附属中学2022-2023学年高三上学期月考(一)化学试题
10 . 物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡,请根据所学知识回答:
(1)某温度下,纯水中的c(H+)=1.5×10-7,则纯水中的
_______ mol/L,该温度时的水的离子积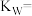
_______ 。保持温度不变,滴入稀盐酸使溶液中的 ,则溶液中的
,则溶液中的 为
为_______  。
。
(2)常温中,一定浓度的CH3COONa溶液的pH=8,已知CH3COOH的电离平衡常数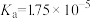 ,则该CH3COONa溶液中:
,则该CH3COONa溶液中: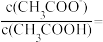
_______ 。
(3)甲酸钠(HCOONa)溶液呈碱性的原因是_______ (用离子方程式表示)。0.02mol/L的HCOONa溶液中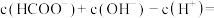
_______ mol/L。
(4)25℃,在0.10mol•L1硫酸铜溶液中加入氢氧化钠稀溶液充分反应,有蓝色氢氧化铜沉淀生成,当溶液的pH=9时,c(Cu2+)=_______ molL1(Ksp[Cu(OH)2]=2.2×1020)。
(1)某温度下,纯水中的c(H+)=1.5×10-7,则纯水中的

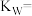
 ,则溶液中的
,则溶液中的 为
为 。
。(2)常温中,一定浓度的CH3COONa溶液的pH=8,已知CH3COOH的电离平衡常数
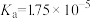 ,则该CH3COONa溶液中:
,则该CH3COONa溶液中: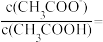
(3)甲酸钠(HCOONa)溶液呈碱性的原因是
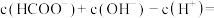
(4)25℃,在0.10mol•L1硫酸铜溶液中加入氢氧化钠稀溶液充分反应,有蓝色氢氧化铜沉淀生成,当溶液的pH=9时,c(Cu2+)=
您最近一年使用:0次
2022-09-14更新
|
308次组卷
|
2卷引用:湖南省岳阳市华容县2021-2022学年高二上学期期末教学质量监测化学试题



