名校
1 . 亚硫酰氯( )和硫酰氯(
)和硫酰氯( )都是重要的化工原料,均易水解
)都是重要的化工原料,均易水解
I.亚硫酰氯( )又名氯化亚钒,熔点为-105℃,沸点为77℃,遇水剧烈反应,产生大量白雾,并生成刺激性气味的气体。
)又名氯化亚钒,熔点为-105℃,沸点为77℃,遇水剧烈反应,产生大量白雾,并生成刺激性气味的气体。
(1)用硫磺、液氯和 为原料,在一定条件下合成
为原料,在一定条件下合成 ,原子利用率可达100%,则三者的物质的量之比为
,原子利用率可达100%,则三者的物质的量之比为_______ 。
(2) 水解后无残留物,是较好的脱水剂。某同学设计实验将
水解后无残留物,是较好的脱水剂。某同学设计实验将 和
和 混合物加热来制取无水
混合物加热来制取无水 。
。
① 在该实验中作脱水剂的作用是
在该实验中作脱水剂的作用是_______ (写出两点)。
②实验室常用NaOH溶液吸收 ,该反应的离子方程式是
,该反应的离子方程式是_______ 。
II.硫酰氯( )的熔点为-54.1℃,沸点为69.1℃,在空气中遇水蒸气发生剧烈反应,并产生大量白雾,100℃以上分解生成
)的熔点为-54.1℃,沸点为69.1℃,在空气中遇水蒸气发生剧烈反应,并产生大量白雾,100℃以上分解生成 和
和 ,实验室合成
,实验室合成 的原理:
的原理:
 ,实验装置如图所示(部分夹持装置略去),请回答下列问题:
,实验装置如图所示(部分夹持装置略去),请回答下列问题:

(3)A、B干燥管中盛有的物质可以分别是下列_______(填标号)。
(4)去除丙装置可能会发生的副反应是_______ (用化学方程式表示)。
(5)为了测定 产品纯度(杂质不参与反应),称取m g
产品纯度(杂质不参与反应),称取m g  产品于锥形瓶中,加入足量蒸馏水,充分反应。滴加几滴指示剂,用c
产品于锥形瓶中,加入足量蒸馏水,充分反应。滴加几滴指示剂,用c 
 溶液滴定反应后的溶液中
溶液滴定反应后的溶液中 的含量,终点时消耗
的含量,终点时消耗 溶液的平均体积为V mL。已知:
溶液的平均体积为V mL。已知:
①根据上表中各种物质的 ,该实验应选择的指示剂为
,该实验应选择的指示剂为_______ (从下列选项中选择,填标号),滴定终点的现象是_______ 。
A. B.
B. C.
C. D.KBr
D.KBr
②该 产品的纯度为
产品的纯度为_______ %。
 )和硫酰氯(
)和硫酰氯( )都是重要的化工原料,均易水解
)都是重要的化工原料,均易水解I.亚硫酰氯(
 )又名氯化亚钒,熔点为-105℃,沸点为77℃,遇水剧烈反应,产生大量白雾,并生成刺激性气味的气体。
)又名氯化亚钒,熔点为-105℃,沸点为77℃,遇水剧烈反应,产生大量白雾,并生成刺激性气味的气体。(1)用硫磺、液氯和
 为原料,在一定条件下合成
为原料,在一定条件下合成 ,原子利用率可达100%,则三者的物质的量之比为
,原子利用率可达100%,则三者的物质的量之比为(2)
 水解后无残留物,是较好的脱水剂。某同学设计实验将
水解后无残留物,是较好的脱水剂。某同学设计实验将 和
和 混合物加热来制取无水
混合物加热来制取无水 。
。①
 在该实验中作脱水剂的作用是
在该实验中作脱水剂的作用是②实验室常用NaOH溶液吸收
 ,该反应的离子方程式是
,该反应的离子方程式是II.硫酰氯(
 )的熔点为-54.1℃,沸点为69.1℃,在空气中遇水蒸气发生剧烈反应,并产生大量白雾,100℃以上分解生成
)的熔点为-54.1℃,沸点为69.1℃,在空气中遇水蒸气发生剧烈反应,并产生大量白雾,100℃以上分解生成 和
和 ,实验室合成
,实验室合成 的原理:
的原理:
 ,实验装置如图所示(部分夹持装置略去),请回答下列问题:
,实验装置如图所示(部分夹持装置略去),请回答下列问题:
(3)A、B干燥管中盛有的物质可以分别是下列_______(填标号)。
| A.碱石灰、浓硫酸 | B.氯化钙、碱石灰 | C.碱石灰、五氧化二磷 | D.碱石灰、碱石灰 |
(5)为了测定
 产品纯度(杂质不参与反应),称取m g
产品纯度(杂质不参与反应),称取m g  产品于锥形瓶中,加入足量蒸馏水,充分反应。滴加几滴指示剂,用c
产品于锥形瓶中,加入足量蒸馏水,充分反应。滴加几滴指示剂,用c 
 溶液滴定反应后的溶液中
溶液滴定反应后的溶液中 的含量,终点时消耗
的含量,终点时消耗 溶液的平均体积为V mL。已知:
溶液的平均体积为V mL。已知:| 物质 |  | AgCl |  |  | AgBr |
 | 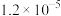 |  |  | 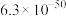 |  |
| 颜色 | 白色 | 白色 | 砖红色 | 黑色 | 浅黄色 |
 ,该实验应选择的指示剂为
,该实验应选择的指示剂为A.
 B.
B. C.
C. D.KBr
D.KBr②该
 产品的纯度为
产品的纯度为
您最近一年使用:0次
2022-11-08更新
|
494次组卷
|
3卷引用:湖南省长沙市长郡中学2022-2023学年高三第三次月考化学试题
名校
解题方法
2 . 已知:常温下, ,
, ,
,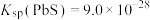 。在自然界中,闪锌矿(ZnS)和方铅矿(PbS)遇硫酸铜溶液均能转化成铜蓝(CuS)。下列说法正确的是
。在自然界中,闪锌矿(ZnS)和方铅矿(PbS)遇硫酸铜溶液均能转化成铜蓝(CuS)。下列说法正确的是
 ,
, ,
,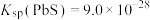 。在自然界中,闪锌矿(ZnS)和方铅矿(PbS)遇硫酸铜溶液均能转化成铜蓝(CuS)。下列说法正确的是
。在自然界中,闪锌矿(ZnS)和方铅矿(PbS)遇硫酸铜溶液均能转化成铜蓝(CuS)。下列说法正确的是A.饱和PbS溶液中,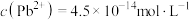 |
| B.相同温度下,在水中的溶解度:ZnS>CuS>PbS |
C.向PbS固体中滴加一定量 溶液,反应达到平衡时,溶液中 溶液,反应达到平衡时,溶液中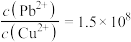 |
D.向含浓度相同的 、 、 、 、 的混合溶液中逐滴加入 的混合溶液中逐滴加入 稀溶液, 稀溶液, 先沉淀 先沉淀 |
您最近一年使用:0次
2022-11-08更新
|
882次组卷
|
7卷引用:湖南省部分学校2022-2023学年高二上学期期中考试化学试题
3 . 硫酸锌是制造锌钡白和锌盐的主要原料,也可用作木材的防腐剂等。用氧化锌烟尘(主要成分为ZnO,还含有少量PbO、CuO、Fe2O3、FeO等)生产ZnSO4∙7H2O的流程如下:

有关金属离子[c(Mn+)=0.1 mol/L]形成氢氧化物沉淀的pH范围如下:
(1)“酸浸”时用的稀酸是_______ 。
(2)“氧化”时的离子方程式为_______ ,加入ZnO除杂时溶液的pH控制范围是_______ ~5.0。
(3)滤渣3含有锌和_______ (写化学式);由滤液得到ZnSO4∙7H2O的操作是_______ 、洗涤、干燥。
(4)取14.35 g ZnSO4∙7H2O (287 g/mol)加热至不同温度,剩余固体的质量如下表:
则680℃时剩余固体的化学式为_______(填字母,括号内为摩尔质量)。

有关金属离子[c(Mn+)=0.1 mol/L]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Fe3+ | Fe2+ | Zn2+ | Cu2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 6.2 | 4.7 |
| 沉淀完全的pH | 2.8 | 8.3 | 8.2 | 6.7 |
(2)“氧化”时的离子方程式为
(3)滤渣3含有锌和
(4)取14.35 g ZnSO4∙7H2O (287 g/mol)加热至不同温度,剩余固体的质量如下表:
| 温度/℃ | 100 | 250 | 680 | 930 |
| 质量/g | 8.95 | 8.05 | 6.72 | 4.05 |
A.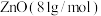 | B.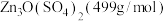 |
C.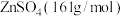 | D.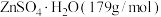 |
您最近一年使用:0次
4 . 磁选后的炼铁高钛炉渣,主要成分有 、
、 、
、 、MgO、CaO以及少量的
、MgO、CaO以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。

该工艺条件下,“焙烧”中, 、
、 几乎不发生反应,
几乎不发生反应, 、MgO、CaO、
、MgO、CaO、 转化为相应的硫酸盐。有关金属离子开始沉淀和沉淀完全的pH见下表:
转化为相应的硫酸盐。有关金属离子开始沉淀和沉淀完全的pH见下表:
回答下列问题:
(1)提高“酸溶”速率的措施有_______ (任写一点即可)。
(2)“水浸”后“滤液”的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,依次析出的金属离子是_______ 。
(3)“水浸渣”在160℃“酸溶”,最适合的酸是_______ 。“酸溶渣”的成分是_______ 、_______ 。
(4) “酸溶”后,将溶液适当稀释并加热, 水解析出
水解析出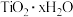 沉淀,该反应的离子方程式是
沉淀,该反应的离子方程式是_______ 。
(5)将“母液①”和“母液②”混合,吸收尾气,经处理得_______ ,循环利用。
 、
、 、
、 、MgO、CaO以及少量的
、MgO、CaO以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
该工艺条件下,“焙烧”中,
 、
、 几乎不发生反应,
几乎不发生反应, 、MgO、CaO、
、MgO、CaO、 转化为相应的硫酸盐。有关金属离子开始沉淀和沉淀完全的pH见下表:
转化为相应的硫酸盐。有关金属离子开始沉淀和沉淀完全的pH见下表:| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 2.2 | 3.5 | 9.5 | 12.4 |
沉淀完全( )的pH )的pH | 3.2 | 4.7 | 11.1 | 13.8 |
(1)提高“酸溶”速率的措施有
(2)“水浸”后“滤液”的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,依次析出的金属离子是
(3)“水浸渣”在160℃“酸溶”,最适合的酸是
(4) “酸溶”后,将溶液适当稀释并加热,
 水解析出
水解析出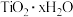 沉淀,该反应的离子方程式是
沉淀,该反应的离子方程式是(5)将“母液①”和“母液②”混合,吸收尾气,经处理得
您最近一年使用:0次
2022-11-06更新
|
295次组卷
|
3卷引用:湖南省长沙市雅礼中学2022-2023学年高二上学期期中考试化学试题
名校
5 . 我们的生活离不开化学,化学物质在不同的领域发挥着重要的作用。根据要求回答下列问题:
(1)将氯化铝溶液加热蒸干灼烧得到的固体为_______ , 是一种液态化合物,遇水剧烈反应,有白雾和使滴有品红试液的滤纸褪色的刺激性气味产生,实际工业上将
是一种液态化合物,遇水剧烈反应,有白雾和使滴有品红试液的滤纸褪色的刺激性气味产生,实际工业上将 与
与 混合共热,可得到无水
混合共热,可得到无水 ,其原因是
,其原因是_______ 。
(2)利用“亚硫酸盐法”吸收工业废气中的 。常温下,将工业废气通入
。常温下,将工业废气通入 溶液中,测得溶液pH与含硫组分物质的量分数
溶液中,测得溶液pH与含硫组分物质的量分数 的变化关系如图所示。
的变化关系如图所示。

①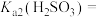
_______ 。b点溶液中
_______ 。
②常温下, 。0.1
。0.1 的
的 溶液中离子浓度由大到小的顺序为
溶液中离子浓度由大到小的顺序为______ (不考虑 )。
)。
(3)工业废水处理时向浓度均为0.1 的
的 和
和 混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中
混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中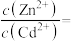
_______ 。 [已知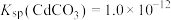 ,
,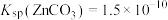 ]
]
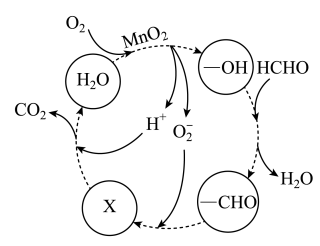
(4)工业废水中含有甲醛,某厂降解甲醛的反应机理如图所示,则X表示的粒子是_______ 。
(1)将氯化铝溶液加热蒸干灼烧得到的固体为
 是一种液态化合物,遇水剧烈反应,有白雾和使滴有品红试液的滤纸褪色的刺激性气味产生,实际工业上将
是一种液态化合物,遇水剧烈反应,有白雾和使滴有品红试液的滤纸褪色的刺激性气味产生,实际工业上将 与
与 混合共热,可得到无水
混合共热,可得到无水 ,其原因是
,其原因是(2)利用“亚硫酸盐法”吸收工业废气中的
 。常温下,将工业废气通入
。常温下,将工业废气通入 溶液中,测得溶液pH与含硫组分物质的量分数
溶液中,测得溶液pH与含硫组分物质的量分数 的变化关系如图所示。
的变化关系如图所示。
①
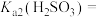

②常温下,
 。0.1
。0.1 的
的 溶液中离子浓度由大到小的顺序为
溶液中离子浓度由大到小的顺序为 )。
)。(3)工业废水处理时向浓度均为0.1
 的
的 和
和 混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中
混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中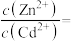
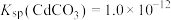 ,
,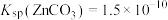 ]
](4)工业废水中含有甲醛,某厂降解甲醛的反应机理如图所示,则X表示的粒子是

您最近一年使用:0次
2022-11-06更新
|
268次组卷
|
2卷引用:湖南省长沙市雅礼中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
6 . 科学探究是化学学科核心素养之一,下列实验方案设计中,能达到实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 证明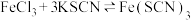  平衡向逆反应方向移动 平衡向逆反应方向移动 | 向 和KSCN混合溶液中,加入少量KCl的固体,溶液颜色变浅 和KSCN混合溶液中,加入少量KCl的固体,溶液颜色变浅 |
| B | 探究 和 和 的反应存在一定的限度 的反应存在一定的限度 | 将12mL 0.01 KI溶液与2mL 0.005 KI溶液与2mL 0.005  溶液混合,充分反应后分成两份,一份滴加几滴KSCN溶液,另一份滴加几滴淀粉溶液 溶液混合,充分反应后分成两份,一份滴加几滴KSCN溶液,另一份滴加几滴淀粉溶液 |
| C | 验证: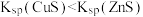 | 在2mL 0.01mol/L  溶液中先滴入几滴0.01mol/L 溶液中先滴入几滴0.01mol/L 溶液,有白色沉淀生成,再滴入几滴0.01mol/L 溶液,有白色沉淀生成,再滴入几滴0.01mol/L  溶液有黑色沉淀生成 溶液有黑色沉淀生成 |
| D | 证明HClO的酸性比 弱 弱 | 室温下,用pH试纸分别测定0.1 NaClO溶液和0.1 NaClO溶液和0.1  溶液的pH,前者大 溶液的pH,前者大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-11-06更新
|
493次组卷
|
3卷引用:湖南省长沙市雅礼中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
7 . 常温下,用废电池的锌皮制备 的过程中,需除去锌皮中的少量杂质铁,工艺流程如下:
的过程中,需除去锌皮中的少量杂质铁,工艺流程如下:

有关数据如下表所示:
下列说法不正确的是
 的过程中,需除去锌皮中的少量杂质铁,工艺流程如下:
的过程中,需除去锌皮中的少量杂质铁,工艺流程如下:
有关数据如下表所示:
| 化合物 |  |  |  |
 近似值 近似值 | 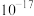 | 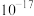 | 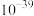 |
A.若不加 溶液,将会使 溶液,将会使 和 和 不好分离 不好分离 |
B.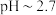 时,铁离子刚好沉淀完全 时,铁离子刚好沉淀完全 |
C.调节pH步骤中, 时,锌离子开始沉淀 时,锌离子开始沉淀 |
D.由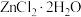 晶体制得 晶体制得 固体的操作方法是边加热边通入HCl气体 固体的操作方法是边加热边通入HCl气体 |
您最近一年使用:0次
2022-11-05更新
|
484次组卷
|
4卷引用:湖南省三湘联考2022-2023学年高二上学期期中联考化学试题
名校
8 . 已知氧化锌和氢氧化锌分别为两性氧化物和氢氧化物。坐标系中横坐标为溶液的 ,纵坐标为
,纵坐标为 或
或 ,25℃时,下列说法不正确的是
,25℃时,下列说法不正确的是

 ,纵坐标为
,纵坐标为 或
或 ,25℃时,下列说法不正确的是
,25℃时,下列说法不正确的是
A.往氢氧化钠溶液中加入少量 溶液,反应的离子方程式为: 溶液,反应的离子方程式为: |
B.若要从某含 的工业废液中完全沉淀 的工业废液中完全沉淀 ,可以调控该溶液的 ,可以调控该溶液的 在 在 之间 之间 |
C. 与 与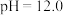 的两种废液中, 的两种废液中,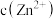 之比为 之比为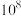 |
D.25℃时, 的溶度积常数 的溶度积常数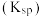 为 为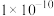 |
您最近一年使用:0次
9 . 铜冶炼过程中,产生的粗硫酸镍废液中含有Cu2+、Fe2+、Ca2+、Mg2+、H3AsO3等杂质微粒,工业生产以此为原料,精制硫酸镍,主要流程如图:
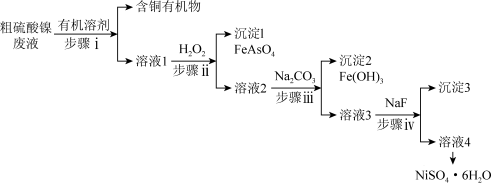
已知:常温下,Fe(OH)3Ksp=2.6×10−39,Ni(OH)2Ksp=5.48×10−16,HFKa=6.3×10−4
(1)步骤i的操作名称是____ 。
(2)①H3AsO3中As的化合价为____ 。
②步骤ii中H2O2的作用是____ 。
(3)步骤iii,加入Na2CO3的目的是通过调pH进一步去除Fe3+,使c(Fe3+)≤2.5×10-4mol•L-1,若溶液2中c(Ni2+)=0.0548mol•L-1,则需控制pH的大致范围为____ 。
(4)①步骤iv,沉淀3的主要成分有____ (填化学式)。
②在加入NaF的同时需调pH约为5,若pH过低,导致沉淀率下降,原因是____ 。
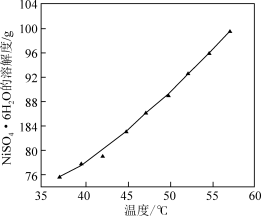
(5)结合图说明由溶液4得到NiSO4•6H2O的操作是____ 。

已知:常温下,Fe(OH)3Ksp=2.6×10−39,Ni(OH)2Ksp=5.48×10−16,HFKa=6.3×10−4
(1)步骤i的操作名称是
(2)①H3AsO3中As的化合价为
②步骤ii中H2O2的作用是
(3)步骤iii,加入Na2CO3的目的是通过调pH进一步去除Fe3+,使c(Fe3+)≤2.5×10-4mol•L-1,若溶液2中c(Ni2+)=0.0548mol•L-1,则需控制pH的大致范围为
(4)①步骤iv,沉淀3的主要成分有
②在加入NaF的同时需调pH约为5,若pH过低,导致沉淀率下降,原因是
(5)结合图说明由溶液4得到NiSO4•6H2O的操作是

您最近一年使用:0次
解题方法
10 . 下列实验操作对应的离子方程式书写正确的是
A.向澄清石灰水中加入足量NaHCO3溶液中: |
B.用碳酸钠溶液浸泡锅炉水垢: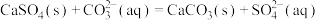 |
C.将四氧化三铁溶于稀硝酸: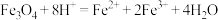 |
D.向 溶液中加入 溶液中加入 : :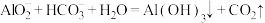 |
您最近一年使用:0次



