1 . 下列实验现象得出的结论不正确的是
| 选项 | 操作和现象 | 结论 |
| A | 向3mL0.1mol/LAgNO3溶液中先加入4~5滴0.1mol/LNaCl溶液,再滴加4~5滴0.1mol/LNaI溶液 | 先出现白色沉淀,后出现黄色沉淀,说明Ksp(AgCl)˃Ksp(AgI) |
| B | 相同条件下,测定等浓度Na2CO3溶液和Na2SO4溶液的pH,前者呈碱性,后者呈中性 | 非金属性:S˃C |
| C | 向2支盛有5mL不同浓度的Na2S2O3溶液的试管中同时加入5mL0.1mol/L硫酸,记录出现浑浊的时间 | 探究浓度对反应速率的影响 |
| D | 其他条件相同,测定等浓度的HCOOK和K2S溶液的pH | 比较Ka(HCOOH)和Ka2(H2S)的大小 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
2 . 常温下对于任一电池反应 ,其电动势
,其电动势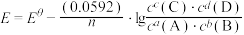 ,n为电池反应中转移的电子数。某同学设计装置(如图1),以Zn―Cu原电池探究离子浓度的改变对电极电势的影响。测得初始时
,n为电池反应中转移的电子数。某同学设计装置(如图1),以Zn―Cu原电池探究离子浓度的改变对电极电势的影响。测得初始时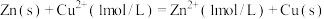 ,
,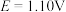 (该反应
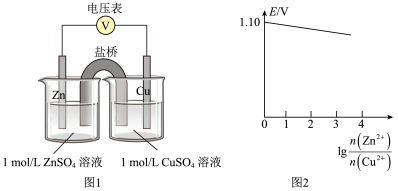
(该反应 ),随放电进行,观察电池电动势的变化趋势并绘制了电池电动势变化示意图(如图2)。下列说法正确的是
),随放电进行,观察电池电动势的变化趋势并绘制了电池电动势变化示意图(如图2)。下列说法正确的是
 ,其电动势
,其电动势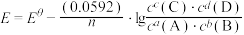 ,n为电池反应中转移的电子数。某同学设计装置(如图1),以Zn―Cu原电池探究离子浓度的改变对电极电势的影响。测得初始时
,n为电池反应中转移的电子数。某同学设计装置(如图1),以Zn―Cu原电池探究离子浓度的改变对电极电势的影响。测得初始时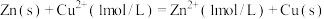 ,
,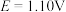 (该反应
(该反应 ),随放电进行,观察电池电动势的变化趋势并绘制了电池电动势变化示意图(如图2)。下列说法正确的是
),随放电进行,观察电池电动势的变化趋势并绘制了电池电动势变化示意图(如图2)。下列说法正确的是
| A.盐桥中通常装有含KCl饱和溶液的琼脂,离子可在其中自由移动 |
B.推测图2中直线与x轴的交点坐标大约为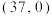 |
C.向盛有2mL 1mol/L 溶液的试管中滴加5滴1mol/L 溶液的试管中滴加5滴1mol/L 溶液,有白色沉淀产生,再向其中滴加5滴1mol/L 溶液,有白色沉淀产生,再向其中滴加5滴1mol/L 溶液产生黑色沉淀,则可知: 溶液产生黑色沉淀,则可知: |
| D.某同学用铜丝代替图1中的盐桥,也能检测到电流,推测一段时间后铜丝质量不变 |
您最近一年使用:0次
3 . 弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。回答下列问题:
(1)已知 在水中存在以下平衡:
在水中存在以下平衡: ,
, ,
, 溶液显
溶液显_______ (填“酸性”、“碱性”、“中性”);等体积等物质的量浓度的 和
和 溶液混合后,所得溶液中离子浓度由大到小顺序是
溶液混合后,所得溶液中离子浓度由大到小顺序是_______ 。
(2) 时,次氯酸的
时,次氯酸的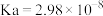 ;亚硫酸的
;亚硫酸的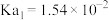 、
、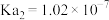 。将少量的
。将少量的 通入
通入 溶液中反应的离子方程式为
溶液中反应的离子方程式为_______ 。
(3)常温下,向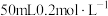 的氨水中逐滴加入
的氨水中逐滴加入 的盐酸,所得溶液的
的盐酸,所得溶液的 、溶液中
、溶液中 和
和 的物质的量分数与加入盐酸的体积的关系如下图所示。
的物质的量分数与加入盐酸的体积的关系如下图所示。

① 的电离常数为
的电离常数为_______ 。
②当加入盐酸的体积为 时,溶液中
时,溶液中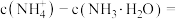
_______  (用计算式表示)。
(用计算式表示)。
(4) 溶液与
溶液与 溶液反应会生成
溶液反应会生成 沉淀。已知:常温下
沉淀。已知:常温下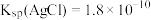 ,
, ,则
,则 转化为
转化为 的平衡常数
的平衡常数
_______ 。
(1)已知
 在水中存在以下平衡:
在水中存在以下平衡: ,
, ,
, 溶液显
溶液显 和
和 溶液混合后,所得溶液中离子浓度由大到小顺序是
溶液混合后,所得溶液中离子浓度由大到小顺序是(2)
 时,次氯酸的
时,次氯酸的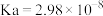 ;亚硫酸的
;亚硫酸的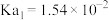 、
、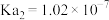 。将少量的
。将少量的 通入
通入 溶液中反应的离子方程式为
溶液中反应的离子方程式为(3)常温下,向
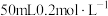 的氨水中逐滴加入
的氨水中逐滴加入 的盐酸,所得溶液的
的盐酸,所得溶液的 、溶液中
、溶液中 和
和 的物质的量分数与加入盐酸的体积的关系如下图所示。
的物质的量分数与加入盐酸的体积的关系如下图所示。
①
 的电离常数为
的电离常数为②当加入盐酸的体积为
 时,溶液中
时,溶液中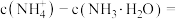
 (用计算式表示)。
(用计算式表示)。(4)
 溶液与
溶液与 溶液反应会生成
溶液反应会生成 沉淀。已知:常温下
沉淀。已知:常温下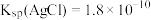 ,
, ,则
,则 转化为
转化为 的平衡常数
的平衡常数
您最近一年使用:0次
4 . 室温下进行下列实验,根据实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向某溶液中滴加 溶液,产生蓝色沉淀 溶液,产生蓝色沉淀 | 原溶液中有 ,无 ,无 |
| B | 向浓度均为 的 的 、 、 混合溶液中滴加少量 混合溶液中滴加少量 溶液,有黄色沉淀生成 溶液,有黄色沉淀生成 | 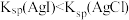 |
| C | 用注射器吸入 由 由 和 和 组成的混合气体,向外拉动注射器活塞至气体体积为原来的2倍,气体颜色变浅 组成的混合气体,向外拉动注射器活塞至气体体积为原来的2倍,气体颜色变浅 | 反应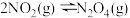 的平衡正向移动 的平衡正向移动 |
| D | 用 试纸测得: 试纸测得: 溶液的 溶液的 约为9, 约为9, 溶液的 溶液的 约为8 约为8 |  电离出 电离出 的能力比 的能力比 的强 的强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
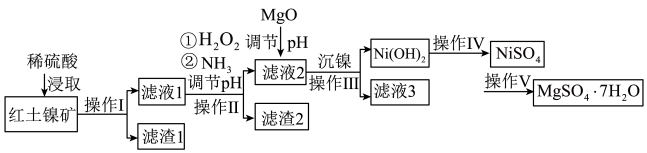
5 . 镍及其化合物在工业上有广泛用途,以某地红土镍矿(主要成分NiO、MgO、 、
、 和铁的氧化物)为原料,采用酸溶法制取
和铁的氧化物)为原料,采用酸溶法制取 和
和 ,工业流程如图所示:
,工业流程如图所示:
已知:①常温下, 易溶于水,
易溶于水, 和NiOOH不溶于水;
和NiOOH不溶于水;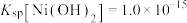 。
。
②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
回答下列问题:
(1)“浸取”时需将矿样研磨的目的是______ ,“滤渣1”的成分______ (填化学式)。
(2)“滤液1”中加入 的作用是
的作用是______ (用离子反应方程式表示)。
(3)操作II为达到实验目的,由表中的数据判断通入 调节溶液pH的范围是
调节溶液pH的范围是______ 。
(4)“滤液1”中是否存在 ,可用
,可用______ 检验。
(5)“沉镍”中pH调为8.5,则滤液中 的浓度为
的浓度为______  。
。
(6)操作V是______ 、过滤、洗涤。
(7) 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为______ 。
 、
、 和铁的氧化物)为原料,采用酸溶法制取
和铁的氧化物)为原料,采用酸溶法制取 和
和 ,工业流程如图所示:
,工业流程如图所示:
已知:①常温下,
 易溶于水,
易溶于水, 和NiOOH不溶于水;
和NiOOH不溶于水;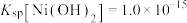 。
。②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
沉淀物 |
|
|
|
|
|
开始沉淀时的pH | 7.1 | 7.6 | 2.7 | 3.4 | 9.2 |
沉淀完全( | 9.0 | 9.6 | 3.2 | 4.7 | 11.1 |
(1)“浸取”时需将矿样研磨的目的是
(2)“滤液1”中加入
 的作用是
的作用是(3)操作II为达到实验目的,由表中的数据判断通入
 调节溶液pH的范围是
调节溶液pH的范围是(4)“滤液1”中是否存在
 ,可用
,可用(5)“沉镍”中pH调为8.5,则滤液中
 的浓度为
的浓度为 。
。(6)操作V是
(7)
 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
您最近一年使用:0次
2023-02-10更新
|
1039次组卷
|
7卷引用: 湖南师范大学附属中学2022-2023学年高二上学期期末考试化学试题
6 . 在化学分析中,以 标准溶液滴定溶液中的
标准溶液滴定溶液中的 时,采用
时,采用 为指示剂,利用
为指示剂,利用 与
与 反应生成砖红色沉淀指示滴定终点。已知25℃时,
反应生成砖红色沉淀指示滴定终点。已知25℃时, ,
, ,当溶液中的
,当溶液中的 恰好沉淀完全(浓度等于
恰好沉淀完全(浓度等于 )时,溶液中
)时,溶液中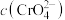 约为
约为
 标准溶液滴定溶液中的
标准溶液滴定溶液中的 时,采用
时,采用 为指示剂,利用
为指示剂,利用 与
与 反应生成砖红色沉淀指示滴定终点。已知25℃时,
反应生成砖红色沉淀指示滴定终点。已知25℃时, ,
, ,当溶液中的
,当溶液中的 恰好沉淀完全(浓度等于
恰好沉淀完全(浓度等于 )时,溶液中
)时,溶液中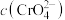 约为
约为A. | B.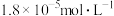 | C.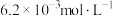 | D. |
您最近一年使用:0次
2023-02-10更新
|
657次组卷
|
13卷引用: 湖南师范大学附属中学2022-2023学年高二上学期期末考试化学试题
湖南师范大学附属中学2022-2023学年高二上学期期末考试化学试题浙江省湖州市2021-2022学年高二上学期期末考试化学试题浙江省湖州市2021-2022学年高二上学期期末调研测试化学试题吉林省长春市第二实验中学2021-2022学年高二下学期开学考试化学试题湖南省长沙市湖南师范大学附属中学2022-2023学年高二上学期期末考试化学试题湖南省邵东市第一中学2022-2023学年高二上学期期末考试化学试题云南省昆明市安宁中学2022-2023学年高二下学期第一次检测化学试题四川省雅安中学2022-2023学年高二下学期期中考试化学试题(已下线)专题08 沉淀溶解平衡-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)新疆乌鲁木齐八一中学2023-2024学年高二上学期11月期中化学试题黑龙江省哈尔滨师范大学附属中学2023-2024学年高二上学期11月期中化学试题黑龙江省哈尔滨市第九中学2023-2024学年高二下学期开学考试化学试卷江西省宜春市丰城市第九中学2023-2024学年高二下学期4月月考化学试题
名校
解题方法
7 . 稀土是元素周期表第Ⅲ族副族元素钪(SC)、钇(Y)和镧系元素共17种化学元素的合称,是隐形战机、超导、核工业等高精尖领域必备的原料,但是稀土的开采和加工对环境破坏比较大。从某种矿物(含铁、铝等元素)中提取稀土(用R表示)的工艺如图:
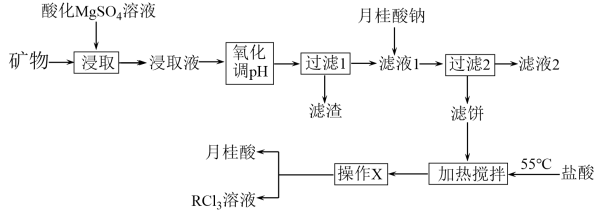
已知:①月桂酸(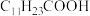 )熔点为44℃,难溶于水;
)熔点为44℃,难溶于水;
②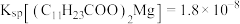 ;
;
③ 开始溶解时的pH为8.8,有关金属离子沉淀的相关pH见表。
开始溶解时的pH为8.8,有关金属离子沉淀的相关pH见表。
(1)“过滤1”前,用NaOH溶液调pH,控制pH的范围为_______ ,得到的滤渣主要成分为_______ 。
(2)“过滤2”后,滤饼中检测不到Mg元素,滤液2中 浓度为0.2mol/L。为尽可能多地提取
浓度为0.2mol/L。为尽可能多地提取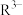 ,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中
,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中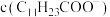 低于
低于_______  (保留两位有效数字)。
(保留两位有效数字)。
(3)“加热搅拌”控制在55℃左右,其原因是_______ 。
(4)稀土中钪元素的单质具有较高熔点且密度和铝接近,可制备高熔点轻质合金,此种合金可用作_______ (任答出一种用途即可)。
(5)某甲醇/ 燃料电池,电解质是掺杂
燃料电池,电解质是掺杂 的
的 晶体,它在熔融状态下能传导
晶体,它在熔融状态下能传导 ,写出该电池负极的电极反应式
,写出该电池负极的电极反应式_______ 。

已知:①月桂酸(
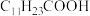 )熔点为44℃,难溶于水;
)熔点为44℃,难溶于水;②
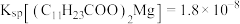 ;
;③
 开始溶解时的pH为8.8,有关金属离子沉淀的相关pH见表。
开始溶解时的pH为8.8,有关金属离子沉淀的相关pH见表。| 离子 |  |  |  |  |
| 开始沉淀时的pH | 8.8 | 1.5 | 3.6 | 6.2~7.4 |
| 沉淀完全时的pH | / | 3.2 | 4.7 | / |
(2)“过滤2”后,滤饼中检测不到Mg元素,滤液2中
 浓度为0.2mol/L。为尽可能多地提取
浓度为0.2mol/L。为尽可能多地提取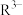 ,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中
,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中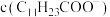 低于
低于 (保留两位有效数字)。
(保留两位有效数字)。(3)“加热搅拌”控制在55℃左右,其原因是
(4)稀土中钪元素的单质具有较高熔点且密度和铝接近,可制备高熔点轻质合金,此种合金可用作
(5)某甲醇/
 燃料电池,电解质是掺杂
燃料电池,电解质是掺杂 的
的 晶体,它在熔融状态下能传导
晶体,它在熔融状态下能传导 ,写出该电池负极的电极反应式
,写出该电池负极的电极反应式
您最近一年使用:0次
2023-02-09更新
|
220次组卷
|
2卷引用:湖南省长沙市雅礼中学2022-2023学年高二上学期期末考试化学试题
名校
解题方法
8 . 弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。请回答下列有关平衡的问题。
Ⅰ.在一定温度下,向一个容积不变(1L)的密闭容器中,加入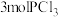 和
和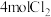 使之发生反应
使之发生反应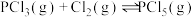 ,起始时压强为
,起始时压强为 ,平衡时容器内压强为起始时的6/7。计算并回答:
,平衡时容器内压强为起始时的6/7。计算并回答:
(1)已知:可逆反应的平衡常数可以用平衡分压代替平衡浓度(称为分压平衡常数,用 表示)计算,分压=总压×物质的量分数,则上述反应的
表示)计算,分压=总压×物质的量分数,则上述反应的
_______ (用含 的代数式表示)。
的代数式表示)。
(2)保持同一反应温度和体积,若将起始物改为amolPCl3,bmolCl2,cmol 。欲使平衡时各组分的体积分数与(1)中的一样,则a,b,c满足的关系为
。欲使平衡时各组分的体积分数与(1)中的一样,则a,b,c满足的关系为_______ 。
Ⅱ.某三元羧酸在表面活性剂、洗涤剂、润滑剂等方面具有重要的地位。常温时,向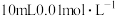 的溶液中滴入等浓度的NaOH溶液,H3A、
的溶液中滴入等浓度的NaOH溶液,H3A、 、
、 、
、 的物质的量分数与溶液的pH的关系如图所示。
的物质的量分数与溶液的pH的关系如图所示。
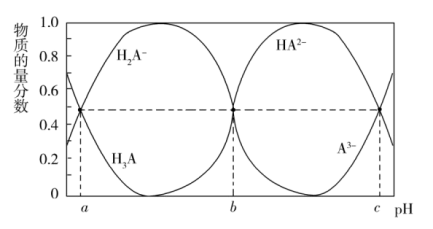
(3)常温时, 的
的 溶液的pH约为
溶液的pH约为_______ 。(已知 )
)
(4)常温时,反应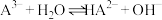 的平衡常数为K=
的平衡常数为K=_______ (用含a或b或c的代数式表示)
(5)当滴入30mLNaOH溶液时,下列溶液中微粒浓度关系正确的是_______
Ⅲ.含有 的废水毒性较大,某工厂废水中含
的废水毒性较大,某工厂废水中含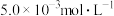 的
的 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理:
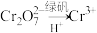 、
、
(6)该废水加硫酸酸化后,再加入绿矾( ),发生反应的离子方程式为
),发生反应的离子方程式为_______ 。
(7)若处理后的废水中残留的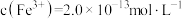 ,则残留的
,则残留的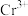 的浓度为
的浓度为_______ mol/L。(已知: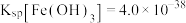 ,
,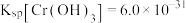 )。
)。
Ⅰ.在一定温度下,向一个容积不变(1L)的密闭容器中,加入
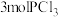 和
和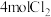 使之发生反应
使之发生反应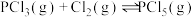 ,起始时压强为
,起始时压强为 ,平衡时容器内压强为起始时的6/7。计算并回答:
,平衡时容器内压强为起始时的6/7。计算并回答:(1)已知:可逆反应的平衡常数可以用平衡分压代替平衡浓度(称为分压平衡常数,用
 表示)计算,分压=总压×物质的量分数,则上述反应的
表示)计算,分压=总压×物质的量分数,则上述反应的
 的代数式表示)。
的代数式表示)。(2)保持同一反应温度和体积,若将起始物改为amolPCl3,bmolCl2,cmol
 。欲使平衡时各组分的体积分数与(1)中的一样,则a,b,c满足的关系为
。欲使平衡时各组分的体积分数与(1)中的一样,则a,b,c满足的关系为Ⅱ.某三元羧酸在表面活性剂、洗涤剂、润滑剂等方面具有重要的地位。常温时,向
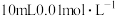 的溶液中滴入等浓度的NaOH溶液,H3A、
的溶液中滴入等浓度的NaOH溶液,H3A、 、
、 、
、 的物质的量分数与溶液的pH的关系如图所示。
的物质的量分数与溶液的pH的关系如图所示。
(3)常温时,
 的
的 溶液的pH约为
溶液的pH约为 )
)(4)常温时,反应
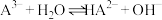 的平衡常数为K=
的平衡常数为K=(5)当滴入30mLNaOH溶液时,下列溶液中微粒浓度关系正确的是_______
A.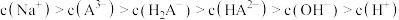 |
B.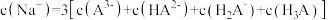 |
C.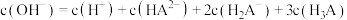 |
D.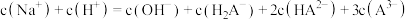 |
Ⅲ.含有
 的废水毒性较大,某工厂废水中含
的废水毒性较大,某工厂废水中含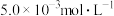 的
的 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理: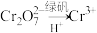 、
、
(6)该废水加硫酸酸化后,再加入绿矾(
 ),发生反应的离子方程式为
),发生反应的离子方程式为(7)若处理后的废水中残留的
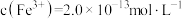 ,则残留的
,则残留的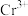 的浓度为
的浓度为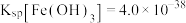 ,
,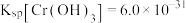 )。
)。
您最近一年使用:0次
2023-02-09更新
|
440次组卷
|
3卷引用:湖南省长沙市雅礼中学2022-2023学年高二上学期期末考试化学试题
9 . 常温下,某研究小组用数字传感器探究 的沉淀溶解平衡。实验测得悬浊液中氯离子浓度变化如图所示,其中a点表示
的沉淀溶解平衡。实验测得悬浊液中氯离子浓度变化如图所示,其中a点表示 溶于
溶于 溶液形成的悬浊液。下列说法正确的是
溶液形成的悬浊液。下列说法正确的是
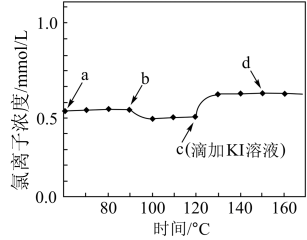
 的沉淀溶解平衡。实验测得悬浊液中氯离子浓度变化如图所示,其中a点表示
的沉淀溶解平衡。实验测得悬浊液中氯离子浓度变化如图所示,其中a点表示 溶于
溶于 溶液形成的悬浊液。下列说法正确的是
溶液形成的悬浊液。下列说法正确的是
A.图中b点可能是滴加 溶液 溶液 | B.图中c点后无黄色沉淀生成 |
C.图中d点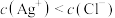 | D.由图可知: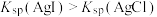 |
您最近一年使用:0次
2023-02-07更新
|
524次组卷
|
10卷引用:湖南省长沙市雅礼书院中学2021-2022学年高三下学期第五次月考化学试题
湖南省长沙市雅礼书院中学2021-2022学年高三下学期第五次月考化学试题广东省江门市2022-2023学年高二化学上学期期末调研考试化学试题广东省茂名市2021届高三第二次综合测试(4月)化学试题(已下线)2021年高考化学押题预测卷(福建卷)(01)(含考试版、答题卡、参考答案、全解全析)(已下线)难点8 水溶液中的四大平衡常数-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)第6周 周测卷-备战2022年高考化学周测与晚练(新高考专用)(已下线)考向27 难溶电解质的溶解平衡-备战2022年高考化学一轮复习考点微专题广东省深圳市深圳实验学校高中部2022-2023学年高二上学期第三阶段考试化学试题四川省内江市第六中学2022-2023学年高二下学期第一次月考(创新班)化学试题(已下线)题型27 沉淀溶解平衡常数及其应用图象
名校
解题方法
10 . 钪及其化合物具有许多优良的性能,在宇航、电子、超导等方面有着广泛的应用。从钛白工业废酸(含钪、钛、铁、锰等离子)中提取氧化钪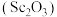 的一种流程如下:
的一种流程如下:
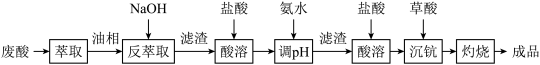
回答下列问题:
(1)洗涤“油相”可除去大量的钛离子。洗涤水是用93%的硫酸、27.5%的双氧水和水按一定比例混合而成。混合的实验操作是_______________________ 。
(2)常温下,先加入氨水调节 ,过滤,滤渣主要成分是
,过滤,滤渣主要成分是__________ ;再向滤液加入氨水调节 ,滤液中
,滤液中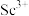 的浓度为
的浓度为__________ 。
{已知: 、
、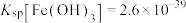 、
、 }
}
(3)用草酸“沉钪”,写出“沉钪”得到草酸钪的离子方程式:___________________________ 。
(4)草酸钪“灼烧”氧化的化学方程式为________________________________________________ 。
(5)废酸中含钪量为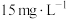 ,VL废酸最多可提取
,VL废酸最多可提取 的质量为
的质量为__________ 。
(6)镧与Sc同族位于第六周期,一种镧、锑形成的配合物结构如图所示:
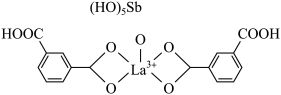
该结构中,中心离子 配位数为
配位数为__________ 。
(7)某铁、镧、锑的合金晶胞如图1,铁原子位于锑原子构成的正八面体的体心,晶胞的六个表面结构都如图2:
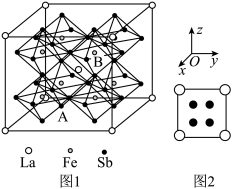
①若图中A点锑原子的坐标为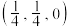 ,则B点铁原子的坐标为
,则B点铁原子的坐标为__________ 。
②若该晶体的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则Sb原子与Sb原子的最近距离为
,则Sb原子与Sb原子的最近距离为__________ cm。
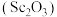 的一种流程如下:
的一种流程如下:
回答下列问题:
(1)洗涤“油相”可除去大量的钛离子。洗涤水是用93%的硫酸、27.5%的双氧水和水按一定比例混合而成。混合的实验操作是
(2)常温下,先加入氨水调节
 ,过滤,滤渣主要成分是
,过滤,滤渣主要成分是 ,滤液中
,滤液中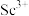 的浓度为
的浓度为{已知:
 、
、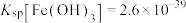 、
、 }
}(3)用草酸“沉钪”,写出“沉钪”得到草酸钪的离子方程式:
(4)草酸钪“灼烧”氧化的化学方程式为
(5)废酸中含钪量为
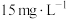 ,VL废酸最多可提取
,VL废酸最多可提取 的质量为
的质量为(6)镧与Sc同族位于第六周期,一种镧、锑形成的配合物结构如图所示:

该结构中,中心离子
 配位数为
配位数为(7)某铁、镧、锑的合金晶胞如图1,铁原子位于锑原子构成的正八面体的体心,晶胞的六个表面结构都如图2:

①若图中A点锑原子的坐标为
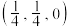 ,则B点铁原子的坐标为
,则B点铁原子的坐标为②若该晶体的密度为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则Sb原子与Sb原子的最近距离为
,则Sb原子与Sb原子的最近距离为
您最近一年使用:0次
2023-02-06更新
|
585次组卷
|
3卷引用:湖南师范大学附属中学2022-2023学年高三上学期月考卷(六)化学试题




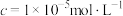 )时的pH
)时的pH

