2021高三·全国·专题练习
解题方法
1 .  =1×1012的溶液中可能大量存在:NH
=1×1012的溶液中可能大量存在:NH 、Na+、CO
、Na+、CO 、SiO
、SiO 。(__)
。(__)
 =1×1012的溶液中可能大量存在:NH
=1×1012的溶液中可能大量存在:NH 、Na+、CO
、Na+、CO 、SiO
、SiO 。(__)
。(__)
您最近半年使用:0次
18-19高二上·河北唐山·阶段练习
名校
解题方法
2 . 某温度下,向c(H+)=1×10-6 mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的c(H+)=1×10-2 mol·L-1。下列对该溶液的叙述错误的是
| A.该温度高于25 ℃ |
| B.由水电离出来的H+的浓度为1×10-10 mol·L-1 |
| C.加入NaHSO4晶体抑制水的电离 |
| D.取该溶液加水稀释100倍,溶液中的c(OH-)减小 |
您最近半年使用:0次
2022-04-14更新
|
516次组卷
|
29卷引用:考点24 水的电离和溶液的酸碱性-备战2022年高考化学一轮复习考点帮(浙江专用)
(已下线)考点24 水的电离和溶液的酸碱性-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题8.2 水的电离和溶液的pH(讲)-《2020年高考一轮复习讲练测》(已下线)考点24 水的电离和溶液的酸碱性-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考向25 水的电离和溶液的酸碱性-备战2022年高考化学一轮复习考点微专题(已下线)专题25 水的电离和溶液的酸碱性(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练(已下线)专题25 水的电离和溶液的酸碱性(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练(已下线)考点27 水的电离和溶液的pH-备战2023年高考化学一轮复习考点帮(全国通用)浙江省舟山市舟山中学2022-2023学年高二上学期阶段性质量监测化学试题(已下线)3.1.1 水的电离和溶液的酸碱性-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)河北省唐山市第一中学2018-2019学年高二上学期10月月考化学试题【全国百强校】河北省辛集中学2018-2019学年高二上学期期中考试化学试题天津市第一中学2019-2020学年高二上学期期末考试化学试题(已下线)《2020年新高考政策解读与配套资源》模拟试题08-2020年北京新高考化学模拟试题鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第1节 水与水溶液 课时2 溶液的酸碱性与pH高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第二节 水的电离和溶液的pH 课时1 水的电离 溶液的酸碱性与pH(已下线)3.2.1+水的电离和溶液的酸碱性-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)黑龙江省实验中学2020-2021学年高二上学期期中考试化学试题甘肃省会宁县第一中学2020-2021学年高二上学期期中考试化学(理)试题黑龙江省大庆中学2020-2021学年高二上学期期中考试化学试题黑龙江省双鸭山市第一中学2020-2021学年高二第二次月考化学试题(已下线)第03章 水溶液中的离子反应与平衡(A卷基础强化篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)安徽省淮南市2020-2021学年高二上期末考试化学试题选择性必修1 专题3 第一单元 弱电解质的电离平衡天津市武清区杨村第一中学2021-2022学年高二上学期第三次月考化学试题辽宁省沈阳市第一二〇中学2021-2022学年高二上学期第二次质量检测化学试题第二节 水的电离和溶液的pH 第1课时 水的电离(已下线)3.2.1 水的电离-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)辽宁省朝阳市建平县实验中学2022-2023学年高二上学期月考化学试题3.1.1强电解质和弱电解质 弱电解质的电离平衡 课后
2022高三·浙江·专题练习
3 . 在某温度时,将xmol/L氨水滴入10mL1.0mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是
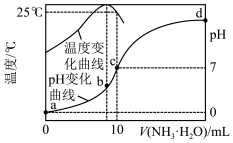

A.a点: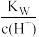 =1.0×10-14 =1.0×10-14 |
| B.氨水的浓度一定大于1.0mol/L |
C.b~d点过程中离子浓度大小关系一定为c(Cl-)>c(NH )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
| D.b、c、d三点水的电离程度大小关系是c>b>d |
您最近半年使用:0次
21-22高三上·浙江杭州·阶段练习
名校
4 . 下列说法正确 的是
| A.测得0.1mol·L-1的一元碱ROH溶液pH=12,则ROH一定为弱电解质 |
| B.25℃时,可溶性正盐BA溶液pH=a,升温至某一温度后pH仍为a,则BA可能为强碱弱酸盐 |
| C.25℃时,测得0.1mol·L-1的一元酸HA溶液pH=b,将该溶液加水稀释100倍,所得溶液的pH=b+2,则HA为弱酸 |
| D.25℃时,pH=1的HA溶液与pH=13的NaOH溶液等体积混合,所得溶液pH一定等于7.0 |
您最近半年使用:0次
2022-01-03更新
|
713次组卷
|
6卷引用:解密10 水溶液中的离子平衡(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)
(已下线)解密10 水溶液中的离子平衡(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)浙江省杭州学军中学2021-2022学年高三上学期12月适应性考试化学试题(已下线)微专题37 强弱电解质的判断与比较-备战2023年高考化学一轮复习考点微专题浙江省宁波市北仑中学2023-2024学年高二上学期期中考试化学试题(已下线)一轮巩固卷4-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(天津专用)(已下线)一轮巩固卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)
2021·四川凉山·一模
5 . 水的电离平衡曲线如图所示,下列说法正确的是
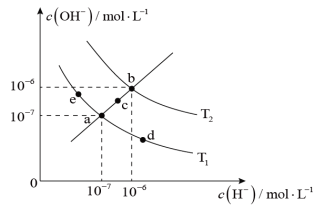

A.图中温度 |
B. 温度时,将 温度时,将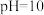 的NaOH溶液与 的NaOH溶液与 的 的 溶液混合,若混合溶液呈中性,则NaOH溶液与 溶液混合,若混合溶液呈中性,则NaOH溶液与 溶液的体积比为 溶液的体积比为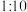 |
C.b点到c点可以通过温度不变,在水中加入适量的 |
D.图中五个点的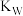 的关系为b>c>a>d=e 的关系为b>c>a>d=e |
您最近半年使用:0次
2021-12-25更新
|
765次组卷
|
5卷引用:解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)
(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)回归教材重难点07 图像数据和结果的分析-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)回归教材重难点07 图像数据和结果的分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)四川省凉山州2021-2022学年高三上学期第一次诊断测试化学试题
21-22高三上·浙江·阶段练习
解题方法
6 . 25℃时,下列说法正确的是
| A.某强碱弱酸盐NaA溶液,随着温度升高,pH一定增大 |
B.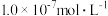 的硫酸溶液中 的硫酸溶液中 |
C.0.1 mol/L的某酸H2A溶液中可能存在: |
| D.pH=7的CH3COOH和CH3COONa混合溶液加水稀释,溶液的pH增大 |
您最近半年使用:0次
2021-12-16更新
|
156次组卷
|
3卷引用:解密10 水溶液中的离子平衡(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)
(已下线)解密10 水溶液中的离子平衡(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用) 浙江省金丽衢十二校2021-2022学年高三上学期第一次联考化学试题河南省商城县观庙高级中学2021-2022学年高二上学期12月月考化学试题
21-22高三上·浙江·阶段练习
解题方法
7 . 碳和硅是带来人类文明的重要元素。
(1)工业上用焦炭在高温下还原二氧化硅可制得含有少量杂质的粗硅。写出该反应的化学反应方程式_______ 。
(2)100℃时,将足量的碳酸氢钠固体置于V L真空恒容容器中,已知: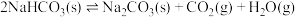 ,上述反应达平衡时体系的总压为100kpa。(分压=总压×物质的量分数)
,上述反应达平衡时体系的总压为100kpa。(分压=总压×物质的量分数)
①下列说法不正确的是_______ 。
A.可通过CO2(g)和H2O(g)的物质的量比值不变来判断该反应达到平衡
B.保持温度、体积不变,平衡体系中不断移走H2O(g),正反应速率增大,逆反应速率减小,平衡向右移动
C.保持体积不变,升高温度,反应速率加快
D.保持温度、体积不变,平衡体系中不断通入等物质的量的CO2(g)和H2O(g), 最终将完全转变为
最终将完全转变为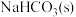
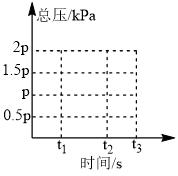
②上述平衡体系t1时刻总压为p(如图),保持温度不变,t1时刻突然将容器的体积变为原来一半且保持不变,到t2时刻达到平衡,在图中画出 时体系的总压
时体系的总压______ 。
(3)大气中部分CO2溶于水并与水进一步发生反应。常温下,反应方程式如下:
①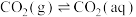
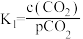
②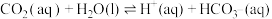 K2
K2
其中pCO2为CO2(g)在空气中的分压,c(CO2)为CO2在水溶液中的平衡浓度。当大气压强为p kPa,大气中CO2(g)的物质的量分数为x时,溶液中H+浓度为_______ mol/L(用K1、K2、p、x、Kw表示,考虑水的电离,忽略 的电离)
的电离)
(4)甲烷气相热分解反应方程式为: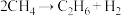 ,该反应的机理如下:
,该反应的机理如下:
① ,②_______,③
,②_______,③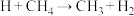 ④
④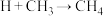 ,补充反应②反应方程式:
,补充反应②反应方程式:_______ 。
(5)在地壳内,深度每增加1km,压强约增加25250~30300kPa,这对固体物质的平衡会发生较大的影响。如:
地壳中存在CaAl2Si2O8、Mg2SiO4和CaMg2Al2Si3O12,在地壳区域高压条件下,有利于_______ (写化学式)生成,试结合上述数据解释原因_______ 。
(1)工业上用焦炭在高温下还原二氧化硅可制得含有少量杂质的粗硅。写出该反应的化学反应方程式
(2)100℃时,将足量的碳酸氢钠固体置于V L真空恒容容器中,已知:
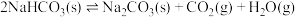 ,上述反应达平衡时体系的总压为100kpa。(分压=总压×物质的量分数)
,上述反应达平衡时体系的总压为100kpa。(分压=总压×物质的量分数)①下列说法不正确的是
A.可通过CO2(g)和H2O(g)的物质的量比值不变来判断该反应达到平衡
B.保持温度、体积不变,平衡体系中不断移走H2O(g),正反应速率增大,逆反应速率减小,平衡向右移动
C.保持体积不变,升高温度,反应速率加快
D.保持温度、体积不变,平衡体系中不断通入等物质的量的CO2(g)和H2O(g),
 最终将完全转变为
最终将完全转变为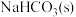
②上述平衡体系t1时刻总压为p(如图),保持温度不变,t1时刻突然将容器的体积变为原来一半且保持不变,到t2时刻达到平衡,在图中画出
 时体系的总压
时体系的总压
(3)大气中部分CO2溶于水并与水进一步发生反应。常温下,反应方程式如下:
①
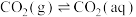
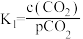
②
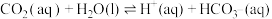 K2
K2其中pCO2为CO2(g)在空气中的分压,c(CO2)为CO2在水溶液中的平衡浓度。当大气压强为p kPa,大气中CO2(g)的物质的量分数为x时,溶液中H+浓度为
 的电离)
的电离)(4)甲烷气相热分解反应方程式为:
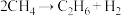 ,该反应的机理如下:
,该反应的机理如下:①
 ,②_______,③
,②_______,③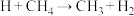 ④
④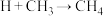 ,补充反应②反应方程式:
,补充反应②反应方程式:(5)在地壳内,深度每增加1km,压强约增加25250~30300kPa,这对固体物质的平衡会发生较大的影响。如:

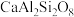 (钙长石) (钙长石) |  (镁橄榄石) (镁橄榄石) | 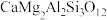 (钙镁石榴子石) | |
| 摩尔质量(g/mol) | 278 | 140 | 418 |
| 密度(g/cm) | 2.70 | 3.22 | 3.50 |
地壳中存在CaAl2Si2O8、Mg2SiO4和CaMg2Al2Si3O12,在地壳区域高压条件下,有利于
您最近半年使用:0次
21-22高三上·浙江·阶段练习
8 . 常温下,0.1mol/L的CH3COONa溶液的pH=8.8,发生:
①:H2O H++OH− Kw
H++OH− Kw
②:CH3COO−+H+ CH3COOH K1
CH3COOH K1
③:CH3COO−+H2O CH3COOH+OH− K2
CH3COOH+OH− K2
下列说法不正确 的是
①:H2O
 H++OH− Kw
H++OH− Kw②:CH3COO−+H+
 CH3COOH K1
CH3COOH K1③:CH3COO−+H2O
 CH3COOH+OH− K2
CH3COOH+OH− K2下列说法
| A.K2=K1×Kw |
| B.由水电离的氢离子浓度为10−8.8mol·L−1 |
| C.常温下,该溶液加水稀释后,n(H+)与n(OH-)的乘积变大 |
| D.常温下,向100mL该溶液中加入100mL pH=8.8的NaOH溶液,所得溶液的pH仍为8.8 |
您最近半年使用:0次
21-22高二上·辽宁沈阳·开学考试
名校
9 . 已知水在25℃和95℃时的电离平衡曲线如图所示。

(1)25℃时水的电离平衡曲线应为___________ (填“A”或“B”)。请说明理由___________ 。25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为___________ 。
(2)95℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是___________ 。
(3)在曲线A所对应的温度下,pH=2的HCl溶液和pH=11的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1___________ α2(填“大于”“小于”“等于”“无法确定”,下同),若将二者等体积混合,则混合液的pH___________ 7,判断的理由是___________ 。
(4)在曲线B所对应的温度下,将0.02mol·L-1的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH=___________ 。

(1)25℃时水的电离平衡曲线应为
(2)95℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是
(3)在曲线A所对应的温度下,pH=2的HCl溶液和pH=11的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1
(4)在曲线B所对应的温度下,将0.02mol·L-1的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH=
您最近半年使用:0次
2021-09-14更新
|
2024次组卷
|
5卷引用:解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)
(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)辽宁省沈阳市第八十三中学2021-2022学年高二上学期期初考试化学试题河北饶阳中学2021-2022学年高二上学期第一阶段考试化学试题(已下线)第3章 水溶液中的离子反应与平衡(章末检测)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)
2021高三·浙江·专题练习
解题方法
10 . 100℃时Kw=1.0×10-12 mol2·L-2,0.01 mol·L-1盐酸的pH=2,0.01 mol·L-1的NaOH溶液的pH=10。( )
您最近半年使用:0次



