解题方法
1 . 请回答下列问题:
(1)已知常温下H2A的Ka1 = 1×10-8,Ka2 = 1×10-11,则NaHA溶液中呈_______ 性,计算说明理由_______ ,溶液中离子浓度排序_______ 。
(2)常温时,pH=3的盐酸中由水电离出的c(H+)为_______ mol·L-1。
(3)100℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2。此时水的离子积
_______ ,溶液中 为
为_______ mol·L-1。
(1)已知常温下H2A的Ka1 = 1×10-8,Ka2 = 1×10-11,则NaHA溶液中呈
(2)常温时,pH=3的盐酸中由水电离出的c(H+)为
(3)100℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2。此时水的离子积

 为
为
您最近一年使用:0次
名校
解题方法
2 . 请根据要求回答下列问题。
(1)1 mol·L-1 Na2CO3溶液的pH_______ (填“>”“<”或“=”, 下同)0.1 mol·L-1Na2CO3溶液的pH;1 mol·L-1 Na2CO3溶液的水解程度_______ 0. 1 mol·L-1Na2CO3溶液的水解程度。
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则pH=9的NaOH溶液与pH=4的H2SO4溶液的体积之比为_______ 。
(3)X、Y、Z、 W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表是常温下浓度均为0.01mol/L的X、Y、Z、W溶液的pH。将X、Y、Z各1 mol同时溶于水中得到混合溶液,则混合溶液中各离子的浓度由大到小的顺序为_______ 。
(1)1 mol·L-1 Na2CO3溶液的pH
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则pH=9的NaOH溶液与pH=4的H2SO4溶液的体积之比为
(3)X、Y、Z、 W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表是常温下浓度均为0.01mol/L的X、Y、Z、W溶液的pH。将X、Y、Z各1 mol同时溶于水中得到混合溶液,则混合溶液中各离子的浓度由大到小的顺序为
| 0.01mol/L的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
您最近一年使用:0次
解题方法
3 . 碳和硅是带来人类文明的重要元素。
(1)工业上用焦炭在高温下还原二氧化硅可制得含有少量杂质的粗硅。写出该反应的化学反应方程式_______ 。
(2)100℃时,将足量的碳酸氢钠固体置于V L真空恒容容器中,已知: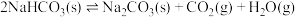 ,上述反应达平衡时体系的总压为100kpa。(分压=总压×物质的量分数)
,上述反应达平衡时体系的总压为100kpa。(分压=总压×物质的量分数)
①下列说法不正确的是_______ 。
A.可通过CO2(g)和H2O(g)的物质的量比值不变来判断该反应达到平衡
B.保持温度、体积不变,平衡体系中不断移走H2O(g),正反应速率增大,逆反应速率减小,平衡向右移动
C.保持体积不变,升高温度,反应速率加快
D.保持温度、体积不变,平衡体系中不断通入等物质的量的CO2(g)和H2O(g), 最终将完全转变为
最终将完全转变为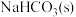
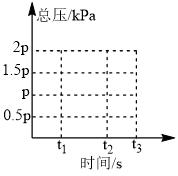
②上述平衡体系t1时刻总压为p(如图),保持温度不变,t1时刻突然将容器的体积变为原来一半且保持不变,到t2时刻达到平衡,在图中画出 时体系的总压
时体系的总压______ 。
(3)大气中部分CO2溶于水并与水进一步发生反应。常温下,反应方程式如下:
①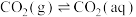
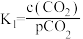
②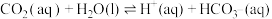 K2
K2
其中pCO2为CO2(g)在空气中的分压,c(CO2)为CO2在水溶液中的平衡浓度。当大气压强为p kPa,大气中CO2(g)的物质的量分数为x时,溶液中H+浓度为_______ mol/L(用K1、K2、p、x、Kw表示,考虑水的电离,忽略 的电离)
的电离)
(4)甲烷气相热分解反应方程式为: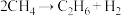 ,该反应的机理如下:
,该反应的机理如下:
① ,②_______,③
,②_______,③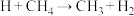 ④
④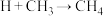 ,补充反应②反应方程式:
,补充反应②反应方程式:_______ 。
(5)在地壳内,深度每增加1km,压强约增加25250~30300kPa,这对固体物质的平衡会发生较大的影响。如:
地壳中存在CaAl2Si2O8、Mg2SiO4和CaMg2Al2Si3O12,在地壳区域高压条件下,有利于_______ (写化学式)生成,试结合上述数据解释原因_______ 。
(1)工业上用焦炭在高温下还原二氧化硅可制得含有少量杂质的粗硅。写出该反应的化学反应方程式
(2)100℃时,将足量的碳酸氢钠固体置于V L真空恒容容器中,已知:
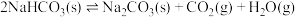 ,上述反应达平衡时体系的总压为100kpa。(分压=总压×物质的量分数)
,上述反应达平衡时体系的总压为100kpa。(分压=总压×物质的量分数)①下列说法不正确的是
A.可通过CO2(g)和H2O(g)的物质的量比值不变来判断该反应达到平衡
B.保持温度、体积不变,平衡体系中不断移走H2O(g),正反应速率增大,逆反应速率减小,平衡向右移动
C.保持体积不变,升高温度,反应速率加快
D.保持温度、体积不变,平衡体系中不断通入等物质的量的CO2(g)和H2O(g),
 最终将完全转变为
最终将完全转变为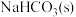
②上述平衡体系t1时刻总压为p(如图),保持温度不变,t1时刻突然将容器的体积变为原来一半且保持不变,到t2时刻达到平衡,在图中画出
 时体系的总压
时体系的总压
(3)大气中部分CO2溶于水并与水进一步发生反应。常温下,反应方程式如下:
①
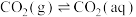
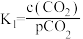
②
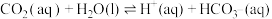 K2
K2其中pCO2为CO2(g)在空气中的分压,c(CO2)为CO2在水溶液中的平衡浓度。当大气压强为p kPa,大气中CO2(g)的物质的量分数为x时,溶液中H+浓度为
 的电离)
的电离)(4)甲烷气相热分解反应方程式为:
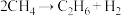 ,该反应的机理如下:
,该反应的机理如下:①
 ,②_______,③
,②_______,③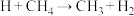 ④
④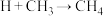 ,补充反应②反应方程式:
,补充反应②反应方程式:(5)在地壳内,深度每增加1km,压强约增加25250~30300kPa,这对固体物质的平衡会发生较大的影响。如:

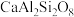 (钙长石) (钙长石) |  (镁橄榄石) (镁橄榄石) | 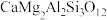 (钙镁石榴子石) | |
| 摩尔质量(g/mol) | 278 | 140 | 418 |
| 密度(g/cm) | 2.70 | 3.22 | 3.50 |
地壳中存在CaAl2Si2O8、Mg2SiO4和CaMg2Al2Si3O12,在地壳区域高压条件下,有利于
您最近一年使用:0次
解题方法
4 . 请回答下列问题:
(1)某温度下,水的离子积常数Kw=2×10-13,0.02mol·L-1的NaOH溶液的pH=___________ 。
(2)25℃时,0.10 mol·L-1的HA溶液中 =1010,该HA溶液的pH=
=1010,该HA溶液的pH=___________ 。
(3)pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后,CH3COONa溶液的pH___________ NaOH溶液的pH(填“>”“<””或“=”)。
(4)将物质的量浓度相同的盐酸与氨水混合后,溶液中的c( )=c(Cl-),则盐酸的体积
)=c(Cl-),则盐酸的体积___________ 氨水的体积(填“>”“<””或“=”)。
(5)某学生用0.1 mol·L-1盐酸标准溶液滴定未知浓度的NaOH溶液,其操作步骤如下:
A.移取20.00 mL待测溶液注入洁净的锥形瓶中,并加入2~3滴酚酞试液。
B.用标准溶液润洗滴定管2~3次。
C.调节滴定管旋塞使尖嘴充满溶液,把盛有标准溶液的酸式滴定管固定好。
D.取标准盐酸溶液注入酸式滴定管至零刻度以上2~3 cm。
E.调节液面至零刻度(或以下),记下读数V1。
F.用标准溶液滴定至终点,记下滴定管液面的刻度V2。
请写出操作步骤的正确顺序___________ (填序号)。
(1)某温度下,水的离子积常数Kw=2×10-13,0.02mol·L-1的NaOH溶液的pH=
(2)25℃时,0.10 mol·L-1的HA溶液中
 =1010,该HA溶液的pH=
=1010,该HA溶液的pH=(3)pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后,CH3COONa溶液的pH
(4)将物质的量浓度相同的盐酸与氨水混合后,溶液中的c(
 )=c(Cl-),则盐酸的体积
)=c(Cl-),则盐酸的体积(5)某学生用0.1 mol·L-1盐酸标准溶液滴定未知浓度的NaOH溶液,其操作步骤如下:
A.移取20.00 mL待测溶液注入洁净的锥形瓶中,并加入2~3滴酚酞试液。
B.用标准溶液润洗滴定管2~3次。
C.调节滴定管旋塞使尖嘴充满溶液,把盛有标准溶液的酸式滴定管固定好。
D.取标准盐酸溶液注入酸式滴定管至零刻度以上2~3 cm。
E.调节液面至零刻度(或以下),记下读数V1。
F.用标准溶液滴定至终点,记下滴定管液面的刻度V2。
请写出操作步骤的正确顺序
您最近一年使用:0次
解题方法
5 . Ⅰ.现有下列4种重要的有机物:
① ②
② ③
③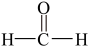 ④
④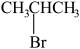
请回答:
(1)能与苯酚缩合成高分子化合物的是__________ 。(填序号)。
(2)能使酸性高锰酸钾溶液褪色的是__________ 。(填序号)。
(3)写出④在一定条件下发生消去反应的化学方程式__________ 。
Ⅱ.2020年3月22日为第28届世界水日,化学中有很多与水相关的化学知识。
(1)海水会腐蚀铁质海轮外壳,制造海轮时会在船底四周镶嵌_____ 。(填“锌块”或“铜块”)
(2)自来水厂常用含有Fe3+的净水剂净水,其原理是______ 。(用离子方程式表示)
(3)自来水常用氯气杀菌消毒,Cl2+H2O⇌HCl+HClO,要增大HClO的浓度,可以加入下列物质中的__________ 。
A.NaOH B.浓HCl C.CaCO3固体 D.H2O E.SO2
(4)常温下,0.01mol·L-1NaOH溶液,由水电离出的c(OH−)=______ mol·L-1。
①
 ②
② ③
③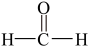 ④
④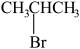
请回答:
(1)能与苯酚缩合成高分子化合物的是
(2)能使酸性高锰酸钾溶液褪色的是
(3)写出④在一定条件下发生消去反应的化学方程式
Ⅱ.2020年3月22日为第28届世界水日,化学中有很多与水相关的化学知识。
(1)海水会腐蚀铁质海轮外壳,制造海轮时会在船底四周镶嵌
(2)自来水厂常用含有Fe3+的净水剂净水,其原理是
(3)自来水常用氯气杀菌消毒,Cl2+H2O⇌HCl+HClO,要增大HClO的浓度,可以加入下列物质中的
A.NaOH B.浓HCl C.CaCO3固体 D.H2O E.SO2
(4)常温下,0.01mol·L-1NaOH溶液,由水电离出的c(OH−)=
您最近一年使用:0次
解题方法
6 . 请回答以下问题
(1)某温度时,测得pH=11的Ba(OH)2溶液浓度是0.005mol·L-1。
①该温度下水的离子积常数Kw=________ 。
②在此温度下,将pH=12的Ba(OH)2溶液Va L与pH=2的硫酸Vb L混合。若所得混合液为中性,则Va∶Vb=________ 。
(2)25 ℃时,部分物质的电离平衡常数如下表所示。请回答下列问题:
①下列说法正确的是__________
A.25 ℃时,向CH3COOH溶液中加入适量的NaOH溶液,CH3COOH的电离程度增大,电离平衡常数不变
B.0.1mol•L-1 CH3COOH溶液加水稀释,稀释后的溶液中水的电离程度减小
C.0.1mol•L-1 HClO溶液和0.1mol•L-1 NaClO溶液等体积混合呈溶液碱性
D.碳酸氢钠溶液中阴阳离子数目相等
② 同浓度的CH3COO-、HCO 、CO32-、ClO-结合H+的能力由强到弱的顺序为
、CO32-、ClO-结合H+的能力由强到弱的顺序为___
③ 25 ℃时,某CH3COOH和CH3COOK混合溶液呈中性,则该混合溶液中: =
=________
(3)煤燃烧排放的烟气含有SO2和NO,采用碱性的NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×10−3mol·L−1。反应10min后溶液中离子浓度的分析结果如下表。
①写出NaClO2溶液脱硝过程中主要反应 的离子方程式______ 。
②如果采用Ca(ClO)2替代NaClO2,其脱硫效果会更好。试从化学平衡原理分析,Ca(ClO)2相比NaClO2具有的优点是________ 。
(1)某温度时,测得pH=11的Ba(OH)2溶液浓度是0.005mol·L-1。
①该温度下水的离子积常数Kw=
②在此温度下,将pH=12的Ba(OH)2溶液Va L与pH=2的硫酸Vb L混合。若所得混合液为中性,则Va∶Vb=
(2)25 ℃时,部分物质的电离平衡常数如下表所示。请回答下列问题:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10—5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
①下列说法正确的是
A.25 ℃时,向CH3COOH溶液中加入适量的NaOH溶液,CH3COOH的电离程度增大,电离平衡常数不变
B.0.1mol•L-1 CH3COOH溶液加水稀释,稀释后的溶液中水的电离程度减小
C.0.1mol•L-1 HClO溶液和0.1mol•L-1 NaClO溶液等体积混合呈溶液碱性
D.碳酸氢钠溶液中阴阳离子数目相等
② 同浓度的CH3COO-、HCO
 、CO32-、ClO-结合H+的能力由强到弱的顺序为
、CO32-、ClO-结合H+的能力由强到弱的顺序为③ 25 ℃时,某CH3COOH和CH3COOK混合溶液呈中性,则该混合溶液中:
 =
=(3)煤燃烧排放的烟气含有SO2和NO,采用碱性的NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×10−3mol·L−1。反应10min后溶液中离子浓度的分析结果如下表。
| 离子 | SO42− | SO32− | NO3− | NO2− | Cl− |
| c/(mol·L−1) | 8.35×10−4 | 6.87×10−6 | 1.5×10−4 | 1.2×10−5 | 3.4×10−3 |
①写出NaClO2溶液脱硝过程中
②如果采用Ca(ClO)2替代NaClO2,其脱硫效果会更好。试从化学平衡原理分析,Ca(ClO)2相比NaClO2具有的优点是
您最近一年使用:0次



