真题
名校
1 . 某温度下,向一定体积 0.1mol/L 醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH (pOH = -lg[OH-])与pH的变化关系如图所示,则
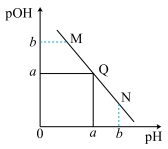

| A.M点所示溶液导电能力强于Q点 |
| B.N点所示溶液中c(CH3COO-)>c(Na+) |
| C.M点和N点所示溶液中水的电离程度可能相同 |
| D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积 |
您最近一年使用:0次
2019-01-30更新
|
1891次组卷
|
17卷引用:2018年5月14日 押高考化学第13题(1)——《每日一题》2018年高三化学四轮复习
(已下线)2018年5月14日 押高考化学第13题(1)——《每日一题》2018年高三化学四轮复习高二人教版选修4 第三章 第二节 水的电离和溶液的酸碱性(已下线)2019年3月3日《每日一题》二轮复习- 每周一测(已下线)2019年5月13日 《每日一题》四轮复习——押高考化学第13题(1)2013年全国普通高等学校招生统一考试理科综合能力测试化学(山东卷)(已下线)2013-2014学年湖北省荆州中学高二上学期期中考试化学试卷(已下线)2014高考名师推荐化学溶液的PH及PH计算2014-2015学年湖北省长阳县第一高级中学高二上学期期中化学试卷2015-2016学年河北省衡水中学高二上二调考试化学试卷2017届河北省沧州一中高三上10.6周测化学试卷2017届福建省宁德市高三上学期单科质检模拟化学试卷山东省寿光现代中学2017-2018学年高二12月月考化学试题湖北省荆州中学2017-2018学年高二12月阶段性质量检测化学试题陕西师范大学附中2017-2018第一学期高二年级化学期中考试化学试题【全国百强校】贵州省思南中学2018-2019学年高二上学期第二次月考化学试题吉林省白城市第一中学2018-2019学年高一下学期期末考试化学试题黑龙江省牡丹江市第二中学2022-2023学年高二上学期期中考试化学试题
2018高三上·全国·专题练习
解题方法
2 . Ⅰ.已知常温下,在NaHSO3溶液中c(H2SO3)<c( ),且H2SO3的电离平衡常数为K1=1.5×10-2,K2=1.1×10-7;氨水的电离平衡常数为K=1.8×10-5;回答下列问题:
),且H2SO3的电离平衡常数为K1=1.5×10-2,K2=1.1×10-7;氨水的电离平衡常数为K=1.8×10-5;回答下列问题:
(1)等物质的量浓度的下列五种溶液:①NH3·H2O ②(NH4)2SO3 ③KHSO3 ④K2SO3 ⑤H2SO3溶液中水的电离程度由大到小排列顺序为____________ (填序号)。
(2)NaHSO3可以将碘盐中的KIO3还原为碘单质,试写出此反应的离子方程式:_________________________________________ 。
Ⅱ.(1)在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显________ (填“酸”、“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb=_____________ 。
(2)已知H2CO3的第二级电离常数K2=5.6×10-11,HClO的电离常数K=3.0×10-8,写出下列条件下所发生反应的离子方程式:
①少量Cl2通入到过量的Na2CO3溶液中:___________________________________ 。
②Cl2与Na2CO3按物质的量之比1∶1恰好反应:_______________________ 。
③少量CO2通入到过量的NaClO溶液中:_____________________________ 。
 ),且H2SO3的电离平衡常数为K1=1.5×10-2,K2=1.1×10-7;氨水的电离平衡常数为K=1.8×10-5;回答下列问题:
),且H2SO3的电离平衡常数为K1=1.5×10-2,K2=1.1×10-7;氨水的电离平衡常数为K=1.8×10-5;回答下列问题:(1)等物质的量浓度的下列五种溶液:①NH3·H2O ②(NH4)2SO3 ③KHSO3 ④K2SO3 ⑤H2SO3溶液中水的电离程度由大到小排列顺序为
(2)NaHSO3可以将碘盐中的KIO3还原为碘单质,试写出此反应的离子方程式:
Ⅱ.(1)在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显
(2)已知H2CO3的第二级电离常数K2=5.6×10-11,HClO的电离常数K=3.0×10-8,写出下列条件下所发生反应的离子方程式:
①少量Cl2通入到过量的Na2CO3溶液中:
②Cl2与Na2CO3按物质的量之比1∶1恰好反应:
③少量CO2通入到过量的NaClO溶液中:
您最近一年使用:0次
名校
3 . 已知Kb(NH3·H2O)=1.7×10-5,Ka(CH3COOH)=1.7×10-5。25℃时,向20mL浓度均为0.01mol·L-1的盐酸和醋酸的混合溶液中逐滴加入0.01mol·L-1的氨水,测定过程中电导率和pH变化曲线如图所示,下列说法错误的是


| A.a点溶液中,c(CH3COO-)数量级约为10-5 |
| B.b点溶液中,c(NH4+) > c(CH3COOH) |
| C.c点溶液中,c(NH4+) +c(NH3·H2O) = c(Cl-)+c(CH3COO-)+c(CH3COOH) |
| D.c点水的电离程度小于d点 |
您最近一年使用:0次
2018-05-29更新
|
1128次组卷
|
3卷引用:回归教材重难点09 盘点溶液中的“四大”平衡-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)
(已下线)回归教材重难点09 盘点溶液中的“四大”平衡-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)【全国百强校】广西南宁市第三中学2018届高三第二次模拟考试理综化学试题河南省六市2022届高三第一次联合调研检测理综化学试题
名校
4 . 室温下,用相同物质的量浓度的 HCl 溶液,分别滴定物质的量浓度均为 0.1 mol/L 的三种碱溶液,滴定 曲线如图所示。下列判断正确的是
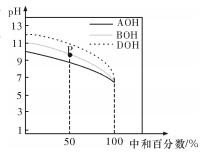

| A.滴定前,三种碱溶液中水电离出的 c(H+)大小关系: DOH>BOH>AOH |
| B.pH= 7 时,c(A+)=c(B+)=c(D+) |
| C.滴定至 P 点时,溶液中:c(Cl-)>c(B+)>c(BOH)>c(OH-)>c(H+) |
| D.当中和百分数达 100%时,将三种溶液混合后:c(AOH)+c(BOH)+c(DOH)=c(H+)-c(OH-) |
您最近一年使用:0次
2018-04-27更新
|
1615次组卷
|
6卷引用:2020届高三化学选修4二轮专题练——酸碱中和滴定的曲线分析【精编25题】
名校
5 . 常温下,用0.1 mol/L的NaOH溶液滴定20 mL同浓度的一元弱酸HA,滴定过程中溶液pH随NaOH溶液体积变化曲线如图所示(忽略中和热效应),下列说法正确的是
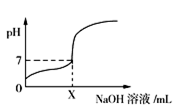

| A.X=20 |
B.HA溶液加水稀释后,溶液中 的值减小 的值减小 |
| C.0.1 mol/L的NaOH溶液中,由水电离出的c(OH−)=0.1 mol/L |
| D.加入NaOH溶液体积为X mL时,溶液中c(A−)=0.05 mol/L |
您最近一年使用:0次
2018-03-01更新
|
581次组卷
|
5卷引用:2019年秋高三化学复习强化练习—— 酸碱中和滴定
名校
6 . 已知:pKa=-lgKa,25℃时,H2A的pKa1=1.85,pKa2=7.19。常温下,用0.1mol·L—1NaOH溶液滴定20mL0.l mol·L—1H2A溶液的滴定曲线如右图所示(曲线上的数字为pH)。下列说法正确的是


| A.a点所得溶液中c(H2A)+c(A2—)+c(HA—)=0.1 mol·L—1 |
| B.b点所得溶液中:c(H2A)+2c(H+)=c(A2—)+2c(OH—) |
| C.对应溶液的电导率:a<b<c<d |
| D.对应溶液水的电离程度:a>b>c>d |
您最近一年使用:0次
2018-02-23更新
|
612次组卷
|
6卷引用:夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——盐类水解中三大守恒的应用
7 . 下列图示与对应的叙述不相符的是


| A.图1表示同温度下,pH=1 的盐酸和醋酸溶液分别加水稀释时pH 的变化曲线,其中曲线Ⅱ为醋酸,且a 点溶液的导电性比b 点强 |
| B.图2 中纯水仅升高温度,不能使a点变到c点 |
| C.图3 表示25 ℃时,用0.100 0 mol・L-1HCl 滴定20 mL 0.100 0 mol・L-1NaOH 溶液,溶液的pH随加入盐酸体积的变化 |
| D.用0.010 0 mol・L-1AgNO3标准溶液滴定浓度均为0.100 0 mol・L-1Cl-、Br-及I-的混合溶液,由图4 曲线,可确定首先沉淀的是I- |
您最近一年使用:0次
2018-02-01更新
|
391次组卷
|
2卷引用:夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——水的电离及水的离子积专练
名校
8 . 类比是重要的学习方法,类比pH的定义可定义pOH和pKW。在某弱酸HX及其盐NaX的混合溶液中(HX和NaX的含量不确定),c(H+)和c(OH-)存在如图所示的关系,则下列说法不正确的是


| A.图中温度T2>25℃ |
| B.若此混合溶液呈酸性且c(HX)=c(NaX),则HX电离能力大于NaX的水解能力 |
C.位于AB线段上任意点的溶液均有pH=pOH=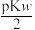 |
| D.图中D点处溶液中离子浓度:c(Na+)>c(X-) |
您最近一年使用:0次
2018-01-21更新
|
646次组卷
|
3卷引用:2020届高三化学二轮冲刺新题专练——弱电解质的电离应用
9 . 极稀溶液中溶质的物质的量浓度很小,常用其负对数pc表示(pcB=-lgcB)。如某溶液中溶质的物质的量浓度为1×10﹣5mol·L﹣1 , 则该溶液中溶质的pc=5。下列说法正确的是
| A.电解质溶液的pc(H+)与pc(OH﹣)之和均为14 |
| B.用盐酸滴定某浓度的KOH溶液,滴定过程中pc(H+)逐渐增大 |
| C.BaCl2溶液中逐滴加入硫酸溶液,滴加过程中pc(Ba2+)逐渐减小 |
| D.某温度下Ksp(AgCl)=1.0×10﹣10 ,则其饱和溶液中pc(Ag+)+ pc(Cl﹣)=10 |
您最近一年使用:0次
2018-01-10更新
|
194次组卷
|
4卷引用:【中等生百日捷进提升系列-基础练测】专题2.8 水溶液中的离子平衡
(已下线)【中等生百日捷进提升系列-基础练测】专题2.8 水溶液中的离子平衡河南省开封市2018届高三上学期第一次模拟考试(12月)理综化学试题陕西省黄陵中学2018届高三(普通班)上学期期末考试化学试题【区级联考】山东省临沂市罗庄区2018-2019学年高二上学期期末考试化学试题
名校
10 . 下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A.pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(OH-)相等 |
| B.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH) |
| C.常温下物质的量浓度相等的①NH4HCO3、②NH4HSO4、③NH4Fe(SO4)2、④NH3•H2O三种溶液中NH4+的浓度:②>③>①>④ |
| D.等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数:N前>N后 |
您最近一年使用:0次
2018-01-02更新
|
184次组卷
|
3卷引用:黄金30题系列 高二化学(选修4) 小题好拿分【提升版】
(已下线)黄金30题系列 高二化学(选修4) 小题好拿分【提升版】辽宁省抚顺市第十九中学2016-2017学年高二上学期期中考试化学试题河北省定州中学2017-2018学年高二(承智班)上学期第二次月考化学试题



