名校
解题方法
1 . 室温下,体积均为20mL、浓度均为0.1mol·L-1的HX溶液、HY溶液中分别滴加同浓度的NaOH溶液,反应后溶液中水电离的c(H+)水的负对数[–lgc(H+)水]与滴加氢氧化钠溶液体积的关系如图所示。下列说法正确的是
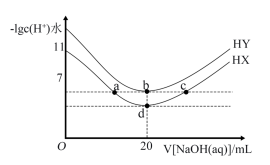

| A.室温时,Ka(HX)=10-6 |
| B.a、b、c三点溶液均显中性 |
| C.b、d两点溶液的离子总浓度不同 |
| D.c点溶液中c(X-)+c(HX)=0.1mol·L-1 |
您最近一年使用:0次
2021-03-12更新
|
1005次组卷
|
5卷引用:押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)
(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)(已下线)小题20 弱电解质的电离,水的电离,溶液pH——备战2021年高考化学经典小题考前必刷(全国通用)安徽省马鞍山市2021届高三第一次模拟理综化学试题广东省华附、省实、广雅、深中四校2020-2021学年高二下学期期末联考化学试题甘肃省张掖市高台县第一中学2022-2023学年高三上学期第四次检测化学试题
名校
解题方法
2 . 常温下,磷酸钠溶液中含磷微粒的分布随pH的变化如图所示,M、N、P三点对应的pH分别为a、b、c,其中δ表示含磷微粒的物质的量分数。下列说法错误的是
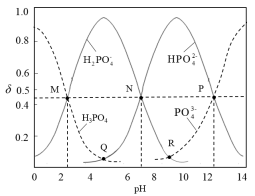

A.常温下, 的一级电离平衡常数Ka1=10-a 的一级电离平衡常数Ka1=10-a |
B.常温下,溶液中水电离出的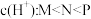 |
C.Q点与R点对应溶液的pH差: |
D.用磷酸标准溶液滴定NaOH溶液,选择酚酞作指示剂,终点时溶质主要为 |
您最近一年使用:0次
2021-02-03更新
|
1092次组卷
|
7卷引用:专题18 酸碱混合图像为载体考查离子平衡-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)
(已下线)专题18 酸碱混合图像为载体考查离子平衡-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)专题11 水溶液中的离子平衡图像(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(已下线)专题四 电解质溶液图象(练)河南省新乡市2020-2021学年高二上学期期末考试化学试题湖北省仙桃中学、天门中学(B班)2021-2022学年高二上学期期中考试化学试题江西省宜春市铜鼓中学2021-2022学年高二下学期第一次月考(实验班)化学试卷湖南省衡阳市第八中学2022-2023学年高二下学期5月月考化学试题
名校
解题方法
3 . 常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0 mol•L﹣1的KNO3溶液:H+、Fe2+、Cl﹣、SO |
B.c(H+)/c(OH﹣)=1012的溶液中:NH 、Al3+、NO 、Al3+、NO 、Cl﹣ 、Cl﹣ |
C.由水电离的c(H+)=1×10﹣13mol/L溶液中:K+、Na+、AlO 、CO 、CO |
D.含1.0mol•L﹣1Al3+的溶液中:Na+、HCO 、SO 、SO 、Mg2+ 、Mg2+ |
您最近一年使用:0次
4 . 室温下,用0.10mol/L CH3 COOH溶液滴定10.00mL浓度均为0.10 mol/L NaOH和NH3·H2O的混合液,混合溶液的相对导电能力随乙酸滴入的变化曲线如下图所示。已知:Ka(CH3COOH)=1. 8×10-5,Kb( NH3·H2O) =1. 8× l0-5。下列叙述错误的是


| A.ab段为CH3COOH与NaOH的中和过程 |
| B.b点水的电离程度最大 |
| C.c点3c(Na+)=2c(CH3 COOH)+2c(CH3 COO-) |
D.d点c(Na+)>c(NH )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
您最近一年使用:0次
2020-07-18更新
|
432次组卷
|
4卷引用:第19讲 水的电离和溶液的酸碱性-2021年高考化学一轮复习名师精讲练
(已下线)第19讲 水的电离和溶液的酸碱性-2021年高考化学一轮复习名师精讲练(已下线)第18讲 弱电解质的电离-2021年高考化学一轮复习名师精讲练四川省成都市2019-2020学年高二下学期期末摸底考试化学试题四川省成都市2020-2021学年高二12月测试化学试题
5 . 298K时,向20mL均为0.1mol·L-1的MOH和NH3·H2O混合液中滴加0.1mol·L-1的CH3COOH溶液,测得混合液的电阻率(表示电阻特性的物理量)与加入CH3COOH溶液的体积(V)的关系如图所示。已知:CH3COOH的Ka=l.8×10-5,NH3•H2O的Kb=l.8×l0-5。下列说法错误的是( )
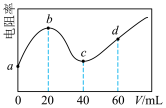

| A.碱性:MOH>NH3·H2O |
| B.c点溶液中浓度:c(CH3COOH)>c(NH3•H2O) |
| C.d点溶液的pH≈5 |
| D.a→d过程中水的电离程度先减小后增大 |
您最近一年使用:0次
6 . 弱电解质的电离平衡、盐类的水解平衡均属于化学平衡。根据要求回答问题。
(1)一定温度下,向1L0.1mol·L-1CH3COOH溶液中加入0.1molCH3COONa固体,则醋酸的电离平衡向________ (填“正”或“逆”)反应方向移动;水的电离程度将________ (填“增大”、“减小”或“不变”)。
(2)99℃时,KW=1.0×10-12mol2·L-2,该温度下测得0.1mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为______ 。
②体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气_____ 。
A.盐酸多B.H2A多C.一样多D.无法确定
③将0.1mol·L-1H2A溶液与0.2mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度的电荷守恒关系式为__________ 。
(3)已知常温下,H2SO3的电离常数为Kal=1.54×10-2,Ka2=1.02×10-7,H2CO3的电离常数为Kal=4.30×10-7,Ka2=5.60×10-11。
①下列微粒可以大量共存的是________ (填字母)。
a. 、
、 b.
b. 、
、 c.
c. 、
、 d.H2SO3、
d.H2SO3、
②已知NaHSO3溶液显酸性,溶液中各离子浓度从大到小的排列顺序是_______ 。
(4)0.1mol·L-1的NaHA溶液,测得溶液显碱性。则该溶液中c(H2A)________ c(A2-)(填“>”、“<”或“=”),作出此判断的依据是__________ (用文字解释)。
(1)一定温度下,向1L0.1mol·L-1CH3COOH溶液中加入0.1molCH3COONa固体,则醋酸的电离平衡向
(2)99℃时,KW=1.0×10-12mol2·L-2,该温度下测得0.1mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为
②体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气
A.盐酸多B.H2A多C.一样多D.无法确定
③将0.1mol·L-1H2A溶液与0.2mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度的电荷守恒关系式为
(3)已知常温下,H2SO3的电离常数为Kal=1.54×10-2,Ka2=1.02×10-7,H2CO3的电离常数为Kal=4.30×10-7,Ka2=5.60×10-11。
①下列微粒可以大量共存的是
a.
 、
、 b.
b. 、
、 c.
c. 、
、 d.H2SO3、
d.H2SO3、
②已知NaHSO3溶液显酸性,溶液中各离子浓度从大到小的排列顺序是
(4)0.1mol·L-1的NaHA溶液,测得溶液显碱性。则该溶液中c(H2A)
您最近一年使用:0次
名校
解题方法
7 . 某些难溶性铅盐可用作涂料,如秦俑彩绘中使用的铅白(PbCO3)和黄金雨中黄色的PbI2。室温下,PbCO3和 PbI2在不同的溶液中分别达到溶解平衡时-lgc(Pb2+)与-lgc(CO32-)或-lgc(I-)的关系如图所示。下列说法错误的是


| A.Ksp(PbCO3)的数量级为 10-14 |
| B.相同条件下,水的电离程度 p 点大于 q 点 |
| C.L1对应的是-lgc(Pb2+)与-lgc(I-)的关系变化 |
| D.p 点溶液中加入 Na2CO3浓溶液,可得白色沉淀 |
您最近一年使用:0次
2020-05-22更新
|
991次组卷
|
9卷引用:专题10 水溶液中的离子平衡-2020年高考真题和模拟题化学分项汇编
(已下线)专题10 水溶液中的离子平衡-2020年高考真题和模拟题化学分项汇编广东省茂名市2020届高三二模化学试题广东省汕头市金山中学2019-2020学年高二6月月考化学试题广东省广州市广大附中、广外2020-2021学年高二上学期期中考试化学试题河南省鹤壁高中2020-2021学年高二下学期第一次段考化学试题(已下线)学科网2020年高三11月大联考考后强化卷(新课标Ⅲ卷)(已下线)2021年秋季高三化学开学摸底考试卷02(山东专用)甘肃省天水市第一中学2021-2022学年高二下学期开学检测化学试题四川省内江市第三中学2021-2022学年高二下学期期中考试化学试题
2020高三·全国·专题练习
名校
解题方法
8 . 常温下,向20mL的某稀H2SO4溶液中滴入0.1mol·L-1氨水,溶液中水电离出的H+浓度随滴入氨水体积变化如图。下列分析正确的是( )


| A.稀硫酸的浓度为0.1mol·L-1 |
| B.C点溶液呈中性 |
| C.E点溶液中存在:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
| D.B点到D点、D点到F点所加氨水体积一定相等 |
您最近一年使用:0次
名校
解题方法
9 . 硫酸锌是制造锌钡白和锌盐的主要原料,也可用作印染媒染剂,医药上用于催吐剂。已知25℃时,Ksp[Zn(OH)2]= 1.0 ×10-1 7 ,Ksp[Ag2SO4]=1.2×10-5,则下列说法正确的是
| A.在水中加入少量ZnSO4固体时,水的电离平衡向正反应方向移动,Kw减小 |
| B.在 ZnSO4 溶液中各离子的浓度关系为: c(Zn2 + )+c(H+ )=c(OH-)+c(SO42-) |
| C.在 0.5L 0.10mol•L-1的 ZnSO4 溶液中加入等体积的0.02 mol⋅L−1的AgNO3溶液,即可生成Ag2SO4沉淀 |
| D.常温下,要除去0.20mol•L-1,ZnSO4 溶液中的Zn2+,至少要调节pH ≥8 |
您最近一年使用:0次
2020-04-02更新
|
384次组卷
|
12卷引用:2019年11月13日 《每日一题》人教版(选修4)——溶度积的有关计算
(已下线)2019年11月13日 《每日一题》人教版(选修4)——溶度积的有关计算2016届广东省松山湖学校、东莞一中高三上12月联考理综化学试卷【全国百强校】河北省武邑中学2019届高三上学期第三次调研考试化学试题【全国百强校】福建省厦门双十中学2018-2019学年高二下学期第二次月考化学试题内蒙古巴彦淖尔市乌拉特前旗第一中学2019-2020学年高三上学期第一次月考理综化学试题甘肃省张掖市临泽县第一中学2019-2020学年高二11月月考化学试题(已下线)【南昌新东方】莲塘一中2020届高二11月质量检测鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3节综合训练高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节综合训练鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 过素养 学科素养拓展训练山东省泰安市新泰中学2020-2021学年高二上学期第二次阶段性考试化学试题山东省新泰市第一中学老校区(新泰中学)2023-2024学年高二上学期第二次月考化学试题
2019高三下·全国·专题练习
名校
解题方法
10 . 电解质溶液的电导率越大,导电能力越强。用0.100mol•L﹣1的NaOH溶液滴定体积均为10.00mL、浓度均为0.100mol•L﹣1 的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是( )
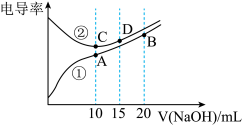

| A.曲线①代表滴定CH3COOH溶液的曲线 |
| B.A点溶液中:c(CH3COO﹣)+c(OH﹣)﹣c(H+)=0.05mol•L﹣1 |
| C.在相同温度下,A、B、C三点溶液中水的电离程度: B<A=C |
| D.D点溶液中:c(Cl﹣)=2c(OH﹣)﹣2c(H+) |
您最近一年使用:0次
2020-03-19更新
|
159次组卷
|
5卷引用:2019年3月3日《每日一题》二轮复习- 每周一测
(已下线)2019年3月3日《每日一题》二轮复习- 每周一测山东省济南外国语学校三箭分校2020届高三上学期期中检测化学试题山西省太原市山西省实验中学2019-2020学年高二上学期12月月考化学试题四川省遂宁市射洪县射洪中学校2019-2020学年高二下学期第一次学月考试化学试题(已下线)2021年1月浙江省普通高校招生选考科目考试化学仿真模拟试卷03



