名校
解题方法
1 . 25℃时,用0.1 mol∙L−1的KOH溶液滴定10mL等浓度的一元弱酸HX溶液过程中,溶液中的lg  随滴入KOH溶液体积的变化关系如图所示。下列说法正确的是
随滴入KOH溶液体积的变化关系如图所示。下列说法正确的是

 随滴入KOH溶液体积的变化关系如图所示。下列说法正确的是
随滴入KOH溶液体积的变化关系如图所示。下列说法正确的是
| A.一元弱酸HX的电离常数约为10−5 |
| B.若b点为15mL,此溶液中存在:3c(K+)=2 c(X-)+2 c(HX) |
| C.从a点到c点过程中水的电离程度先减小后增大 |
| D.a点溶液中存在:c(K+)> c(X-)> c(H+)= c(OH-) |
您最近一年使用:0次
2022-02-20更新
|
266次组卷
|
3卷引用:2023年湖南卷高考真题变式题(选择题11-14)
(已下线)2023年湖南卷高考真题变式题(选择题11-14)四川省内江市第六中学2021-2022学年高三上学期第四次月考化学试题 湖南省株洲市第八中学2022-2023学年高三上学期第三次月考化学试题
2022高三·全国·专题练习
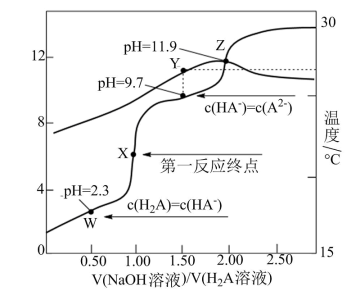
2 . 6.0mL0.10 mol·L-1H2A溶液,溶液pH和温度随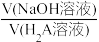 的变化曲线如图所示。下列说法
的变化曲线如图所示。下列说法不正确 的是
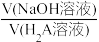 的变化曲线如图所示。下列说法
的变化曲线如图所示。下列说法
| A.从W至Z点,水的电离程度和KW逐渐增大 |
B.当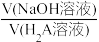 =1时c(Na+)=c(H2A)+c(HA—)+c(A2-) =1时c(Na+)=c(H2A)+c(HA—)+c(A2-) |
| C.27℃,H2A的电离常数Ka2=10-9.7 |
| D.可用酚酞作为第二反应终点的指示剂 |
您最近一年使用:0次
3 . 电解质溶液电导率越大导电能力越强。根据溶液电导率变化可以确定滴定反应的终点。常温下用0.100mol·L-1盐酸分别滴定10.00mL浓度均为0.100mol·L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温Kb[(CH3)2NH]=1.6×10-4。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是
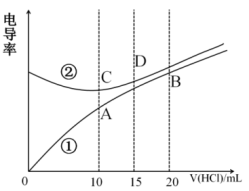

| A.曲线②代表滴定氢氧化钠溶液的曲线 |
| B.滴定二甲胺的过程应该选择甲基橙作为指示剂 |
C.B点溶液中:c(H+)<c(OH-)+c[(CH3)2NH ]+2c[(CH3)2NH] ]+2c[(CH3)2NH] |
| D.A、B、C、D四点的溶液中,水的电离程度最大的是A |
您最近一年使用:0次
解题方法
4 . 常温下,往20mL0.1mol·L-1CH3COOH溶液中滴加等浓度的NaOH溶液,由水电离出的氢氧根离子浓度随滴入NaOH溶液的体积变化如下图所示,下列说法正确的是
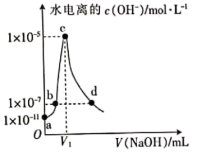

| A.该CH3COOH溶液的电离度为10% | B.c点对应溶液的pH为9 |
| C.V1>20 | D.b、d两点溶液的pH相等 |
您最近一年使用:0次
2021-07-13更新
|
490次组卷
|
2卷引用:疑难压轴1 电解质溶液中“四大常数”的相关计算
名校
解题方法
5 . 25℃,向20mL0.1mol•L-1的弱碱BOH溶液(Kb=1.0×10-5)中逐滴加入0.1mol•L-1盐酸,pH~V曲线如图所示,下列说法正确的是


| A.a点到b点,水的电离程度先减小后增大 |
| B.a点时,c(Cl-)+c(OH-)=c(H+)+c(BOH) |
| C.b点时,c(Cl-)=c(BOH)+c(B+)+c(H+) |
| D.V=20mL时,c(Cl-)>c(B+)>c(OH-)>c(H+) |
您最近一年使用:0次
2021-06-30更新
|
536次组卷
|
4卷引用:考点28 盐类的水解-备战2023年高考化学一轮复习考点帮(全国通用)
(已下线)考点28 盐类的水解-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第32练 盐类的水解-2023年高考化学一轮复习小题多维练(全国通用)安徽省淮北市2021届高三第一次模拟考试化学试题湖南省常德市汉寿县第一中学2023-2024学年高三下学期3月月考化学试题
6 . 室温下,向20.00mL 0.10mol·L﹣1 HX溶液中逐滴滴加0.10mol·L﹣1 NaOH溶液,溶液pH随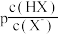 变化关系如图所示,已知
变化关系如图所示,已知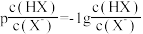 。下列说法错误的是
。下列说法错误的是
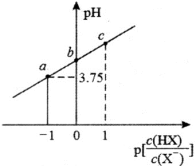
A.HX的电离常数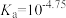 |
B.当 时,加入NaOH溶液的体积小于10.00mL 时,加入NaOH溶液的体积小于10.00mL |
C.当加入10.00mL NaOH溶液时: |
| D.如图所示各点对应溶液中水的电离程度:a>c |
您最近一年使用:0次
名校
解题方法
7 . 下列各组离子能在指定溶液中,大量共存的是
①无色溶液中:K+、Cl−、Na+、H2PO 、PO
、PO 、SO
、SO
②使pH=11的溶液中:CO 、Na+、AlO
、Na+、AlO 、NO
、NO 、S2−、SO
、S2−、SO
③水电离的H+浓度c(H+)=10−12mol·L−1的溶液中:Cl−、HCO 、NO
、NO 、NH
、NH 、S2O
、S2O
④加入Mg能放出H2的溶液中:Mg2+、NH 、Cl−、K+、SO
、Cl−、K+、SO
⑤使甲基橙变红的溶液中:Fe3+、MnO 、NO
、NO 、Na+、SO
、Na+、SO
⑥酸性溶液中:Fe2+、Al3+、NO 、I−、Cl−、S2−
、I−、Cl−、S2−
①无色溶液中:K+、Cl−、Na+、H2PO
 、PO
、PO 、SO
、SO
②使pH=11的溶液中:CO
 、Na+、AlO
、Na+、AlO 、NO
、NO 、S2−、SO
、S2−、SO
③水电离的H+浓度c(H+)=10−12mol·L−1的溶液中:Cl−、HCO
 、NO
、NO 、NH
、NH 、S2O
、S2O
④加入Mg能放出H2的溶液中:Mg2+、NH
 、Cl−、K+、SO
、Cl−、K+、SO
⑤使甲基橙变红的溶液中:Fe3+、MnO
 、NO
、NO 、Na+、SO
、Na+、SO
⑥酸性溶液中:Fe2+、Al3+、NO
 、I−、Cl−、S2−
、I−、Cl−、S2−| A.①②⑤ | B.①③⑥ | C.②④⑤ | D.①②④ |
您最近一年使用:0次
2021-05-01更新
|
1510次组卷
|
4卷引用:2019年秋高三化学复习强化练习—— 离子反应(提升练)
解题方法
8 . 在某温度时,将1.0mol・L-1氨水滴入10 mL1.0mol・L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示:
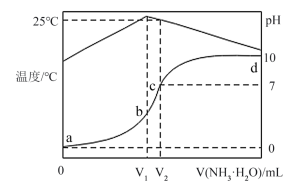
(1)a、b、c、d对应的溶液中水的电离程度由大到小的是_____ 。
(2)氨水体积滴至____ 时(填“V1”或“V2”),氨水与盐酸恰好完全反应,简述判断依据____ ;此时溶液中离子浓度由大到小的顺序是____ 。

(1)a、b、c、d对应的溶液中水的电离程度由大到小的是
(2)氨水体积滴至
您最近一年使用:0次
9 . 向XmL0.1mol L-1氨水中滴加等浓度的稀高氯酸,测得混合溶液的温度和Poh[Poh=-lgc(OH-)]随着加入稀高氯酸的体积变化如图所示(图中实线为温度变化,虚线为pOH变化)。下列说法正确的是
L-1氨水中滴加等浓度的稀高氯酸,测得混合溶液的温度和Poh[Poh=-lgc(OH-)]随着加入稀高氯酸的体积变化如图所示(图中实线为温度变化,虚线为pOH变化)。下列说法正确的是

 L-1氨水中滴加等浓度的稀高氯酸,测得混合溶液的温度和Poh[Poh=-lgc(OH-)]随着加入稀高氯酸的体积变化如图所示(图中实线为温度变化,虚线为pOH变化)。下列说法正确的是
L-1氨水中滴加等浓度的稀高氯酸,测得混合溶液的温度和Poh[Poh=-lgc(OH-)]随着加入稀高氯酸的体积变化如图所示(图中实线为温度变化,虚线为pOH变化)。下列说法正确的是
| A.x=40 |
| B.b、c点由水电离出的c(OH-)大小为b>c |
C.b点时溶液中微粒浓度存在关系:C(NH )+c(NH3.H2O)=C(H+)+c(ClO )+c(NH3.H2O)=C(H+)+c(ClO ) ) |
| D.a、d点对应氨水的电离常数:K(d)<K(a) |
您最近一年使用:0次
10 . 某温度下,向10 mL 0.1 mol·L-1 CuCl2溶液中滴入0.1 mol·L-1的Na2S溶液,溶液中-lgc(Cu2+)随滴入的Na2S溶液体积的变化如图所示。下列叙述不正确的是
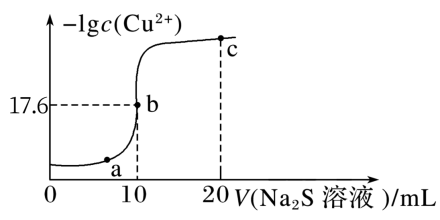

| A.Ksp(CuS)的数量级为10-36 |
| B.c点对应溶液中:c(S2-)+c(Cl-)=c(Na+) |
| C.a、b、c三点对应溶液中,b点水的电离程度最小 |
| D.Na2S溶液中:2c(S2-)+c(HS-)+c(OH-)=c(Na+)+c(H+) |
您最近一年使用:0次



