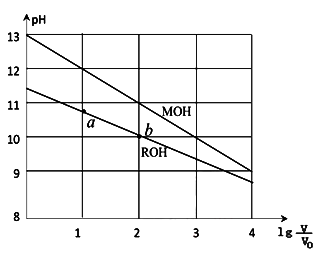
1 . 浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随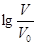 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )
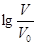 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )
| A.MOH的碱性强于ROH的碱性 |
| B.ROH的电离程度:b点大于a点 |
| C.若两溶液无限稀释,则它们的c(OH-)相等 |
D.当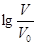 =2时,若两溶液同时升高温度,则 =2时,若两溶液同时升高温度,则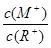 增大 增大 |
您最近一年使用:0次
2016-12-09更新
|
9270次组卷
|
62卷引用:重庆市万州第三中学2020-2021学年高二上学期期中考试化学试题
重庆市万州第三中学2020-2021学年高二上学期期中考试化学试题2015-2016学年江西省余江一中高二上期中考试化学试卷2016-2017学年河北省冀州中学高二上期中化学卷江西省临川第二中学2017-2018学年高二上学期期中考试化学试题山西省康杰中学2017-2018学年高二上学期期中考试化学试题【全国百强校】湖北省武汉市华中师范大学第一附属中学2018-2019学年高二上学期期中检测化学试题云南省腾冲市第八中学2018-2019学年高二下学期期中考试化学试题黑龙江省牡丹江市第三高级中学2019-2020学年高二上学期期中考试化学(理)试题四川省遂宁市船山区第二中学校2019-2020学年高二下学期期中考试化学试题青海省湟川中学2019-2020学年高二上学期期中考试化学试题广东省惠州市第一中学2021-2022学年高二上学期期中考试化学试题2015年全国普通高等学校招生统一考试化学(新课标I卷)河北省衡水中学2015-2016学年高二上一调考试化学试卷2015-2016学年河北正定中学高二上学期第一次联考化学试卷2015-2016学年河北省衡水中学高二上学期调考化学试卷2015-2016学年湖北省荆州中学高二上第二次月考化学试卷陕西省西安市第一中学2015-2016学年高二上12月月考化学试卷2015-2016学年湖南师大附属中学高二上二次阶段测化学卷2015-2016学年湖南省浏阳一中高二上第三次月考化学试卷2015-2016学年山西省忻州一中高二上学期期末理化学试卷2016届甘肃省武威二中高三下学期开学考试理综化学试卷2016-2017学年湖南省长沙一中高二上第一次月考化学卷2016-2017学年安徽省淮北市第一中学高二下学期第一次月考化学试卷山西省康杰中学2016-2017学年高二下学期期末考试化学试题2018版化学(苏教版)高考总复习专题八对接高考精练--弱电解质的电离平衡内蒙古赤峰市宁城县2018届高三10月月考化学试题湖北省沙市中学2017-2018学年高二上学期第三次双周考试化学试题(已下线)解密11 弱电解质的电离和溶液的酸碱性——备战2018年高考化学之高频考点解密2018-2019学年鲁科版高中化学选修四:模块综合检测题(一)河北省沧州市盐山中学2018-2019学年高二上学期12月月考化学试题【全国百强校】黑龙江省双鸭山市第一中学2018-2019学年高二上学期期末考试化学试题山东省菏泽市第一中学老校区2018-2019学年高二上学期期末模拟化学试题(已下线)2019年3月2日《每日一题》二轮复习- 周末培优【全国百强校】江苏省扬州中学2018-2019学年高二下学期4月月考化学试题河北省承德第一中学2019-2020学年高二上学期期中考试化学试题(已下线)专题8.1 弱电解质的电离平衡(练)-《2020年高考一轮复习讲练测》辽宁省丹东市凤城市第一中学2019-2020学年高二上学期12月月考化学试题湖北省武汉市武昌区武汉中学2019-2020学年高二上学期化学(人教版选修4)期末复习试题:专题1 弱电解质的电离复习题云南省楚雄永仁一中2020届高三3月线上模拟理综化学试题(已下线)专题十二 水溶液中的离子平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训江西省赣州市赣州县第三中学2019-2020学年高二下学期入学考试化学试题鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第2节 弱电解质的电离盐类的水解人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第二节 水的电离和溶液的pH 高考帮黑龙江省鹤岗市第一中学2020-2021学年高二10月月考化学试题(已下线)易错18 电解质溶液图像-备战2021年高考化学一轮复习易错题鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 第2节 弱电解质的电离 盐类的水解 课时1 弱电解质的电离平衡新疆北屯高级中学2020-2021学年高二上学期10月月考化学试题河南省郑州市第一〇六高级中学2020-2021学年高二上学期11月考试化学试题河北省石家庄市藁城区第一中学2019-2020学年高二上学期第二次月考化学试题安徽省蚌埠市2020-2021学年高二上学期期末统考化学试题江西省赣州市赣县第三中学2020-2021学年高二下学期2月入学考试化学试题(已下线)3.1 电离平衡-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)广东省惠州市第一中学2021-2022学年高二上学期第二次考试化学试题河南省南阳市第一中学校2021-2022学年高二上学期第三次月考化学试题黑龙江省七台河市勃利县高级中学2021-2022学年高二上学期9月月考化学试题河南省信阳高级中学2021-2022学年高二下学期4月月考化学试题第三章 本章复习提升3(已下线)专题八 水溶液中的离子反应与平衡 能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)海南省琼海市嘉积第二中学2021-2022学年高二下学期教学质量监测(段考)化学科试题 广西钟山县钟山中学2021-2022学年高二上学期第三次(12月)月考化学(理科)试题(已下线)专题21 电解质溶液图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)四川省凉山州宁南中学2022-2023学年高二上学期期末考试化学试题
名校
2 . 25℃时,部分物质的电离常数如表所示:
请回答下列问题:
(1)a.CH3COOH,b.H2CO3,c.HClO的酸性由强到弱的顺序为____________ (填编号).
(2)已知水存在如下平衡:H2O+H2O H
H O+OH-
O+OH-  >0,现欲使平衡向右移动,且所得溶液显碱性,选择方法是
>0,现欲使平衡向右移动,且所得溶液显碱性,选择方法是__________ 。
A.向水中加入NaHSO4固体 B.向水中加入NaOH固体
C.加热至100℃ D.向水中加入Na
(3)向NaClO溶液中通入少量的CO2,反应的离子方程式为_________________ .
(4)pH相同等体积的下列三种物质的溶液:a.HCl,b.H2SO4,c.CH3COOH滴加等浓度的NaOH溶液将它们恰好中和,用去NaOH溶液的体积分别为V1、V2、V3则三者的大小关系( )
A.V3>V2>V1 B.V3=V2=V1 C.V3>V2=V1 D.V1=V2>V3
(5)常温下0.1mol·L﹣1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________ (填序号).
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH﹣) D. c(H+)·c(CH3COO﹣)/c(CH3COOH)
(6)25℃时,将pH均为2的HCl与HX的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示.

则稀释前c(HX)_____ 0.01 mol/L(填“>”、“=”、“ < ”);a、b两点:c(X﹣)____ c(Cl﹣)(填“>”、“=”、“ < ”);溶液的导电性:a____ b(填“>”、“=”、“ < ”)
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离常数 | 1.7×10﹣5 | K1=4.3×10﹣7 K2=5.6×10﹣11 | 3.0×10﹣8 |
(1)a.CH3COOH,b.H2CO3,c.HClO的酸性由强到弱的顺序为
(2)已知水存在如下平衡:H2O+H2O
 H
H O+OH-
O+OH-  >0,现欲使平衡向右移动,且所得溶液显碱性,选择方法是
>0,现欲使平衡向右移动,且所得溶液显碱性,选择方法是A.向水中加入NaHSO4固体 B.向水中加入NaOH固体
C.加热至100℃ D.向水中加入Na
(3)向NaClO溶液中通入少量的CO2,反应的离子方程式为
(4)pH相同等体积的下列三种物质的溶液:a.HCl,b.H2SO4,c.CH3COOH滴加等浓度的NaOH溶液将它们恰好中和,用去NaOH溶液的体积分别为V1、V2、V3则三者的大小关系
A.V3>V2>V1 B.V3=V2=V1 C.V3>V2=V1 D.V1=V2>V3
(5)常温下0.1mol·L﹣1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH﹣) D. c(H+)·c(CH3COO﹣)/c(CH3COOH)
(6)25℃时,将pH均为2的HCl与HX的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示.

则稀释前c(HX)
您最近一年使用:0次
2020-11-04更新
|
710次组卷
|
2卷引用:重庆市合川实验中学2020-2021学年高二上学期期中考试化学试题
名校
3 . 室温下,pH均为2的两种一元酸HA和HB各 ,分别加水稀释,pH随溶液体积的变化曲线如下图所示。下列说法正确的是
,分别加水稀释,pH随溶液体积的变化曲线如下图所示。下列说法正确的是
 ,分别加水稀释,pH随溶液体积的变化曲线如下图所示。下列说法正确的是
,分别加水稀释,pH随溶液体积的变化曲线如下图所示。下列说法正确的是
| A.HA的酸性比HB的酸性弱 |
| B.a点溶液的导电性比c点溶液的导电性强 |
| C.溶液中水的电离程度a>c |
D.对a、b两点溶液同时升高温度,则 增大 增大 |
您最近一年使用:0次
2021-01-05更新
|
338次组卷
|
2卷引用:重庆市凤鸣山中学2021-2022学年高二上学期期中(半期)考试化学试题
名校
解题方法
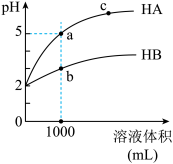
4 . pH均为4的稀硫酸和硫酸铝溶液加水稀释时的pH变化曲线如图,下列说法正确的是


| A.Y曲线代表稀硫酸 |
B.a点和b点溶液中 : : |
C.b、c两点的溶液中水电离出的 相等 相等 |
| D.a、c点对应的两溶液中,稀硫酸中c水(H+)与硫酸铝溶液中c水(H+)的比值比稀释前的比值大 |
您最近一年使用:0次
名校
5 . 已知常温时HClO的Ka=3.0×10-8,HF的Ka=3.5×10-4。现将pH和体积都相同的次氯酸和氢氟酸溶液分别加蒸馏水稀释,pH随溶液体积的变化如图所示。下列叙述正确的是( )
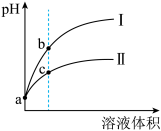

| A.曲线I为次氯酸稀释时pH变化曲线 |
| B.b点溶液中水的电离程度比c点溶液中水的电离程度小 |
| C.a点时,若都加入相同大小的锌粒,此时与氢氟酸反应的速率大 |
| D.取a点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗次氯酸的体积较小 |
您最近一年使用:0次
2020-06-12更新
|
367次组卷
|
15卷引用:重庆市凤鸣山中学2018-2019学年高二上学期期中考试化学试题
重庆市凤鸣山中学2018-2019学年高二上学期期中考试化学试题甘肃省兰州第一中学2018-2019学年高二(理)上学期期中考试化学试题四川省成都外国语学校2020-2021学年高二上学期期中考试化学试题重庆市重庆实验外国语学校2021-2022学年高二上学期10月月考化学试题黑龙江省哈尔滨市第三中学校2023-2024学年高二上学期期中考试化学试题【全国市级联考】贵州省安顺市2018届高三适应性监测考试(三)理综化学试题(已下线)《2018-2019学年同步单元双基双测AB卷》第三单元 水溶液中的离子平衡单元测试B卷【全国百强校】河南省信阳市高级中学2018-2019学年高二上学期10月月考化学试题1江西省南昌市八一中学2018-2019学年高二上学期12月月考化学试题【校级联考】江西省赣州教育发展联盟2018-2019学年高二上学期12月联考化学试题【校级联考】天津市七校(静海一中、宝坻一中、杨村一中等)2019届高三上学期期末考试化学试题宁夏回族自治区宁夏大学附属中学2019届高三下学期第一次模拟考试理科综合化学试题广东省佛山市实验中学2020届高三上学期第一次适应性考试理综化学试题江西省宜春市昌黎实验学校2021-2022学年高二上学期12月月考化学试题云南省玉溪第一中学2022-2023学年高二上学期第一次月考化学试题
名校
6 . 某温度下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如图所示,下列判断错误的是( )
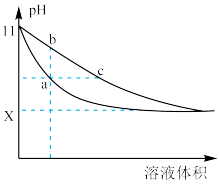

| A.a.c两点溶液的导电能力相同 |
| B.曲线bc表示氨水的稀释过程 |
| C.与同种盐酸完全反应时,上述两种碱消耗盐酸较多的是氢氧化钠 |
D.从b点到c点的过程中溶液中的n(NH )+n(NH3•H2O)保持不变 )+n(NH3•H2O)保持不变 |
您最近一年使用:0次
2020-11-04更新
|
335次组卷
|
2卷引用:重庆市万州区万州第二高级中学2020-2021学年高二上学期期中考试化学试题
名校
解题方法
7 . pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1000 mL,其中pH与溶液体积V的关系如图所示。下列说法正确的是


| A.A、B两酸溶液的物质的量浓度一定相等 |
| B.稀释后,A酸溶液的酸性比B酸溶液强 |
| C.a=5时,A是强酸,B是弱酸 |
| D.若a小于5,则A、B都是弱酸,且A的酸性弱于B |
您最近一年使用:0次
2018-12-12更新
|
544次组卷
|
6卷引用:重庆市第七中学2018-2019学年高二上学期期中考试化学试题
名校
8 . pH=2的X、Y、Z三种酸的溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的变化关系如图所示,下列说法中正确的是


| A.X是强酸,Y和Z是弱酸 |
| B.稀释前的浓度大小为c(Y)>c(Z)>c(X) |
| C.稀释前电离程度大小为X>Z>Y |
| D.pH=2时,X、Y、Z都是稀溶液 |
您最近一年使用:0次
2019-11-05更新
|
364次组卷
|
2卷引用:重庆市璧山来凤中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
9 . 常温下,取0.1mol/L的NaA和NaB两种盐溶液各1L,分别通入0.02molCO2,发生如下反应:NaA+CO2+H2O=HA+NaHCO3、2NaB+CO2+H2O=2HB+Na2CO3。在1LHA和HB的溶液分别加水稀释至体积为VL时可能有如图曲线,则下列说法正确的是( )


| A.X是HA,Y是HB |
| B.常温下pH:NaA溶液>NaB溶液 |
| C.若常温下,浓度均为0.1mol/L的NaA和HA的混合溶液pH>7,则c(A-)>c(HA) |
| D.在等浓度的NaA和NaB混合溶液中通入HCl至中性时,c(Cl-)=c(HA)+c(HB) |
您最近一年使用:0次
名校
10 . 下列图示与对应的叙述相符的是






甲 乙 丙
| A.图甲中纯水仅升高温度,就可以从a点变到c点 |
| B.图甲中在b点对应温度下,将pH=2的H2SO4溶液与pH=10的NaOH溶液等体积混合后,溶液显中性 |
| C.图乙表相同温度下pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 |
| D.用0.0100mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/L,C1-、Br-及I-的混合溶液,由图丙曲线,可确定首先沉淀的是Cl- |
您最近一年使用:0次
2017-12-25更新
|
246次组卷
|
3卷引用:重庆市第一中学2017-2018学年高二上学期期中考试化学试题



