解题方法
1 . 常温下,分别在 溶液中滴加
溶液中滴加 溶液,溶液
溶液,溶液 代表
代表 ]与
]与 关系如图所示。已知:
关系如图所示。已知: 。
。
 溶液中滴加
溶液中滴加 溶液,溶液
溶液,溶液 代表
代表 ]与
]与 关系如图所示。已知:
关系如图所示。已知: 。
。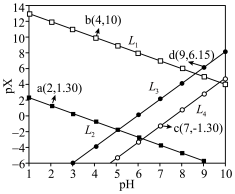
A.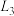 代表 代表 代表 代表 |
B. 的数量级为 的数量级为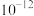 |
C.若在同溶液中产生这两种沉淀时, |
D. 的平衡常数 的平衡常数 |
您最近一年使用:0次
2 . 用0.1 NaOH标准溶液滴定20mL等浓度的三元酸
NaOH标准溶液滴定20mL等浓度的三元酸 ,得到pH与
,得到pH与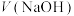 、
、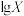 [
[ 或
或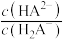 或
或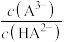 ]的关系分别如图1、图2所示。
]的关系分别如图1、图2所示。
 NaOH标准溶液滴定20mL等浓度的三元酸
NaOH标准溶液滴定20mL等浓度的三元酸 ,得到pH与
,得到pH与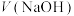 、
、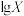 [
[ 或
或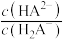 或
或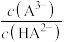 ]的关系分别如图1、图2所示。
]的关系分别如图1、图2所示。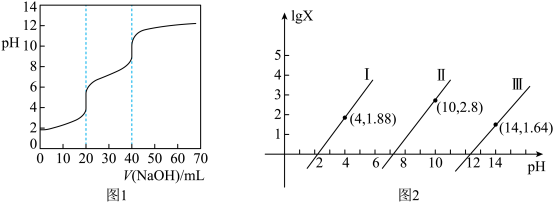
A.当加入20mL NaOH溶液时,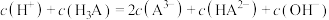 |
B.当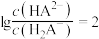 时,水电离出的 时,水电离出的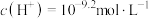 |
C.当加入40mL NaOH溶液时, |
D.当pH=11时,溶液中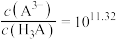 |
您最近一年使用:0次
2024-05-25更新
|
390次组卷
|
3卷引用:山东省潍坊市2024届高三下学期二模化学试题
3 . 常温下,0.10 mol/L HCOONH4溶液中部分微粒( 、
、 、HCOOH、
、HCOOH、 )的
)的 (可通入加入NaOH或HCl调节溶液pH)关系如图所示。
(可通入加入NaOH或HCl调节溶液pH)关系如图所示。 ,
,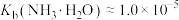 。下列说法正确的是
。下列说法正确的是


 、
、 、HCOOH、
、HCOOH、 )的
)的 (可通入加入NaOH或HCl调节溶液pH)关系如图所示。
(可通入加入NaOH或HCl调节溶液pH)关系如图所示。 ,
,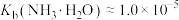 。下列说法正确的是
。下列说法正确的是

A.曲线②和③分别表示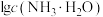 和 和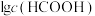 随pH的变化 随pH的变化 |
| B.溶液中M点对应的pH=7 |
C.HCOONH4的水解平衡常数 约为 约为 |
D.原溶液中 |
您最近一年使用:0次
2024-02-25更新
|
146次组卷
|
2卷引用:湖北省新高考协作体2023-2024学年高三下学期2月收心考试化学试题
名校
解题方法
4 . 硫及其化合物的转化是资源利用和环境保护的重要研究课题,回答下列问题:
Ⅰ.若在绝热、恒容的密闭容器中通入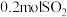 和
和 ,发生反应
,发生反应
 ,一段时间内,正反应速率随时间的变化曲线如图所示。
,一段时间内,正反应速率随时间的变化曲线如图所示。
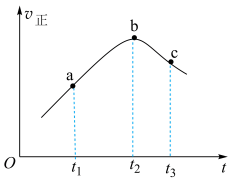
(1)混合气体的密度:a___________ (填“>”、“<”或“=”,下同)c,混合气体的平均摩尔质量:a___________ c。
(2)b点时,
___________ (用分式表示)。
(3)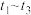 内,
内, 先增大后减小的主要原因为
先增大后减小的主要原因为___________ 。
Ⅱ.常温下,氢硫酸( 的水溶液)的电离方程式可表示为
的水溶液)的电离方程式可表示为 和
和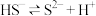 。现将氢硫酸与氢氧化钠溶液混合。已知:
。现将氢硫酸与氢氧化钠溶液混合。已知: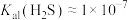 ,
, 。
。
(4)对于反应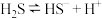 ,该反应的平衡常数表达式为
,该反应的平衡常数表达式为___________ 。
(5)若将等体积、等浓度的氢硫酸与氢氧化钠溶液混合,发生反应的化学方程式:___________ 。
(6)常温下,当混合后溶液中的 时,该溶液的pH约为
时,该溶液的pH约为___________ [已知: ,
, ]。
]。
Ⅰ.若在绝热、恒容的密闭容器中通入
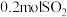 和
和 ,发生反应
,发生反应
 ,一段时间内,正反应速率随时间的变化曲线如图所示。
,一段时间内,正反应速率随时间的变化曲线如图所示。
(1)混合气体的密度:a
(2)b点时,

(3)
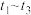 内,
内, 先增大后减小的主要原因为
先增大后减小的主要原因为Ⅱ.常温下,氢硫酸(
 的水溶液)的电离方程式可表示为
的水溶液)的电离方程式可表示为 和
和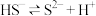 。现将氢硫酸与氢氧化钠溶液混合。已知:
。现将氢硫酸与氢氧化钠溶液混合。已知: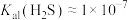 ,
, 。
。(4)对于反应
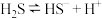 ,该反应的平衡常数表达式为
,该反应的平衡常数表达式为(5)若将等体积、等浓度的氢硫酸与氢氧化钠溶液混合,发生反应的化学方程式:
(6)常温下,当混合后溶液中的
 时,该溶液的pH约为
时,该溶液的pH约为 ,
, ]。
]。
您最近一年使用:0次
5 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液含( 、
、 、
、 、
、 、
、 和
和 )。实现镍、钴、镁元素的回收。
)。实现镍、钴、镁元素的回收。
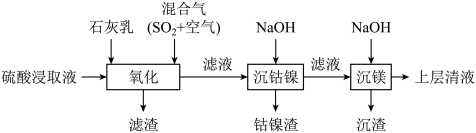
已知:
回答下列问题:
(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为___________ (答出一条即可)。
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸( ),
), 中S的化合价为+6,其中过氧键的数目为
中S的化合价为+6,其中过氧键的数目为___________ 。
(3)“氧化”中,用石灰乳调节pH=4, 被
被 氧化为
氧化为 ,该反应的化学方程式为
,该反应的化学方程式为___________ ;滤渣的成分为 、
、
___________ (填化学式)。
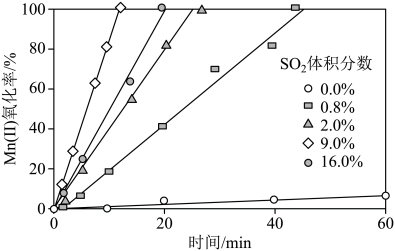
(4)“氧化”中保持空气通入速率不变,Mn(Ⅱ)氧化率与时间的关系如下。 体积分数为
体积分数为___________ 时,Mn(Ⅱ)氧化速率最大;继续增大 体积分数时,Mn(Ⅱ)氧化速率减小的原因是
体积分数时,Mn(Ⅱ)氧化速率减小的原因是___________ 。
(5)“沉钴镍”中得到的Co(Ⅱ)在空气中可被氧化成棕色的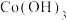 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(6)“沉镁”中为使 沉淀完全(溶液中剩余离子浓度小于
沉淀完全(溶液中剩余离子浓度小于 mol/L),需控制pH不低于
mol/L),需控制pH不低于___________ 。
 、
、 、
、 、
、 、
、 和
和 )。实现镍、钴、镁元素的回收。
)。实现镍、钴、镁元素的回收。
已知:
| 物质 |  |  |  |  |
 |  |  |  | 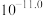 |
(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(
 ),
), 中S的化合价为+6,其中过氧键的数目为
中S的化合价为+6,其中过氧键的数目为(3)“氧化”中,用石灰乳调节pH=4,
 被
被 氧化为
氧化为 ,该反应的化学方程式为
,该反应的化学方程式为 、
、
(4)“氧化”中保持空气通入速率不变,Mn(Ⅱ)氧化率与时间的关系如下。
 体积分数为
体积分数为 体积分数时,Mn(Ⅱ)氧化速率减小的原因是
体积分数时,Mn(Ⅱ)氧化速率减小的原因是
(5)“沉钴镍”中得到的Co(Ⅱ)在空气中可被氧化成棕色的
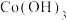 ,该反应的化学方程式为
,该反应的化学方程式为(6)“沉镁”中为使
 沉淀完全(溶液中剩余离子浓度小于
沉淀完全(溶液中剩余离子浓度小于 mol/L),需控制pH不低于
mol/L),需控制pH不低于
您最近一年使用:0次
2023-10-08更新
|
134次组卷
|
2卷引用:山西省运城市2023-2024学年高三上学期开学考试化学试题
6 . 某同学模拟工业废水变废为宝,设计了用沉淀法回收各金属阳离子的实验方案:

已知:
①溶液中某离子浓度小于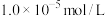 ,可认为该离子不存在;
,可认为该离子不存在;
②实验过程中,假设溶液体积、温度不变;
③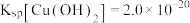 ;
;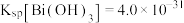 ;
;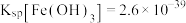 ;
; 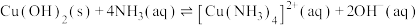

下列说法不正确的是

| 模拟工业废水的离子浓度(mol/l) |  |  |  |  |  |
| 0.10 | 0.010 | 0.0040 | 0.0010 | 0.141 |
①溶液中某离子浓度小于
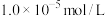 ,可认为该离子不存在;
,可认为该离子不存在;②实验过程中,假设溶液体积、温度不变;
③
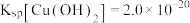 ;
;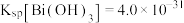 ;
;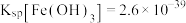 ;
; 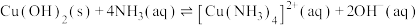

下列说法不正确的是
A.步骤I中加入的 |
B.步骤II得到的滤液N中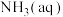 的浓度 的浓度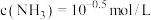 |
C.步骤III得到的沉淀Z为 |
D.反应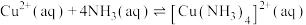 的平衡常数 的平衡常数 |
您最近一年使用:0次
2023-05-31更新
|
460次组卷
|
3卷引用:浙江省重点中学拔尖学生培养联盟2023届高三下学期6月适应性考试化学试题
浙江省重点中学拔尖学生培养联盟2023届高三下学期6月适应性考试化学试题江西省智学联盟体2023-2024学年高三上学期第一次联考化学试题 (已下线)考点4 沉淀溶解平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
7 . 向 的
的 溶液中逐滴滴加等浓度的NaOH溶液,所得溶液中
溶液中逐滴滴加等浓度的NaOH溶液,所得溶液中 、
、 、
、 三种微粒的物质的量分数(
三种微粒的物质的量分数( )与溶液pH的关系如图a所示;向
)与溶液pH的关系如图a所示;向 的草酸钠溶液中逐滴滴加等浓度的
的草酸钠溶液中逐滴滴加等浓度的 溶液,形成的
溶液,形成的 与
与 变化如图b所示。下列有关说法中
变化如图b所示。下列有关说法中错误 的是(已知 )
)

 的
的 溶液中逐滴滴加等浓度的NaOH溶液,所得溶液中
溶液中逐滴滴加等浓度的NaOH溶液,所得溶液中 、
、 、
、 三种微粒的物质的量分数(
三种微粒的物质的量分数( )与溶液pH的关系如图a所示;向
)与溶液pH的关系如图a所示;向 的草酸钠溶液中逐滴滴加等浓度的
的草酸钠溶液中逐滴滴加等浓度的 溶液,形成的
溶液,形成的 与
与 变化如图b所示。下列有关说法中
变化如图b所示。下列有关说法中 )
)
A.图b中当溶液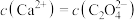 时, 时,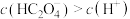 |
B.向 草酸钠溶液中加入等体积 草酸钠溶液中加入等体积 溶液后,溶液中 溶液后,溶液中 为 为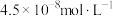 |
C. 的 的 溶液的pH>2.5 溶液的pH>2.5 |
D.向 的 的 溶液中逐滴滴加等浓度的 溶液中逐滴滴加等浓度的 溶液,所得溶液中 溶液,所得溶液中 、 、 、 、 三种微粒的物质的量分数( 三种微粒的物质的量分数( )与溶液pH的关系与图a相同 )与溶液pH的关系与图a相同 |
您最近一年使用:0次
8 . 工业以钒铁精矿(主要成为 ,还含有少量
,还含有少量 、
、 )为主要原料制备
)为主要原料制备 的工艺流程如图所示。
的工艺流程如图所示。
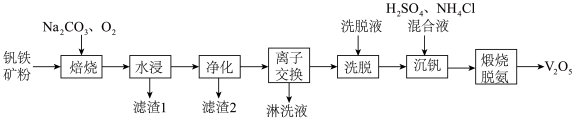
回答下列问题:
(1) 中V的化合价为
中V的化合价为_______ ,V在周期表的位置为_______ 。
(2)“焙烧”的目的是将 转化为可溶性的
转化为可溶性的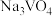 并将Al、Si的氧化物转化为可溶性钠盐,“焙烧”过程中生成
并将Al、Si的氧化物转化为可溶性钠盐,“焙烧”过程中生成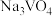 的化学反应方程式为
的化学反应方程式为_______ 。
(3)“滤渣1”的化学式为_______ ,“净化”除去的阴离子有 、
、 和
和_______ 。
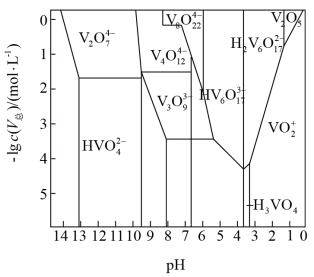
(4)“离子交换”和“洗脱”可以表示为: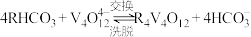 。常温下,各种形态五价钒粒子总浓度的负对数
。常温下,各种形态五价钒粒子总浓度的负对数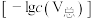 与pH关系如图所示。已知净化液中
与pH关系如图所示。已知净化液中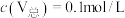 ,则“离子交换”前还应调节pH的范围为
,则“离子交换”前还应调节pH的范围为_______ ,淋洗液中的阳离子主要是_______
(5)“沉钒”过程过滤得到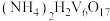 ,则沉钒反应的离子方程式为
,则沉钒反应的离子方程式为_______ 。
 ,还含有少量
,还含有少量 、
、 )为主要原料制备
)为主要原料制备 的工艺流程如图所示。
的工艺流程如图所示。
回答下列问题:
(1)
 中V的化合价为
中V的化合价为(2)“焙烧”的目的是将
 转化为可溶性的
转化为可溶性的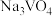 并将Al、Si的氧化物转化为可溶性钠盐,“焙烧”过程中生成
并将Al、Si的氧化物转化为可溶性钠盐,“焙烧”过程中生成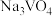 的化学反应方程式为
的化学反应方程式为(3)“滤渣1”的化学式为
 、
、 和
和(4)“离子交换”和“洗脱”可以表示为:
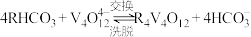 。常温下,各种形态五价钒粒子总浓度的负对数
。常温下,各种形态五价钒粒子总浓度的负对数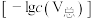 与pH关系如图所示。已知净化液中
与pH关系如图所示。已知净化液中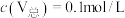 ,则“离子交换”前还应调节pH的范围为
,则“离子交换”前还应调节pH的范围为
(5)“沉钒”过程过滤得到
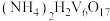 ,则沉钒反应的离子方程式为
,则沉钒反应的离子方程式为
您最近一年使用:0次
2022-05-19更新
|
317次组卷
|
2卷引用:湖北省武汉市武昌区2022届高三5月质量检测化学试题
名校
9 . As2S3可转化为用于治疗白血病的亚砷酸。向一定浓度的亚砷酸溶液中逐滴滴入NaOH溶液,含砷元素微粒的物质的量分数与溶液pH的关系如图所示。下列表述正确的是


A.当pH调至11时,所发生的反应为:H3AsO3+2OH-=HAsO +2H2O +2H2O |
B.P点,pH= |
C.N点: |
D.Q点:c(Na+)>2c(HAsO )+4c(AsO )+4c(AsO ) ) |
您最近一年使用:0次
2022-01-24更新
|
226次组卷
|
2卷引用:山东省青岛市2021-2022学年高三上学期教学质量检测化学试题
10 . 从含铅烟灰(主要化学成分为PbO、Fe2O3、In2O3和In2S3)中分离回收铟和锡的工艺流程如图。
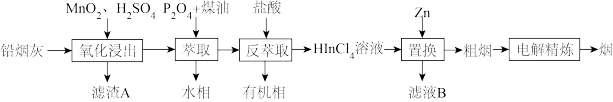
已知:①“萃取”时发生反应:In3++3H2A2(有机液)→In(HA2)3(有机液)+3H+;
Fe3++3H2A2(有机液) →Fe(HA2)3(有机液)+3H+
②“反萃取”时发生反应:In(HA2)3(有机液)+4HCl→3(HA2)3(有机液)+HInCl4。
回答下列问题:
(1)“浸出”过程中硫元素最终均以硫酸根的形式存在于浸出液中,请写出In2S3发生反应的化学方程式____ 。
(2)滤渣A的主要成分除含过量MnO2外,还有___ (填化学式)。
(3)“萃取”过程中的萃取剂可用H2A2表示,使In3+进入有机相,萃取过程发生的化学反应方程式为:In3++3H2A2 In(HA2)3+3H+,平衡常数为K=9.96。“萃取”过程中萃取剂和浸出液的用量比、萃取时间和萃取率(E%)的关系如表所示。“萃取”时萃取率的高低受溶液的pH影响很大,已知pH与萃取率的关系符合如下公式:lg
In(HA2)3+3H+,平衡常数为K=9.96。“萃取”过程中萃取剂和浸出液的用量比、萃取时间和萃取率(E%)的关系如表所示。“萃取”时萃取率的高低受溶液的pH影响很大,已知pH与萃取率的关系符合如下公式:lg =lgK-lg
=lgK-lg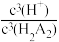 。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=
。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=___ (已知lg19=1.28,忽略萃取剂浓度的变化,结果保留三位有效数字)。
(4)盐酸的浓度与铟、铁的反萃取率的关系如图所示。则“反萃取”过程中应选择盐酸的最佳浓度为____ 。

(5)“置换”后所得浊液,需要经过过滤、洗涤、干燥等操作得到粗铟,在洗涤操作中,检验粗铟已洗涤干净的方法为___ 。
(6)电解精炼铟时阳极材料应选用____ ,随着电解的不断进行,电解液中c(In3+)会逐渐____ (“减小”或“不变”)。

已知:①“萃取”时发生反应:In3++3H2A2(有机液)→In(HA2)3(有机液)+3H+;
Fe3++3H2A2(有机液) →Fe(HA2)3(有机液)+3H+
②“反萃取”时发生反应:In(HA2)3(有机液)+4HCl→3(HA2)3(有机液)+HInCl4。
回答下列问题:
(1)“浸出”过程中硫元素最终均以硫酸根的形式存在于浸出液中,请写出In2S3发生反应的化学方程式
(2)滤渣A的主要成分除含过量MnO2外,还有
(3)“萃取”过程中的萃取剂可用H2A2表示,使In3+进入有机相,萃取过程发生的化学反应方程式为:In3++3H2A2
 In(HA2)3+3H+,平衡常数为K=9.96。“萃取”过程中萃取剂和浸出液的用量比、萃取时间和萃取率(E%)的关系如表所示。“萃取”时萃取率的高低受溶液的pH影响很大,已知pH与萃取率的关系符合如下公式:lg
In(HA2)3+3H+,平衡常数为K=9.96。“萃取”过程中萃取剂和浸出液的用量比、萃取时间和萃取率(E%)的关系如表所示。“萃取”时萃取率的高低受溶液的pH影响很大,已知pH与萃取率的关系符合如下公式:lg =lgK-lg
=lgK-lg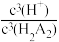 。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=
。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=(4)盐酸的浓度与铟、铁的反萃取率的关系如图所示。则“反萃取”过程中应选择盐酸的最佳浓度为

(5)“置换”后所得浊液,需要经过过滤、洗涤、干燥等操作得到粗铟,在洗涤操作中,检验粗铟已洗涤干净的方法为
(6)电解精炼铟时阳极材料应选用
您最近一年使用:0次



