解题方法
1 . 某研究小组制备配合物顺式一二甘氨酸合铜[(H2NCH2COO)2Cu]并测定所得产品中铜的含量。回答下列问题:
Ⅰ.制备Cu(OH)2
如图所示,向装有CuSO4溶液的三颈烧瓶中滴加氨水,先出现蓝色沉淀,后蓝色沉淀消失,溶液变为深蓝色。再加入过量的NaOH溶液,过滤,洗涤,干燥。_____ 价。
(2)写出少量的氨水和硫酸铜溶液反应的离子方程式:__________________ 。
Ⅱ.制备顺式一二甘氨酸合铜[(H2NCH2COO)2Cu]
将制得的Cu(OH)2固体置于烧杯中,加入甘氨酸,水浴加热至65~70℃,搅拌,充分反应后趁热过滤,往滤液中加入10mL95%的乙醇溶液,冷却结晶,过滤、洗涤、干燥,得产品。
(3)写出Cu(OH)2与甘氨酸反应的化学方程式:___________ 。
(4)下列说法中正确的是________ (填标号)。
a.实验Ⅰ中不用CuSO4溶液直接与NaOH反应的原因可能是防止生成碱式硫酸铜沉淀
b.实验Ⅱ中,趁热过滤的目的是除去Cu(OH)2的同时减少产物的析出
c.加入95%的乙醇溶液能增大顺式一二甘氨酸合铜的溶解度
Ⅲ.产品中Cu元素含量的测定
实验流程如下:
A.用分析天平称量产品xg,配制成100mL样品溶液;
B.用移液管移取20.00mL溶液到碘量瓶中,加入过量KI固体,在暗处静置5分钟,用标准Na2S2O3溶液滴定至溶液呈浅黄色,加入适量NH4SCN溶液,剧烈振荡碘量瓶,加入淀粉溶液,用标准Na2S2O3溶液滴定至终点;再取20.00mL溶液进行一次平行实验。
已知:ⅰ.2Cu2++4I-=2CuI↓+I2,2 +I2=2I-+
+I2=2I-+ ;
;
ⅱ.CuI固体能吸附溶液中的少量碘单质;
ⅲ.Ksp(CuSCN)<Ksp(CuI)。
(5)①配制100mL样品溶液时,需要的玻璃仪器有烧杯、玻璃棒、________ 。
②滴定终点的现象是________ 。
③若两次平行实验,平均消耗0.1050mol·L-1 Na2S2O3溶液20.00mL,则xg产品中含Cu的质量为______ g。
Ⅰ.制备Cu(OH)2
如图所示,向装有CuSO4溶液的三颈烧瓶中滴加氨水,先出现蓝色沉淀,后蓝色沉淀消失,溶液变为深蓝色。再加入过量的NaOH溶液,过滤,洗涤,干燥。

(2)写出少量的氨水和硫酸铜溶液反应的离子方程式:
Ⅱ.制备顺式一二甘氨酸合铜[(H2NCH2COO)2Cu]
将制得的Cu(OH)2固体置于烧杯中,加入甘氨酸,水浴加热至65~70℃,搅拌,充分反应后趁热过滤,往滤液中加入10mL95%的乙醇溶液,冷却结晶,过滤、洗涤、干燥,得产品。
(3)写出Cu(OH)2与甘氨酸反应的化学方程式:
(4)下列说法中正确的是
a.实验Ⅰ中不用CuSO4溶液直接与NaOH反应的原因可能是防止生成碱式硫酸铜沉淀
b.实验Ⅱ中,趁热过滤的目的是除去Cu(OH)2的同时减少产物的析出
c.加入95%的乙醇溶液能增大顺式一二甘氨酸合铜的溶解度
Ⅲ.产品中Cu元素含量的测定
实验流程如下:
A.用分析天平称量产品xg,配制成100mL样品溶液;
B.用移液管移取20.00mL溶液到碘量瓶中,加入过量KI固体,在暗处静置5分钟,用标准Na2S2O3溶液滴定至溶液呈浅黄色,加入适量NH4SCN溶液,剧烈振荡碘量瓶,加入淀粉溶液,用标准Na2S2O3溶液滴定至终点;再取20.00mL溶液进行一次平行实验。
已知:ⅰ.2Cu2++4I-=2CuI↓+I2,2
 +I2=2I-+
+I2=2I-+ ;
;ⅱ.CuI固体能吸附溶液中的少量碘单质;
ⅲ.Ksp(CuSCN)<Ksp(CuI)。
(5)①配制100mL样品溶液时,需要的玻璃仪器有烧杯、玻璃棒、
②滴定终点的现象是
③若两次平行实验,平均消耗0.1050mol·L-1 Na2S2O3溶液20.00mL,则xg产品中含Cu的质量为
您最近一年使用:0次
2024-04-21更新
|
155次组卷
|
2卷引用:2024届青海省海东市高三下学期二模理科综合试卷-高中化学
名校
解题方法
2 . 滴定分析法是一种精度很高的定量分析法。以酚酞为指示剂,用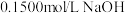 标准溶液滴定某未知浓度的盐酸溶液,下列说法错误的是
标准溶液滴定某未知浓度的盐酸溶液,下列说法错误的是
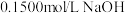 标准溶液滴定某未知浓度的盐酸溶液,下列说法错误的是
标准溶液滴定某未知浓度的盐酸溶液,下列说法错误的是| A.用酸式滴定管盛装待测液 |
| B.装液之前需润洗碱式滴定管 |
| C.指示剂多加不影响测定结果 |
| D.滴定终点时,溶液颜色由无色变为粉红色 |
您最近一年使用:0次
2022-01-14更新
|
1034次组卷
|
4卷引用:青海省西宁市城西区青海师范大学附属实验中学2022-2023学年高二上学期12月月考化学试题
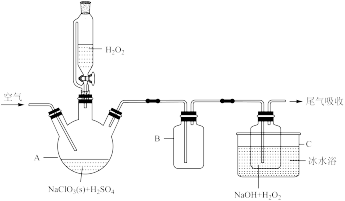
3 . 亚氯酸钠(NaClO2)是一种高效漂白剂,其有效氯含量相当于漂白粉的7倍。可用ClO2与过氧化氢为原料制取亚氯酸钠,相关实验装置如图所示。请回答:
已知:
①2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O;
②2ClO2+2NaOH=NaClO2+NaClO3+H2O;
③已知NaClO2饱和溶液在温度低于38℃时析出NaClO2·3H2O晶体,高于38℃时析出NaClO2晶体,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)仪器B的作用是___________ 。
(2)写出装置C中制备NaClO2固体的化学方程式:___________ 。冰水浴冷却的目的是___________ (写两种)。
(3)在装置A中发生反应生成NaClO2,反应过程中放出大量的热。
①研究表明,实验时装置C中H2O2与NaOH的物料比需要控制在0.8左右,原因可能是___________ 。
②在吸收液中H2O2和NaOH的物料比、浓度和体积不变的条件下,控制反应在0~3℃进行,实验中可采取的措施是___________ 。
(4)尾气吸收时,一般用___________ 溶液吸收过量的ClO2。
(5)为了测定NaClO2粗品的纯度,取上述粗产品a g溶于水配成1 L溶液,取出10 mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.20 mol·L-1 Na2S2O3标准液滴定,达到滴定终点时用去标准液V mL,试计算NaClO2粗品的纯度___________ (提示:2Na2S2O3+I2=Na2S4O6+2NaI)
(6)下列关于该实验及样品组成分析的说法,正确的是___________ (填字母)。
A.装置C中制得的NaClO2固体中可用略低于38℃的热水洗涤2~3遍
B.装置C中制得的NaClO2固体后的操作包括过滤、洗涤和干燥
C.如果撤去装置C中的冰水浴,可能导致产品中混有的杂质是NaClO3和NaCl
D.装置A中空气流速过快或过慢,均会增大NaClO2的产率

已知:
①2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O;
②2ClO2+2NaOH=NaClO2+NaClO3+H2O;
③已知NaClO2饱和溶液在温度低于38℃时析出NaClO2·3H2O晶体,高于38℃时析出NaClO2晶体,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)仪器B的作用是
(2)写出装置C中制备NaClO2固体的化学方程式:
(3)在装置A中发生反应生成NaClO2,反应过程中放出大量的热。
①研究表明,实验时装置C中H2O2与NaOH的物料比需要控制在0.8左右,原因可能是
②在吸收液中H2O2和NaOH的物料比、浓度和体积不变的条件下,控制反应在0~3℃进行,实验中可采取的措施是
(4)尾气吸收时,一般用
(5)为了测定NaClO2粗品的纯度,取上述粗产品a g溶于水配成1 L溶液,取出10 mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.20 mol·L-1 Na2S2O3标准液滴定,达到滴定终点时用去标准液V mL,试计算NaClO2粗品的纯度
(6)下列关于该实验及样品组成分析的说法,正确的是
A.装置C中制得的NaClO2固体中可用略低于38℃的热水洗涤2~3遍
B.装置C中制得的NaClO2固体后的操作包括过滤、洗涤和干燥
C.如果撤去装置C中的冰水浴,可能导致产品中混有的杂质是NaClO3和NaCl
D.装置A中空气流速过快或过慢,均会增大NaClO2的产率
您最近一年使用:0次
名校
4 . 常温下,向20ml,0.1mol·L-1CH3COOH溶液中滴加0.1mol·L-1的NaOH溶液,其pH变化曲线如图所示(忽视温度变化)。下列说法中错误的是


| A.c点表示CH3COOH和NaOH恰好反应完全 |
| B.a点表示的溶液中由水电离出的H+浓度为1.0×10-11mol·L-1 |
| C.b点表示的溶液中c(CH3COO-)>c(Na+) |
| D.b、d点表示的溶液中[c(CH3COO-)•c(H+)]/c(CH3COOH)相等 |
您最近一年使用:0次
名校
5 . 室温下,用0.100 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 mol·L-1的盐酸和醋酸,滴定曲线如图所示。下列说法不正确的是( )


| A.I表示的是滴定醋酸的曲线, 用酚酞作指示剂 |
| B.pH=7时,滴定醋酸消耗的V(NaOH)小于20.00 mL |
| C.V(NaOH)=20.00 mL时,两份溶液中c(Cl-)=c(CH3COO-) |
| D.V(NaOH)=10.00 mL时,醋酸溶液中c(CH3COO-)>c(Na+)> c(H+)>c(OH-) |
您最近一年使用:0次
名校
6 . 碘对动植物的生命是极其重要的,海水里的碘化物和碘酸盐参与大多数海生物的新陈代谢。在高级哺乳动物中,碘以碘化氨基酸的形式集中在甲状腺内,缺乏碘会引起甲状腺肿大。
I.现要从工业含碘废液中回收碘单质(废液中含有H2O、油脂、I2、I)。设计如图一所示的实验过程:

(1)为了将含碘废液中的I2完全转化为I—而进入水层,向含碘废液中加入了稍过量的A溶液,则A应该具有___________ 性。
(2)将在三颈烧瓶中反应完全后的溶液经过操作②获得碘单质,操作②包含多步操作,操作名称分别为萃取、_____ 、_____ ,在操作②中必须用到下列所示的部分仪器或装置,这些仪器和装置是________________ (填标号)。

(3)将操作①所得溶液放入图二所示的三颈烧瓶中,并用盐酸调至pH约为2,再缓慢通入适量Cl2,使其在30~40℃反应。写出其中发生反应的离子方程式________________ ;Cl2不能过量,因为过量的Cl2将I2氧化为IO3-,写出该反应的离子方程式__________ 。
II.油脂的不饱和度可通过油脂与碘的加成反应测定,通常称为油脂的碘值。碘值越大,油脂的不饱和程度越高。碘值是指100g油脂所能吸收的I2的克数。称取xg某油脂,加入含ymol I2的韦氏溶液( 韦氏溶液是碘值测定时使用的特殊试剂,含有CH3COOH),充分振荡;过量的I2用cmol/L Na2S2O3标准溶液滴定(淀粉作指示剂),消耗Na2S2O3溶液V mL(滴定反应为:2Na2S2O3+I2=Na2S4O6+2NaI)。回答下列问题:
(1)下列有关滴定的说法不正确的是________ (填标号)。
A.标准Na2S2O3溶液应盛装在碱式滴定管中
B.滴定时眼睛只要注视滴定管中溶液体积的变化
C. 滴定终点时,俯视读数,导致测定结果偏低
D.滴定到溶液由无色变蓝色时应该立即停止滴定
(2)用该测定方法测定的碘值需要用相关的实验校正,因为所测得的碘值总比实际碘值低,原因是_______________________________________________ 。
(3)该油脂的碘值为_____ g(列式表示)。
I.现要从工业含碘废液中回收碘单质(废液中含有H2O、油脂、I2、I)。设计如图一所示的实验过程:

(1)为了将含碘废液中的I2完全转化为I—而进入水层,向含碘废液中加入了稍过量的A溶液,则A应该具有
(2)将在三颈烧瓶中反应完全后的溶液经过操作②获得碘单质,操作②包含多步操作,操作名称分别为萃取、

(3)将操作①所得溶液放入图二所示的三颈烧瓶中,并用盐酸调至pH约为2,再缓慢通入适量Cl2,使其在30~40℃反应。写出其中发生反应的离子方程式
II.油脂的不饱和度可通过油脂与碘的加成反应测定,通常称为油脂的碘值。碘值越大,油脂的不饱和程度越高。碘值是指100g油脂所能吸收的I2的克数。称取xg某油脂,加入含ymol I2的韦氏溶液( 韦氏溶液是碘值测定时使用的特殊试剂,含有CH3COOH),充分振荡;过量的I2用cmol/L Na2S2O3标准溶液滴定(淀粉作指示剂),消耗Na2S2O3溶液V mL(滴定反应为:2Na2S2O3+I2=Na2S4O6+2NaI)。回答下列问题:
(1)下列有关滴定的说法不正确的是
A.标准Na2S2O3溶液应盛装在碱式滴定管中
B.滴定时眼睛只要注视滴定管中溶液体积的变化
C. 滴定终点时,俯视读数,导致测定结果偏低
D.滴定到溶液由无色变蓝色时应该立即停止滴定
(2)用该测定方法测定的碘值需要用相关的实验校正,因为所测得的碘值总比实际碘值低,原因是
(3)该油脂的碘值为
您最近一年使用:0次
2018-05-04更新
|
364次组卷
|
3卷引用:【全国校级联考】青海省西宁市第四高级中学、第五中学、第十四中学三校2018届高三4月联考理综化学试题



