名校
解题方法
1 . 某实验小组用如下实验测定海带预处理后所得溶液的碘含量,实验步骤及现象如下:
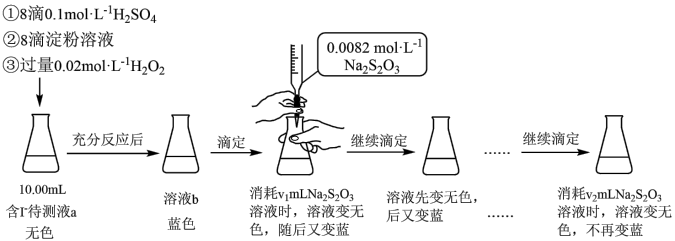
已知:I2+2Na2S2O3=2NaI+Na2S4O6,下列说法不正确 的是:

已知:I2+2Na2S2O3=2NaI+Na2S4O6,下列说法
| A.溶液b为蓝色是因为发生了反应:H2O2+2I-+2H+=I2+2H2O |
| B.该实验可证明蓝色恢复与空气无关 |
| C.溶液反复由无色变蓝的原因可能是H2O2氧化I-的反应速率比Na2S2O3还原I2的反应速率快 |
| D.上述实验不能准确测定待测液中的碘含量,应补充实验步骤:滴定前向溶液b中加少量MnO2,反应至不再产生气泡,过滤,对滤液进行滴定 |
您最近一年使用:0次
2023-11-06更新
|
1263次组卷
|
10卷引用:内蒙古赤峰二中2023-2024学年高二上学期第二次月考化学试题
内蒙古赤峰二中2023-2024学年高二上学期第二次月考化学试题北京市丰台区2023-2024学年高三上学期期中练习化学试题(已下线)选择题21-23(已下线)选择题11-14湖北省武昌实验中学2023-2024学年高三上学期12月月考化学试题黑龙江省大庆实验中学实验三部2023-2024学年高三上学期阶段考试(二)化学试题湖南省长沙市长郡中学2023-2024学年高二上学期12月阶段性检测化学试题河北省保定市唐县第一中学2023-2024学年高二上学期1月期末化学试题河南省信阳高级中学2023-2024学年高二上学期元旦测试化学试题北京实验学校2023-2024学年高三上学期12月化学学科竞赛试题
解题方法
2 . 醋是我们生活中离不开的一种重要调味品,其主要成分是醋酸,某研究性学习小组为了探究醋酸的电离情况,进行了如下实验:
Ⅰ.小组同学取一定质量的冰醋酸加水稀释成一定浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
(1)25℃,冰醋酸稀释过程中溶液的导电能力变化如图所示。

①a、b、c三点对应的溶液中,c(H+)由小到大的顺序为____ 。
②a、b、c三点对应的溶液中,CH3COOH的电离程度最大的是____ 。
③若使b点对应的溶液中c(CH3COO-)增大、c(H+)减小,可采用的方法是____ (答一条即可)。
(2)取C点溶液用____ (填“量筒”或“酸式滴定管”)量取25.00mL,稀释到100.00mL。
①为准确测定c点醋酸溶液浓度,分别取20.00mL稀释后的醋酸溶液,滴加___ (填指示剂),用0.2000 mol∙L−1的NaOH溶液对溶液进行滴定,几次滴定消耗NaOH溶液的体积如表:
②该醋酸溶液的准确浓度为____ (保留小数点后四位) 。
③滴定前排气泡时,应选择图中的____ (填字母,下同)。
a. b.
b. c.
c. d.
d.
④下列错误操作,造成测定结果偏高的是____ (多选、错选不得分)。
a.未用标准液润洗碱式滴定管
b.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
c.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
d.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
Ⅱ.小组同学用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是___ 。
(4)设计一个简单的实验,证明醋酸的酸性比碳酸的强。实验操作及现象为___ 。
Ⅰ.小组同学取一定质量的冰醋酸加水稀释成一定浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
(1)25℃,冰醋酸稀释过程中溶液的导电能力变化如图所示。

①a、b、c三点对应的溶液中,c(H+)由小到大的顺序为
②a、b、c三点对应的溶液中,CH3COOH的电离程度最大的是
③若使b点对应的溶液中c(CH3COO-)增大、c(H+)减小,可采用的方法是
(2)取C点溶液用
①为准确测定c点醋酸溶液浓度,分别取20.00mL稀释后的醋酸溶液,滴加
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 19.95 | 30.13 |
③滴定前排气泡时,应选择图中的
a.
 b.
b. c.
c. d.
d.
④下列错误操作,造成测定结果偏高的是
a.未用标准液润洗碱式滴定管
b.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
c.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
d.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
Ⅱ.小组同学用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
| 醋酸的浓度(mol∙L−1) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
(4)设计一个简单的实验,证明醋酸的酸性比碳酸的强。实验操作及现象为
您最近一年使用:0次
解题方法
3 . 某化学兴趣小组进行如下有关 性质和含量测定的探究活动。
性质和含量测定的探究活动。
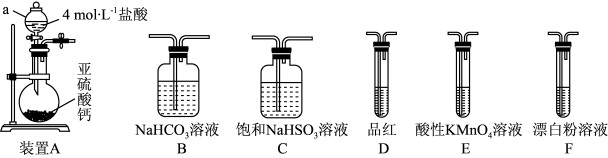
(1)装置A中仪器 的名称为
的名称为_______ 。写出 中
中 价的硫元素体现氧化性的化学反应
价的硫元素体现氧化性的化学反应_______ (用化学方程式表示)。
(2)选用上图中的装置和药品探究亚硫酸与次氯酸的酸性强弱:
①甲同学认为按照 尾气处理顺序连接装置可以证明亚硫酸和次氯酸的酸性强弱,乙同学认为该方案不合理其理由是
尾气处理顺序连接装置可以证明亚硫酸和次氯酸的酸性强弱,乙同学认为该方案不合理其理由是_______ 。
②丙同学设计的合理实验方案为:按照
_______  尾气处理(填字母)顺序连接装置。可以证明亚硫酸的酸性强于次氯酸的酸性的实验现象是
尾气处理(填字母)顺序连接装置。可以证明亚硫酸的酸性强于次氯酸的酸性的实验现象是_______ 。
③其中装置C的作用是_______ 。常温下,测得装置C中饱和 溶液的
溶液的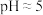 ,则该溶液中所有离子浓度由大到小的顺序为
,则该溶液中所有离子浓度由大到小的顺序为_______ 。(已知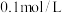 的
的 溶液
溶液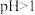 )
)
(3)测定某葡萄酒中抗氧化剂的残留量(以游离 计算)的方案如下:
计算)的方案如下:

(已知:滴定时反应的化学方程式为 )
)
①按上述方案实验,消耗标准 溶液
溶液 ,该次实验测得样品中抗氧化剂的残留量(以游离
,该次实验测得样品中抗氧化剂的残留量(以游离 计算)为
计算)为_______  。
。
②在上述实验过程中,若有部分 被空气氧化,则测得结果
被空气氧化,则测得结果_______ (填“偏高”、“偏低”或“不变”)。
 性质和含量测定的探究活动。
性质和含量测定的探究活动。
(1)装置A中仪器
 的名称为
的名称为 中
中 价的硫元素体现氧化性的化学反应
价的硫元素体现氧化性的化学反应(2)选用上图中的装置和药品探究亚硫酸与次氯酸的酸性强弱:
①甲同学认为按照
 尾气处理顺序连接装置可以证明亚硫酸和次氯酸的酸性强弱,乙同学认为该方案不合理其理由是
尾气处理顺序连接装置可以证明亚硫酸和次氯酸的酸性强弱,乙同学认为该方案不合理其理由是②丙同学设计的合理实验方案为:按照
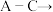
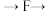 尾气处理(填字母)顺序连接装置。可以证明亚硫酸的酸性强于次氯酸的酸性的实验现象是
尾气处理(填字母)顺序连接装置。可以证明亚硫酸的酸性强于次氯酸的酸性的实验现象是③其中装置C的作用是
 溶液的
溶液的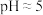 ,则该溶液中所有离子浓度由大到小的顺序为
,则该溶液中所有离子浓度由大到小的顺序为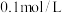 的
的 溶液
溶液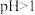 )
)(3)测定某葡萄酒中抗氧化剂的残留量(以游离
 计算)的方案如下:
计算)的方案如下:
(已知:滴定时反应的化学方程式为
 )
)①按上述方案实验,消耗标准
 溶液
溶液 ,该次实验测得样品中抗氧化剂的残留量(以游离
,该次实验测得样品中抗氧化剂的残留量(以游离 计算)为
计算)为 。
。②在上述实验过程中,若有部分
 被空气氧化,则测得结果
被空气氧化,则测得结果
您最近一年使用:0次
4 . 某化学兴趣小组做以下属于对SO2的性质进行研究。请回答下列问题:

(1)装置B的作用是_______________________ 。
(2)装置C的目的是检验SO2的_____ 性。装置D中NaOH全部转化为NaHSO3的标志是_______________ 。
(3)请设计简单实验证明:室温下,NaHSO3溶液中HSO3-的电离平衡常数Ka与水解平衡常数Kb的相对大小关系_______________________________ 。
(4)向装置D所得NaHSO3溶液中加入NaClO溶液时,反应有下列三种可能的情况:
Ⅰ.HSO3-与ClO-恰好反应 Ⅱ. NaClO不足 Ⅲ. NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成下表:(已知酸性:H2SO3>H2CO3>HClO)
(5)测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2 +2H2O==H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为_________ g·L-1。
②在上述实验过程中,若有部分HI 被空气氧化,则测得结果________ (填“偏高”、偏低”或“不变”)。

(1)装置B的作用是
(2)装置C的目的是检验SO2的
(3)请设计简单实验证明:室温下,NaHSO3溶液中HSO3-的电离平衡常数Ka与水解平衡常数Kb的相对大小关系
(4)向装置D所得NaHSO3溶液中加入NaClO溶液时,反应有下列三种可能的情况:
Ⅰ.HSO3-与ClO-恰好反应 Ⅱ. NaClO不足 Ⅲ. NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成下表:(已知酸性:H2SO3>H2CO3>HClO)
| 实验序号 | 实验操作 | 现象 | 结论 |
| ① | 加入几小块CaCO3固体 | 有气泡产生 | Ⅰ或Ⅱ |
| ② | 滴加少量淀粉KI溶液,振荡 | Ⅲ | |
| ③ | 滴加少量溴水,振荡 | Ⅱ | |
| ④ | 滴加少量酸性KMnO4溶液,振荡 | 溶液呈紫色 |

(已知:滴定时反应的化学方程式为SO2+I2 +2H2O==H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为
②在上述实验过程中,若有部分HI 被空气氧化,则测得结果
您最近一年使用:0次
名校
解题方法
5 . 常温时,采用甲基橙和酚酞双指示剂,用盐酸滴定Na2CO3溶液,溶液中 lgc(H2CO3)、 lgc(HCO )、lgc(CO
)、lgc(CO )、lgc(H+ )、lgc(OH-)随溶液 pH 的变化及滴定曲线如图所示,下列说法不正确的是
)、lgc(H+ )、lgc(OH-)随溶液 pH 的变化及滴定曲线如图所示,下列说法不正确的是
 )、lgc(CO
)、lgc(CO )、lgc(H+ )、lgc(OH-)随溶液 pH 的变化及滴定曲线如图所示,下列说法不正确的是
)、lgc(H+ )、lgc(OH-)随溶液 pH 的变化及滴定曲线如图所示,下列说法不正确的是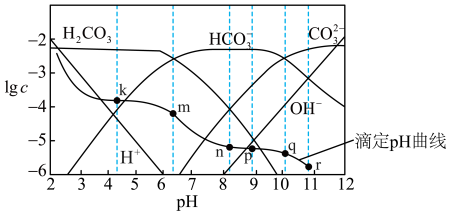
| A.整个滴定过程中可先用酚酞再用甲基橙作指示剂 |
| B.n点的pH为m点和q点pH的平均值 |
C.r点溶液中:c(OH-) = c(H+ )+c(HCO )+c(H2CO3) )+c(H2CO3) |
| D.r点到 k 点对应的变化过程中,溶液中水的电离程度一直减小 |
您最近一年使用:0次
2024-01-08更新
|
169次组卷
|
10卷引用:内蒙古赤峰二中2023-2024学年高三上学期第三次月考化学试题
内蒙古赤峰二中2023-2024学年高三上学期第三次月考化学试题辽宁省朝阳市2021届高三第四次模拟考试化学试题河北省部分重点高中2023-2024学年高三上学期第一次综合素养测评化学试题广东省河源中学2023-2024学年上学期高三年级一调考试化学试题河北省衡水中学2023-2024学年高三上学期一调考试化学试题河北省石家庄市部分名校2024届高三上学期一调考试化学试题河北省唐山市第二十三中2023-2024学年高三上学期期中考试化学试题2024届陕西省西安市西北工业大学附属中学高三上学期第二次模拟考试理科综合试题-高中化学2024届陕西省西安市第一中学高三上学期模拟测试理科综合试题-高中化学湖南省长沙麓山国际实验学校2023-2024学年高二下学期4月份学情检测化学试卷
名校
6 . H2S2O3是一种弱酸,实验室欲用0.01 mol·L-1的Na2S2O3溶液滴定I2溶液,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,如图,下列说法合理的是
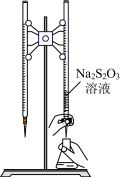

| A.Na2S2O3是该反应的还原剂 |
| B.该滴定可用甲基橙作指示剂 |
| C.该滴定可选用图所示装置 |
| D.该反应中每消耗2 mol Na2S2O3,电子转移数为4 mol |
您最近一年使用:0次
2022-10-10更新
|
435次组卷
|
40卷引用:【全国百强校】内蒙古自治区集宁一中2018-2019学年高二上学期第一次阶段测试化学试题
【全国百强校】内蒙古自治区集宁一中2018-2019学年高二上学期第一次阶段测试化学试题2015届福建省福州市高三上学期期末考试化学试卷2016届福建省仙游一中高三上学期10月月考化学试卷2018版化学(苏教版)高考总复习专题八课时跟踪训练--水的电离和溶液的酸碱性2017-2018学年四川省乐山四校高二第二学期半期联考化学试题河北省辛集市第一中学2017-2018学年高一下学期期末考试化学试题福建省晋江市季延中学2017-2018学年高二下学期期末考试化学试题2018-2019学年人教版高中化学选修四水溶液中的离子平衡章末综合测评题(三)【校级联考】吉林省辽源市田家炳高级中学(第六十六届友好学校)2018-2019学年高二上学期期末联考化学试题【全国百强校】江西省南昌市第二中学2018-2019学年高二上学期期末考试化学试题河北省唐山市第二中学2019-2020学年高二上学期期中考试化学试题江西省上饶市上饶中学2019-2020学年高二上学期第二次月考化学(理科实验、重点)试题山西省大同市天镇县第一中学校2019-2020学年高二上学期第二次月考化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——酸碱中和滴定2020届高三化学选修4二轮专题练——酸碱中和滴定章节强化练【精编25题】2020届高三化学选修4二轮专题练——酸碱中和滴定的综合应用与拓展【精编25题】人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 章末综合检测卷浙江省苍南县金乡卫城中学2020-2021学年高二上学期第一次月考化学试题人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 易错疑难集训(二)江苏省南京市中华中学2020-2021学年高二上学期9月测试化学试题选择性必修1(SJ)专题3易错疑难集训(一)河北省迁安市2020-2021学年高二上学期期末考试化学试题江西省鄱阳县第一中学2019-2020学年高二上学期第二次检测化学试题(已下线)第22讲 水的电离与溶液的pH (练) — 2022年高考化学一轮复习讲练测(新教材新高考)江西省吉安一中2021-2022学年高二上学期第一次段考化学试题广东实验中学2021-2022学年高二上学期期中考试化学试题广东省揭阳华侨高级中学2021-2022学年高二上学期期中考试化学试题江西省吉安市安福二中、吉安县三中、井大附中三校2021-2022学年高二上学期12月联考化学试题第二节 水的电离和溶液的pH 第3课时 酸碱中和滴定河北省保定市博野中学2021-2022学年高二上学期期中考试化学试题(已下线)第22讲 水的电离与溶液的pH(练)-2023年高考化学一轮复习讲练测(新教材新高考)福建省莆田第十五中学2022-2023学年高三上学期第一次月考化学试题黑龙江省牡丹江市第三高级中学2022-2023学年高三上学期第五次月考化学试题(已下线)第八章 水溶液中的离子反应与平衡 第48练 酸碱中和反应及中和滴定(已下线)第3讲 酸碱中和滴定【精品卷】3.2.3 酸碱中和滴定课堂例题-人教版2023-2024学年选择性必修1江苏省南菁高级中学2023-2024学年高二上学期10月考试化学试题福建省德化一中、永安一中、漳平一中三校协作2023-2024学年高二上学期12月联考化学试题福建省泉州市泉港区第一中学2023-2024学年高二上学期12月月考化学试题福建省福州格致鼓山中学、教院二附中、铜盘中学、十五中、十中2023-2024学年高二上学期期末联考化学试题
名校
7 . 常温下,向二元弱酸H2Y溶液中滴加KOH溶液,所得混合溶液的pH与离子浓度变化的关系如图所示。下列有关说法错误的是


A.曲线M表示pH与lg 的变化关系 的变化关系 |
| B.Ka2(H2Y)的数量级为10-5 |
| C.d点溶液中:c(H+)-c(OH-)=2c(Y2-)+c(HY-)-c(K+) |
| D.交点e的溶液中:c(H2Y)=c(Y2-)>c(HY-)>c(H+)>c(OH-) |
您最近一年使用:0次
2021-10-15更新
|
1295次组卷
|
3卷引用:内蒙古鄂尔多斯市第一中学2021-2022学年高二上学期第一次月考化学试题
名校
解题方法
8 . 25℃时,向20.00mL 盐酸中滴加
盐酸中滴加 的NaOH溶液,溶液的pH随NaOH溶液体积的变化如图。已知lg5≈0.7.下列说法错误的是
的NaOH溶液,溶液的pH随NaOH溶液体积的变化如图。已知lg5≈0.7.下列说法错误的是
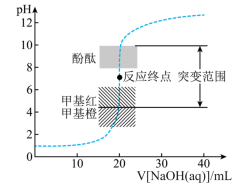
 盐酸中滴加
盐酸中滴加 的NaOH溶液,溶液的pH随NaOH溶液体积的变化如图。已知lg5≈0.7.下列说法错误的是
的NaOH溶液,溶液的pH随NaOH溶液体积的变化如图。已知lg5≈0.7.下列说法错误的是
| A.NaOH与盐酸恰好完全反应时,pH=7 |
| B.当接近终点时,需加快滴定速度便于观察颜色突变 |
| C.选择甲基红指示反应终点,误差比甲基橙的小 |
| D.V[NaOH(aq)]=30.00mL时,pH≈12.3 |
您最近一年使用:0次
2021-12-04更新
|
91次组卷
|
3卷引用:内蒙古乌兰浩特市第四中学2022-2023学年高二上学期期中考试化学试题
9 . NOx含量的测定,是将气体样品通入适量酸化的H2O2溶液中,使NOx完全被氧化成NO3-,加水稀释,量取该溶液,加入FeSO4标准溶液(过量),充分反应后,用K2Cr2O7标准溶液滴定剩余的Fe2+下列说法不正确的是
A.NO被H2O2氧化为 的离子方程式为2NO+3H2O2=2H++2 的离子方程式为2NO+3H2O2=2H++2 +2H2O +2H2O |
| B.滴定操作使用的玻璃仪器有酸式滴定管 |
| C.若FeSO4标准溶液部分变质,会使测定结果偏高 |
| D.气体样品中混有空气,测定结果会偏高 |
您最近一年使用:0次
名校
解题方法
10 . 亚砷酸(H3AsO3)可以用于治疗白血病,其在溶液中存在多种微粒形态,将KOH溶液滴入亚砷酸溶液,各种微粒物质的量分数与溶液的pH关系如图所示。下列说法不正确的是
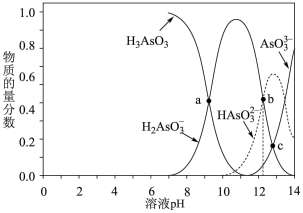

| A.人体血液的pH在7.35-7.45之间,患者用药后人体中含As元素的主要微粒是H3AsO3 |
B.pH在8.0~10.0时,反应的离子方程式为:H3AsO3+OH-=H2AsO +H2O +H2O |
C.通常情况下,H2AsO 电离程度大于水解程度 电离程度大于水解程度 |
D.交点b的溶液中:2c(HAsO )+4c(AsO )+4c(AsO )<c(K+) )<c(K+) |
您最近一年使用:0次
2021-02-12更新
|
965次组卷
|
5卷引用:内蒙古乌兰浩特第一中学2022-2023学年高二上学期第三次月考化学试题
内蒙古乌兰浩特第一中学2022-2023学年高二上学期第三次月考化学试题江西省吉安市“省重点中学五校协作体”2021届高三第一次联考理综化学试题(已下线)难点8 水溶液中的四大平衡常数-2021年高考化学【热点·重点·难点】专练(新高考)(已下线)题型26 电离平衡常数、水解平衡常数及其应用图像湖南省株洲市第一中学2021届高三下学期第三次模拟检测化学试题



