解题方法
1 . 高铁酸钾(K2FeO4)是一种强氧化剂和环境友好型水处理剂,易分解,遇水和酸易变质。某学习小组在实验室对高铁酸钾的制备和一些性质进行探究。回答下列问题:
(1)高铁酸钾的制备,装置如图1所示。
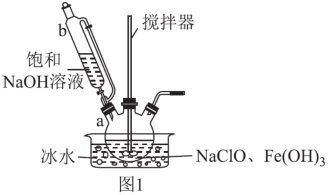
步骤一:将b中饱和NaOH溶液全部逐滴滴入a中,充分反应;
步骤二:由b向a中反应后液体中加入饱和KOH溶液;
步骤三:将a中所得浊液移出,分离提纯。
①仪器b的名称是_______ ,其侧管的作用为_______ 。
②a中制备Na2FeO4反应的离子方程式为_______ 。
③K2FeO4悬浊液经过滤、洗涤,可得粗产品。粗产品中的可溶性杂质可通过_______ 方法进一步提纯。
(2)K2FeO4遇水转化为Fe(OH)3,则其能用于净水的原理为:_______ 。
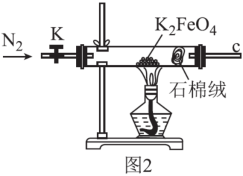
(3)用图2所示装置探究K2FeO4受热分解的产物。设计实验方案证明完全分解后的固体产物中不含Fe(II):取完全分解后的少量固体,溶于稀硫酸,_______ 。
(4)实验室可用间接碘量法测定含少量KCl杂质的K2FeO4样品的纯度:称取0.9000gK2FeO4样品溶于碱性KI溶液中,调节pH使混合液充分反应。用1.000mol·L-1的Na2S2O3标准溶液进行滴定,消耗Na2S2O3标准溶液15.00mL。请计算K2FeO4样品的纯度:_______ 。
已知: +4I-+8H+=Fe2++2I2+4H2O;I2+2
+4I-+8H+=Fe2++2I2+4H2O;I2+2 =
= +2I-。
+2I-。
(1)高铁酸钾的制备,装置如图1所示。

步骤一:将b中饱和NaOH溶液全部逐滴滴入a中,充分反应;
步骤二:由b向a中反应后液体中加入饱和KOH溶液;
步骤三:将a中所得浊液移出,分离提纯。
①仪器b的名称是
②a中制备Na2FeO4反应的离子方程式为
③K2FeO4悬浊液经过滤、洗涤,可得粗产品。粗产品中的可溶性杂质可通过
(2)K2FeO4遇水转化为Fe(OH)3,则其能用于净水的原理为:
(3)用图2所示装置探究K2FeO4受热分解的产物。设计实验方案证明完全分解后的固体产物中不含Fe(II):取完全分解后的少量固体,溶于稀硫酸,

(4)实验室可用间接碘量法测定含少量KCl杂质的K2FeO4样品的纯度:称取0.9000gK2FeO4样品溶于碱性KI溶液中,调节pH使混合液充分反应。用1.000mol·L-1的Na2S2O3标准溶液进行滴定,消耗Na2S2O3标准溶液15.00mL。请计算K2FeO4样品的纯度:
已知:
 +4I-+8H+=Fe2++2I2+4H2O;I2+2
+4I-+8H+=Fe2++2I2+4H2O;I2+2 =
= +2I-。
+2I-。
您最近一年使用:0次
名校
2 . 常温下,用 乙酸溶液滴定
乙酸溶液滴定 溶液,溶液的
溶液,溶液的 变化曲线如图所示。下列说法错误的是
变化曲线如图所示。下列说法错误的是

已知:常温下, 。
。
 乙酸溶液滴定
乙酸溶液滴定 溶液,溶液的
溶液,溶液的 变化曲线如图所示。下列说法错误的是
变化曲线如图所示。下列说法错误的是
已知:常温下,
 。
。A.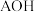 为一元强碱 为一元强碱 |
B. 点溶液中存在: 点溶液中存在: |
C.滴定过程中, 点水的电离程度最大 点水的电离程度最大 |
D. 点: 点: |
您最近一年使用:0次
名校
3 . 某实验小组利用虚拟感应器技术测定用1 mol·L-1的碳酸钠溶液滴定10.00 mL 1 mol·L-1盐酸过程中碳酸根离子浓度、碳酸氢根离子浓度、碳酸分子浓度的变化(忽略滴定过程中CO2的逸出),变化曲线如图所示。已知:25℃时,H2CO3的Ka1=4.0×10-7,Ka2=5.0×10-11;lg4=0.6。下列说法不正确 的是

A.曲线Ⅱ表示C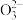 的浓度变化 的浓度变化 | B.V2=10 |
| C.溶液中水的电离程度:b>d | D.c点对应溶液的pH=6.4 |
您最近一年使用:0次
名校
解题方法
4 . 常温常压下,某同学向20.00mL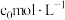 氨水中逐滴加入
氨水中逐滴加入 的盐酸,实验测得溶液的pH随加入盐酸体积的变化如图所示,其中N点为反应终点(此时盐酸与氨水恰好完全反应),此时消耗盐酸的体积为17.20mL。下列说法中正确的是
的盐酸,实验测得溶液的pH随加入盐酸体积的变化如图所示,其中N点为反应终点(此时盐酸与氨水恰好完全反应),此时消耗盐酸的体积为17.20mL。下列说法中正确的是

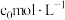 氨水中逐滴加入
氨水中逐滴加入 的盐酸,实验测得溶液的pH随加入盐酸体积的变化如图所示,其中N点为反应终点(此时盐酸与氨水恰好完全反应),此时消耗盐酸的体积为17.20mL。下列说法中正确的是
的盐酸,实验测得溶液的pH随加入盐酸体积的变化如图所示,其中N点为反应终点(此时盐酸与氨水恰好完全反应),此时消耗盐酸的体积为17.20mL。下列说法中正确的是
A. |
B.M点的溶液中存在: |
C.N点溶液中: |
| D.P、M、N三点对应溶液中水的电离程度最大的为M点 |
您最近一年使用:0次
2023-05-16更新
|
98次组卷
|
2卷引用:海南省琼海市2023届高三联考二模化学试题
名校
解题方法
5 . 常温下,向 的HA溶液中逐滴加入
的HA溶液中逐滴加入 的烧碱溶液,溶液中由水电离出的
的烧碱溶液,溶液中由水电离出的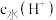 随加入烧碱溶液体积的变化如图所示,下列说法错误的是
随加入烧碱溶液体积的变化如图所示,下列说法错误的是

 的HA溶液中逐滴加入
的HA溶液中逐滴加入 的烧碱溶液,溶液中由水电离出的
的烧碱溶液,溶液中由水电离出的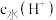 随加入烧碱溶液体积的变化如图所示,下列说法错误的是
随加入烧碱溶液体积的变化如图所示,下列说法错误的是
A.由图可知A-的水解平衡常数K约为 |
B.B点溶液中粒子浓度之间存在: |
C.E点溶液中粒子浓度之间存在: |
D.F点的溶液呈碱性,粒子浓度之间存在: |
您最近一年使用:0次
2022-10-27更新
|
440次组卷
|
3卷引用:海南省海南中学2023- 2024学年高三上学期第4次月考化学试题
名校
6 . 某温度下,向20mL0.15mol•L-1NH4Cl溶液中滴加0.15mol•L-1的AgNO3溶液,该实验使用(NH4)2CrO4作指示剂(已知Ag2CrO4为砖红色沉淀)。滴加过程中,溶液中-lgc(Cl-)与AgNO3溶液体积(V)的关系如图所示。下列说法错误的是


| A.相同温度下,Ksp(Ag2CrO4)一定大于Ksp(AgCl) |
| B.由图可知当恰好达到滴定终点时,Cl-恰好完全沉淀 |
C.已知Ksp(Ag2CrO4)=10-12,a点时,溶液中c(CrO )≥0.01mol•L-1 )≥0.01mol•L-1 |
| D.若用0.075mol•L-1的AgNO3溶液,则a点移至b点;将NH4Cl溶液改为等浓度的NH4Br溶液,则a点移至c点 |
您最近一年使用:0次
2022-01-11更新
|
228次组卷
|
2卷引用:海南省海口市海南中学2023届高三下学期第二次模拟化学试题
7 . 已知:pH=-lgc(H+),pOH=-lgc(OH-)。常温下,向某浓度的盐酸溶液中滴加氨水溶液,所得溶液pOH和pH变化如图所示。下列说法不正确的是
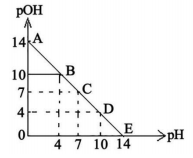

| A.盐酸的初始浓度为0.1mol∙L−1 |
| B.B点溶液和D点溶液水电离的氢氧根离子浓度相等 |
| C.C点溶液中c(NH4+)=c(Cl−) |
| D.升高温度(高于25℃),滴定过程中pOH+pH<14 |
您最近一年使用:0次
2018-12-05更新
|
1010次组卷
|
3卷引用:海南省琼海市嘉积第二中学2021-2022学年高二下学期教学质量监测(段考)化学科试题
名校
8 . 已知:pKa=-lgKa,25℃时,H2A的pKa1=1.85,Pka2=7.19。用0.1 mol/L NaOH溶液滴定20 mL 0.1 mol/L H2A溶液的滴定曲线如图所示(曲线上的数字为pH)。下列说法不正确 的是( )
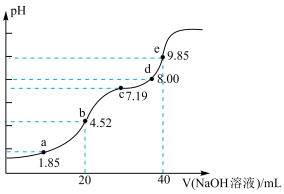

| A.a点所得溶液中:2n(H2A)+n(A2-)=0.002mol |
| B.b点所得溶液中:c(H2A)+c(H+)=c(A2-)+c(OH-) |
| C.c点所得溶液中:c(Na+)<3c(HA-) |
| D.d点所得溶液中:c(Na+)>c(A2-)>c(HA-) |
您最近一年使用:0次
2019-04-19更新
|
715次组卷
|
5卷引用:2016届海南省农垦中学高三考前押题理综化学试卷
9 . 室温下,用0.10mol/LNaOH溶液分别滴定20.00mL0.10mol/L的HA和HB溶液,滴定曲线如下图所示。下列说法错误的是


| A.当Ⅰ代表HB,b点时体系中有:c(B-)+c(HB)=0.05mol/L |
| B.滴定分析中,甲基橙不能用做滴定曲线Ⅰ中的指示剂 |
| C.a点时的溶液中离子浓度最大的是c(Na+) |
| D.若Ⅱ代表HA的滴定曲线,则Ka(HB)≈10-5 |
您最近一年使用:0次



