名校
解题方法
1 . 著名化学反应“法老之蛇”曾令无数人叹服。某兴趣小组为探究 分解产物的成分,在连接好如图所示装置,检验装置气密性后,点燃A处酒精灯。
分解产物的成分,在连接好如图所示装置,检验装置气密性后,点燃A处酒精灯。

回答下列问题:
(1)仪器a的名称为___________ 。
(2)待A中固体充分分解后,取下B装置,B瓶中有无色液体,并有类似氯仿的芳香甜味,与酯混合能够互溶,经查证,B中液体为 ,请举出一种其在实验室中的用途
,请举出一种其在实验室中的用途__________ 。
(3)取下C装置,点燃C中气体,气体燃烧火焰呈紫红色,边缘略带蓝色,则E中反应的化学方程式为___________ 。
(4)取下D装置,将燃着的镁条伸入瓶中,镁条继续燃烧。取出燃烧产物,加入少量热水,产生的气体能使湿润的红色石蕊试纸变蓝,可证明 分解产物中含有
分解产物中含有___________ 。
(5)充分反应后A中剩余固体经证实为HgS。结合以上推断写出 分解的化学方程式
分解的化学方程式_____ 。
(6)用王水溶解A中剩余固体,记溶解后的溶液为X。可用 滴定法测定溶液X中离子浓度以测定
滴定法测定溶液X中离子浓度以测定 的分解率。
的分解率。
已知:① ;
;
② ;
;
③ 标准溶液中含有
标准溶液中含有 指示液。
指示液。
若取上述溶液X,用浓度为cmol/L的 标准溶液进行滴定,消耗VmL,忽略反应前后溶液体积变化,滴定终点的现象为
标准溶液进行滴定,消耗VmL,忽略反应前后溶液体积变化,滴定终点的现象为___________ ;原 固体质量为mg,
固体质量为mg, 的摩尔质量记为M,则
的摩尔质量记为M,则 的分解率为
的分解率为___________ 。(用含M、c、V、m的式子表示)
 分解产物的成分,在连接好如图所示装置,检验装置气密性后,点燃A处酒精灯。
分解产物的成分,在连接好如图所示装置,检验装置气密性后,点燃A处酒精灯。
 | 沸点为-21.2℃,熔点为-34.4℃,化学性质与卤素单质相似,有剧毒,燃烧时火焰呈紫红色,边缘略带蓝色 |
 | 沸点为46.5℃,熔点为-111.9℃,能与酯互溶 |
(1)仪器a的名称为
(2)待A中固体充分分解后,取下B装置,B瓶中有无色液体,并有类似氯仿的芳香甜味,与酯混合能够互溶,经查证,B中液体为
 ,请举出一种其在实验室中的用途
,请举出一种其在实验室中的用途(3)取下C装置,点燃C中气体,气体燃烧火焰呈紫红色,边缘略带蓝色,则E中反应的化学方程式为
(4)取下D装置,将燃着的镁条伸入瓶中,镁条继续燃烧。取出燃烧产物,加入少量热水,产生的气体能使湿润的红色石蕊试纸变蓝,可证明
 分解产物中含有
分解产物中含有(5)充分反应后A中剩余固体经证实为HgS。结合以上推断写出
 分解的化学方程式
分解的化学方程式(6)用王水溶解A中剩余固体,记溶解后的溶液为X。可用
 滴定法测定溶液X中离子浓度以测定
滴定法测定溶液X中离子浓度以测定 的分解率。
的分解率。已知:①
 ;
;②
 ;
;③
 标准溶液中含有
标准溶液中含有 指示液。
指示液。若取上述溶液X,用浓度为cmol/L的
 标准溶液进行滴定,消耗VmL,忽略反应前后溶液体积变化,滴定终点的现象为
标准溶液进行滴定,消耗VmL,忽略反应前后溶液体积变化,滴定终点的现象为 固体质量为mg,
固体质量为mg, 的摩尔质量记为M,则
的摩尔质量记为M,则 的分解率为
的分解率为
您最近一年使用:0次
2023-12-21更新
|
66次组卷
|
2卷引用:福建省“德化一中、永安一中、漳平一中”三校协作2023-2024学年高三上学期12月联考化学试题
解题方法
2 . 铋( )的化合物广泛应用于电子、医药等领域。由辉铋碎(主要成分为
)的化合物广泛应用于电子、医药等领域。由辉铋碎(主要成分为 ,含
,含 、
、 、
、 等杂质)制备
等杂质)制备 的工艺流程如下:
的工艺流程如下:
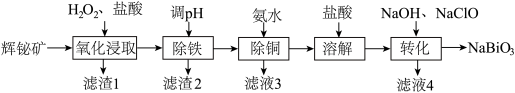
已知:ⅰ.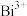 易水解;
易水解; 难溶于冷水。
难溶于冷水。
ⅱ.“氧化浸取”时,铋元素转化为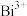 ,硫元素转化为硫单质。
,硫元素转化为硫单质。
ⅲ.
回答下列问题:
(1)为提高“氧化浸取”速率,采取的措施有:升高温度、___________ (写出一条)。辉铋矿浸取率随温度的变化曲线如图,高于40℃时浸取率快速下降,其可能的原因是___________

(2)“除铜”时发生反应: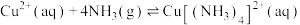
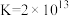 ,则
,则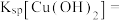
___________ 。
(3)“转化”时,生成 的离子方程式为
的离子方程式为___________ 。
(4)已知酸性环境下, 可以将
可以将 氧化成
氧化成 (
( 被还原成
被还原成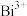 )。可通过一个原电池装置来证明,
)。可通过一个原电池装置来证明,

①请在图中的方框内标出溶液中溶质的化学式__________
②并写出负极的电极反应式:___________ 。
(5)甲同学取NaBiO3产品w g,加入足量稀硫酸和 稀溶液使其完全反应,再用
稀溶液使其完全反应,再用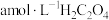 标准溶液滴定生成的
标准溶液滴定生成的 ,当溶液紫红色恰好褪去时,消耗b mL标准溶液。甲同学测得产品的纯度为
,当溶液紫红色恰好褪去时,消耗b mL标准溶液。甲同学测得产品的纯度为___________ (用含w、a、b的代数式表示)。乙同学认为甲同学的测量数据不一定准确,若排除实验仪器和操作的影响因素,还需进行的操作是___________
已知:
 )的化合物广泛应用于电子、医药等领域。由辉铋碎(主要成分为
)的化合物广泛应用于电子、医药等领域。由辉铋碎(主要成分为 ,含
,含 、
、 、
、 等杂质)制备
等杂质)制备 的工艺流程如下:
的工艺流程如下:
已知:ⅰ.
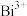 易水解;
易水解; 难溶于冷水。
难溶于冷水。ⅱ.“氧化浸取”时,铋元素转化为
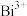 ,硫元素转化为硫单质。
,硫元素转化为硫单质。ⅲ.

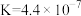
回答下列问题:
(1)为提高“氧化浸取”速率,采取的措施有:升高温度、

(2)“除铜”时发生反应:
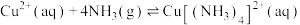
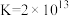 ,则
,则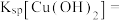
(3)“转化”时,生成
 的离子方程式为
的离子方程式为(4)已知酸性环境下,
 可以将
可以将 氧化成
氧化成 (
( 被还原成
被还原成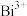 )。可通过一个原电池装置来证明,
)。可通过一个原电池装置来证明,
①请在图中的方框内标出溶液中溶质的化学式
②并写出负极的电极反应式:
(5)甲同学取NaBiO3产品w g,加入足量稀硫酸和
 稀溶液使其完全反应,再用
稀溶液使其完全反应,再用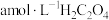 标准溶液滴定生成的
标准溶液滴定生成的 ,当溶液紫红色恰好褪去时,消耗b mL标准溶液。甲同学测得产品的纯度为
,当溶液紫红色恰好褪去时,消耗b mL标准溶液。甲同学测得产品的纯度为已知:

您最近一年使用:0次
3 . 实验小组对硫代硫酸钠( )进行探究。
)进行探究。
Ⅰ.硫代硫酸钠的制备。
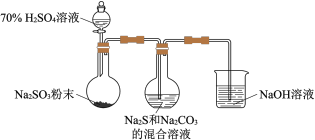
实验室将 通入
通入 和
和 混合溶液中可制得
混合溶液中可制得 ,装置如下图:
,装置如下图:
(1)用化学用语解释 和
和 的混合溶液呈碱性的原因:
的混合溶液呈碱性的原因: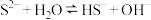 、
、_______ 。
(2)为保证 的产量,实验中通入的
的产量,实验中通入的 不能过量,则理论上
不能过量,则理论上 和
和 的最佳物质的量之比应为
的最佳物质的量之比应为_______ 。
Ⅱ.测定样品纯度。
步骤①:准确称取10.00g产品,溶于蒸馏水配成250.00mL溶液。
步骤②:取25.00mL上述溶液注入锥形瓶,加入2~3滴淀粉溶液,用 标准碘溶液滴定。已知:
标准碘溶液滴定。已知: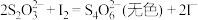 ,回答下列问题:
,回答下列问题:
(3)步骤②中滴定终点的现象为_______ 。
(4)实验数据如表,产品中 的质量分数为
的质量分数为_______ (精确到0.1%)。
(5)下列操作会使样品纯度偏小的是_______ 。
A.读数时,滴定前仰视,滴定后俯视
B.滴定过程中,锥形瓶振荡过于剧烈,有少量溶液溅出
C.滴定管用蒸馏水洗净后,未用标准碘溶液润洗
Ⅲ.小组查阅资料:可视为一个S原子取代了 中的一个О原子。该实验小组运用类比学习的思想预测了的某些性质,并通过实验进行验证。
中的一个О原子。该实验小组运用类比学习的思想预测了的某些性质,并通过实验进行验证。
假设1:从结构角度,与 结构相似,化学性质也相似
结构相似,化学性质也相似
假设2:从化合价角度,与 性质相似
性质相似
(6)实验:用玻璃棒蘸取 溶液点在pH试纸中部,将试纸颜色与标准比色卡对照,发现pH
溶液点在pH试纸中部,将试纸颜色与标准比色卡对照,发现pH_______ 证明假设1不成立;向新制氯水(pH<2)中滴加少量 溶液,观察到
溶液,观察到_______ 证明假设2成立。(反应在25℃下进行)
 )进行探究。
)进行探究。Ⅰ.硫代硫酸钠的制备。
实验室将
 通入
通入 和
和 混合溶液中可制得
混合溶液中可制得 ,装置如下图:
,装置如下图:
(1)用化学用语解释
 和
和 的混合溶液呈碱性的原因:
的混合溶液呈碱性的原因: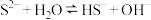 、
、(2)为保证
 的产量,实验中通入的
的产量,实验中通入的 不能过量,则理论上
不能过量,则理论上 和
和 的最佳物质的量之比应为
的最佳物质的量之比应为Ⅱ.测定样品纯度。
步骤①:准确称取10.00g产品,溶于蒸馏水配成250.00mL溶液。
步骤②:取25.00mL上述溶液注入锥形瓶,加入2~3滴淀粉溶液,用
 标准碘溶液滴定。已知:
标准碘溶液滴定。已知: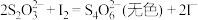 ,回答下列问题:
,回答下列问题:(3)步骤②中滴定终点的现象为
(4)实验数据如表,产品中
 的质量分数为
的质量分数为| 滴定次数 | 滴定前/mL | 滴定后/mL |
| 第一次 | 0.10 | 19.90 |
| 第二次 | 0.25 | 20.25 |
| 第三次 | 0.00 | 20.20 |
A.读数时,滴定前仰视,滴定后俯视
B.滴定过程中,锥形瓶振荡过于剧烈,有少量溶液溅出
C.滴定管用蒸馏水洗净后,未用标准碘溶液润洗
Ⅲ.小组查阅资料:可视为一个S原子取代了
 中的一个О原子。该实验小组运用类比学习的思想预测了的某些性质,并通过实验进行验证。
中的一个О原子。该实验小组运用类比学习的思想预测了的某些性质,并通过实验进行验证。假设1:从结构角度,与
 结构相似,化学性质也相似
结构相似,化学性质也相似假设2:从化合价角度,与
 性质相似
性质相似(6)实验:用玻璃棒蘸取
 溶液点在pH试纸中部,将试纸颜色与标准比色卡对照,发现pH
溶液点在pH试纸中部,将试纸颜色与标准比色卡对照,发现pH 溶液,观察到
溶液,观察到
您最近一年使用:0次
名校
4 . 根据下列实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向含有酚酞的 溶液中加入少量 溶液中加入少量 固体 固体 | 有白色沉淀生成,溶液红色变浅 | 证明 存在水解平衡 存在水解平衡 |
| B | 室温下,用pH试纸测定浓度均为 的NaCN溶液、 的NaCN溶液、 溶液的pH 溶液的pH | NaCN溶液的pH较大 | 酸性: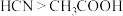 |
| C | 向浓度均为 NaCl和NaI混合溶液中滴加2-3滴 NaCl和NaI混合溶液中滴加2-3滴 溶液 溶液 | 产生黄色沉淀 | 溶度积: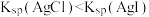 |
| D | 用 盐酸滴定未知浓度NaOH溶液(甲基橙做指示剂) 盐酸滴定未知浓度NaOH溶液(甲基橙做指示剂) | 滴入最后一滴盐酸时,溶液由橙色变红色,且在半分钟内不恢复 | 滴定到达终点 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
5 . 食盐中加 可预防碘缺乏症。某研究小组制取
可预防碘缺乏症。某研究小组制取 并对其纯度进行测定。
并对其纯度进行测定。
Ⅰ.制取 样品
样品
①原理: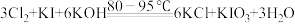
②装置:(C的加热装置已省略)
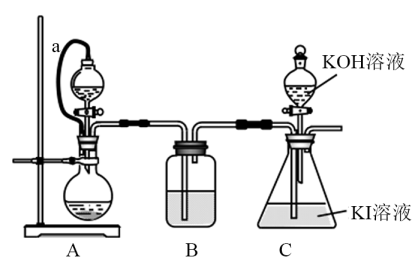
Ⅱ.分离提纯
①取C中溶液,加入浓盐酸,搅拌冷却,过滤,洗涤,得到 粗产品。
粗产品。
②将 粗产品溶于水,加入KOH调pH至中性,得
粗产品溶于水,加入KOH调pH至中性,得 产品。
产品。
回答下列问题:
(1)用装置A制取氯气,可选择的氧化剂有_______。
(2)橡胶管a的作用是_______ ;该装置的设计缺陷是_______ 。
(3)配制一定浓度KI溶液,下列仪器一定不需要的是_______ (填仪器名称)。
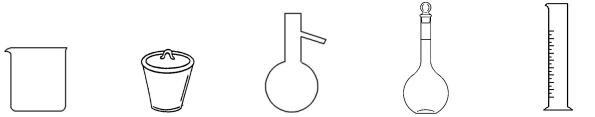
(4)装置C中溶液有KI剩余,加入浓盐酸会导致 产率偏小,原因是
产率偏小,原因是_______ (用离子方程式表示)。
III.测定 产品纯度
产品纯度
a.取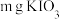 产品配成250mL溶液,取25mL,加稍过量的KI与盐酸溶液,加几滴淀粉指示剂,用
产品配成250mL溶液,取25mL,加稍过量的KI与盐酸溶液,加几滴淀粉指示剂,用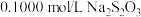 标准液滴定至终点,测得消耗标准液的平均体积为VmL。
标准液滴定至终点,测得消耗标准液的平均体积为VmL。
b.不加 产品,其它操作步骤、所用试剂及用量与步骤a完全相同,测得消耗
产品,其它操作步骤、所用试剂及用量与步骤a完全相同,测得消耗 标准液的平均体积为
标准液的平均体积为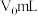 。(已知:
。(已知: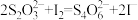 )
)
(5)步骤b的目的是_______ 。
(6)计算该 样品的纯度:
样品的纯度:_______ (填数学表达式)。
(7)某同学为证明食盐中含有 ,请你帮他完成试剂的选择:家用食盐、干海带(含有
,请你帮他完成试剂的选择:家用食盐、干海带(含有 )、
)、___ (限选生活中常用的物质)。
 可预防碘缺乏症。某研究小组制取
可预防碘缺乏症。某研究小组制取 并对其纯度进行测定。
并对其纯度进行测定。Ⅰ.制取
 样品
样品①原理:
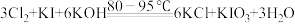
②装置:(C的加热装置已省略)

Ⅱ.分离提纯
①取C中溶液,加入浓盐酸,搅拌冷却,过滤,洗涤,得到
 粗产品。
粗产品。②将
 粗产品溶于水,加入KOH调pH至中性,得
粗产品溶于水,加入KOH调pH至中性,得 产品。
产品。回答下列问题:
(1)用装置A制取氯气,可选择的氧化剂有_______。
| A.高锰酸钾 | B.氯酸钾 | C.二氧化锰 | D.氯化钾 |
(3)配制一定浓度KI溶液,下列仪器一定不需要的是

(4)装置C中溶液有KI剩余,加入浓盐酸会导致
 产率偏小,原因是
产率偏小,原因是III.测定
 产品纯度
产品纯度a.取
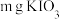 产品配成250mL溶液,取25mL,加稍过量的KI与盐酸溶液,加几滴淀粉指示剂,用
产品配成250mL溶液,取25mL,加稍过量的KI与盐酸溶液,加几滴淀粉指示剂,用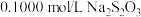 标准液滴定至终点,测得消耗标准液的平均体积为VmL。
标准液滴定至终点,测得消耗标准液的平均体积为VmL。b.不加
 产品,其它操作步骤、所用试剂及用量与步骤a完全相同,测得消耗
产品,其它操作步骤、所用试剂及用量与步骤a完全相同,测得消耗 标准液的平均体积为
标准液的平均体积为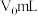 。(已知:
。(已知: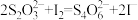 )
)(5)步骤b的目的是
(6)计算该
 样品的纯度:
样品的纯度:(7)某同学为证明食盐中含有
 ,请你帮他完成试剂的选择:家用食盐、干海带(含有
,请你帮他完成试剂的选择:家用食盐、干海带(含有 )、
)、
您最近一年使用:0次
2022-11-03更新
|
1066次组卷
|
3卷引用:福建省龙岩市上杭县第一中学2022-2023学年高三上学期12月月考化学试题
福建省龙岩市上杭县第一中学2022-2023学年高三上学期12月月考化学试题广东省佛山市顺德区普通高中2022-2023学年高三上学期教学质量检测(一)化学试题(已下线)专题七 非金属元素及其化合物-实战高考·二轮复习核心突破
名校
6 . 亚硝酸(HNO2)是一种比醋酸略强的一元弱酸。
(1)设计一种实验方案,证明亚硝酸是弱酸:___________ 。
(2)某化学小组设计以下方法测定亚硝酸溶液浓度。298K时,用0.1000mol/L的NaOH溶液滴定未知浓度的20.00ml HNO2溶液,滴定过程中溶液pH与NaOH溶液体积的关系如图所示:
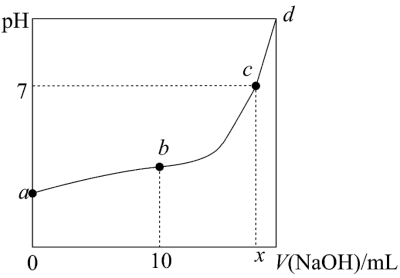
①图中a、b两点水的电离程度;b___________ a(填“>”或者“<”),图中b点离子浓度大小关系:___________ 。
②此滴定实验中选用___________ 为指示剂误差最小。
A.紫色石蕊 B.酚酞 C.甲基橙
③依据以下实验数据,计算c(HNO2)=___________ 。
④以下操作会引起所测溶液浓度偏小的是___________
A.未润洗酸式滴定管
B.碱式滴定管开始时有气泡,滴定终点时无气泡
C.碱式滴定管滴定前平视读数,滴定后俯视读数
(3)HNO2有很强的还原性,也可以用酸性KMnO4滴定HNO2浓度。滴定时,将HNO2溶液装入锥形瓶,用___________ (填“酸式”或“碱式”)滴定管盛装KMnO4标准液进行操作。达到滴定终点的现象是___________ 。
(1)设计一种实验方案,证明亚硝酸是弱酸:
(2)某化学小组设计以下方法测定亚硝酸溶液浓度。298K时,用0.1000mol/L的NaOH溶液滴定未知浓度的20.00ml HNO2溶液,滴定过程中溶液pH与NaOH溶液体积的关系如图所示:

①图中a、b两点水的电离程度;b
②此滴定实验中选用
A.紫色石蕊 B.酚酞 C.甲基橙
③依据以下实验数据,计算c(HNO2)=
| 序号 | 滴定前读数/mL | 滴定终点读数/mL |
| 1 | 0.00 | 19.98 |
| 2 | 1.26 | 23.40 |
| 3 | 1.54 | 21.56 |
A.未润洗酸式滴定管
B.碱式滴定管开始时有气泡,滴定终点时无气泡
C.碱式滴定管滴定前平视读数,滴定后俯视读数
(3)HNO2有很强的还原性,也可以用酸性KMnO4滴定HNO2浓度。滴定时,将HNO2溶液装入锥形瓶,用
您最近一年使用:0次
名校
7 . 下列图示与对应的叙述相符的是
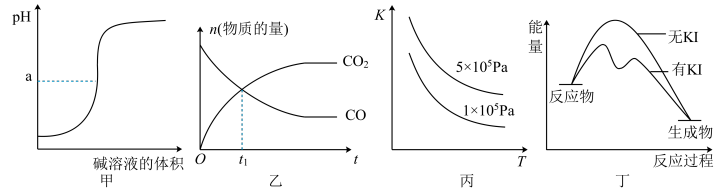

| A.图甲所示,a<7时可表示强酸滴定弱碱的滴定曲线 |
| B.图乙所示,2NO(g)+2CO(g)⇌2CO2(g)+N2(g),t1时刻证明反应达到了平衡状态 |
| C.图丙所示,表示反应2SO2(g)+O2(g)⇌2SO3(g);△H<0的平衡常数K与温度和压强的关系 |
| D.图丁所示,H2O2分解反应过程中,加入KI可加快反应速率,但不改变焓变 |
您最近一年使用:0次
2020-12-10更新
|
378次组卷
|
3卷引用:福建省南安第一中学2021届高三第二次模拟考试化学试题
名校
解题方法
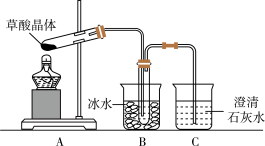
8 . 草酸(乙二酸)存在于自然界的植物中,草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,175℃时分解。
Ⅰ.用硝酸氧化法制备草酸晶体并测定其纯度,制备装置如图所示(加热、固定等装置略去)。
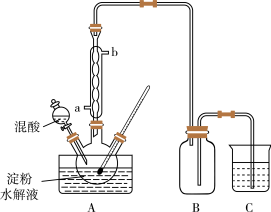
实验步骤如下
①糖化:先将淀粉水解为葡萄糖;
②氧化:在淀粉水解液中加入混酸(质量之比为3:2的65%HNO3与98%H2SO4的混合物),在55~60℃下水浴加热发生反应;
③结晶、蒸发、干燥:反应后溶液经冷却、减压过滤,即得草酸晶体粗产品。
(1)装混酸的仪器名称为________ ;步骤②中,水浴加热的优点为___________________ 。
(2)“②氧化”时发生的主要反应如下,完成下列化学方程式:
___ C6H12O6 + ___ HNO3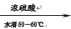
____ +__________ H2C2O4 + 9NO2↑ + 3NO↑+ ______ 。
(3)称取m g草酸晶体粗产品,配成100 mL溶液。取20.00 mL于锥形瓶中,用a moL·L-1KMnO4标准液标定,只发生5H2C2O4 + 2MnO4- + 6H+ = 2Mn2+ + 10CO2↑ + 8H2O反应,消耗KMnO4标准液体积为VmL,则所得草酸晶体(H2C2O4·2H2O)的纯度为___________ 。
Ⅱ.证明草酸晶体分解得到的产物
(4)甲同学选择上述装置验证产物CO2,装置B的主要作用是__________ 。
(5)乙同学认为草酸晶体分解的产物中除了CO2、H2O应该还有CO,为进行验证,选用甲同学实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验。
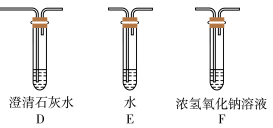
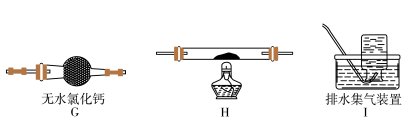
①乙同学的实验装置中,依次连接的合理顺序为A、B、_____________ 。其中装置H反应管中盛有的物质是________________________ 。
②能证明草酸晶体分解产物中有CO的现象是_____________________ 。
Ⅰ.用硝酸氧化法制备草酸晶体并测定其纯度,制备装置如图所示(加热、固定等装置略去)。

实验步骤如下
①糖化:先将淀粉水解为葡萄糖;
②氧化:在淀粉水解液中加入混酸(质量之比为3:2的65%HNO3与98%H2SO4的混合物),在55~60℃下水浴加热发生反应;
③结晶、蒸发、干燥:反应后溶液经冷却、减压过滤,即得草酸晶体粗产品。
(1)装混酸的仪器名称为
(2)“②氧化”时发生的主要反应如下,完成下列化学方程式:
(3)称取m g草酸晶体粗产品,配成100 mL溶液。取20.00 mL于锥形瓶中,用a moL·L-1KMnO4标准液标定,只发生5H2C2O4 + 2MnO4- + 6H+ = 2Mn2+ + 10CO2↑ + 8H2O反应,消耗KMnO4标准液体积为VmL,则所得草酸晶体(H2C2O4·2H2O)的纯度为
Ⅱ.证明草酸晶体分解得到的产物
(4)甲同学选择上述装置验证产物CO2,装置B的主要作用是
(5)乙同学认为草酸晶体分解的产物中除了CO2、H2O应该还有CO,为进行验证,选用甲同学实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验。



①乙同学的实验装置中,依次连接的合理顺序为A、B、
②能证明草酸晶体分解产物中有CO的现象是
您最近一年使用:0次
9 . 焦亚硫酸钠(Na2S2O5)是的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3 + SO2 = Na2S2O5。

⑴ 装置Ⅰ中产生气体的化学方程式为________________________________ ;
⑵ 上图中盛装浓硫酸的玻璃仪器的名称是:__________________________ ;
⑶ 装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为_________ (填序号)。

实验二 焦亚硫酸钠的性质(Na2S2O5溶于水即生成NaHSO3)
⑷ 证明NaHSO3溶液中HSO 的电离程度大于水解程度,可采用的实验方法是
的电离程度大于水解程度,可采用的实验方法是___________ (填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
实验三 葡萄酒中抗氧化剂残留量的测定
⑸ 葡萄酒常用Na2S2O5作抗氧化剂。测定葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:(滴定时反应为SO2 + I2 + 2H2O = H2SO4 + 2HI)

①上述滴定过程中的终点现象为______________________________________ ;
②按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为____________ g·L-1。
实验一 焦亚硫酸钠的制取
采用如图装置(实验前除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3 + SO2 = Na2S2O5。

⑴ 装置Ⅰ中产生气体的化学方程式为
⑵ 上图中盛装浓硫酸的玻璃仪器的名称是:
⑶ 装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为

实验二 焦亚硫酸钠的性质(Na2S2O5溶于水即生成NaHSO3)
⑷ 证明NaHSO3溶液中HSO
 的电离程度大于水解程度,可采用的实验方法是
的电离程度大于水解程度,可采用的实验方法是a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
实验三 葡萄酒中抗氧化剂残留量的测定
⑸ 葡萄酒常用Na2S2O5作抗氧化剂。测定葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:(滴定时反应为SO2 + I2 + 2H2O = H2SO4 + 2HI)

①上述滴定过程中的终点现象为
②按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为
您最近一年使用:0次
10 . 热稳定系数和总氯量是漂白粉行业标准里的两个指标。
Ⅰ.利用如图装置(省略加热装置),探究漂白粉的热分解产物。资料显示:久置于潮湿环境中的漂白粉受热生成的气体产物有O2和少量Cl2。
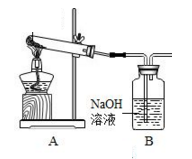
(1)加热干燥漂白粉样品,观察到B中有大量无色气泡产生。则次氯酸钙分解的固体产物中一定有________ 。
(2)加热久置于潮湿环境中的漂白粉样品,观察到B中也有气泡产生。
①B中发生反应的离子方程式为_______ 。
②待充分反应后,断开连接A、B的橡皮管,停止加热,冷却。利用B中产物,通过实验证明加热时有少量氯气生成。请设计实验方案:_________ 。
Ⅱ. 测定漂白粉总氯的百分含量(即样品中氯元素总质量与样品总质量的比值)。实验步骤如下:
①准确称取5.000 g漂白粉样品,研细,加蒸馏水溶解并冷却后,稀释至500 mL。
②移取25.00 mL该试样溶液至锥形瓶中,调节pH,缓慢加入适量3% H2O2水溶液,搅拌至不再产生气泡。加入适量K2CrO4溶液作为指示剂,以0.1000mol/L AgNO3标准溶液滴定至终点。多次实验,测得消耗AgNO3标准溶液平均体积为25.00 mL。(已知:Ksp (AgCl,白色)=1.56×10-10,Ksp (Ag2Cr2O4,砖红色)=9.0×10-12)
(3)步骤①中,溶解、稀释的过程所用的玻璃仪器有烧杯、玻璃棒、____ 、 ____ 。
(4)加入H2O2水溶液,搅拌至不再产生气泡,目的是______ (用离子方程式表示)。
(5)滴定终点的现象是_______ 。
(6)该漂白粉总氯的百分含量为__________ 。
(7)下列操作导致总氯百分含量测定结果偏高的是______ 。
A.指示剂K2CrO4的用量过多
B.在滴定终点读取滴定管刻度时,俯视标准液液面
C.滴定前滴定管尖嘴部分有气泡,滴定后消失
Ⅰ.利用如图装置(省略加热装置),探究漂白粉的热分解产物。资料显示:久置于潮湿环境中的漂白粉受热生成的气体产物有O2和少量Cl2。

(1)加热干燥漂白粉样品,观察到B中有大量无色气泡产生。则次氯酸钙分解的固体产物中一定有
(2)加热久置于潮湿环境中的漂白粉样品,观察到B中也有气泡产生。
①B中发生反应的离子方程式为
②待充分反应后,断开连接A、B的橡皮管,停止加热,冷却。利用B中产物,通过实验证明加热时有少量氯气生成。请设计实验方案:
Ⅱ. 测定漂白粉总氯的百分含量(即样品中氯元素总质量与样品总质量的比值)。实验步骤如下:
①准确称取5.000 g漂白粉样品,研细,加蒸馏水溶解并冷却后,稀释至500 mL。
②移取25.00 mL该试样溶液至锥形瓶中,调节pH,缓慢加入适量3% H2O2水溶液,搅拌至不再产生气泡。加入适量K2CrO4溶液作为指示剂,以0.1000mol/L AgNO3标准溶液滴定至终点。多次实验,测得消耗AgNO3标准溶液平均体积为25.00 mL。(已知:Ksp (AgCl,白色)=1.56×10-10,Ksp (Ag2Cr2O4,砖红色)=9.0×10-12)
(3)步骤①中,溶解、稀释的过程所用的玻璃仪器有烧杯、玻璃棒、
(4)加入H2O2水溶液,搅拌至不再产生气泡,目的是
(5)滴定终点的现象是
(6)该漂白粉总氯的百分含量为
(7)下列操作导致总氯百分含量测定结果偏高的是
A.指示剂K2CrO4的用量过多
B.在滴定终点读取滴定管刻度时,俯视标准液液面
C.滴定前滴定管尖嘴部分有气泡,滴定后消失
您最近一年使用:0次



