解题方法
1 . 三氯乙醛( )是无色油状液体,是制取农药的常用原料。某小组探究制备三氯乙醛的实验装置如图所示(夹持、加热装置均略去)。
)是无色油状液体,是制取农药的常用原料。某小组探究制备三氯乙醛的实验装置如图所示(夹持、加热装置均略去)。
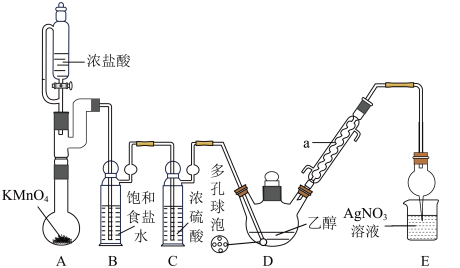
已知:①制备原理: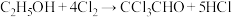 ,(保持70℃左右)
,(保持70℃左右)
②有关物质的性质:
请回答:
(1)仪器a的名称为_______ 。若发现D中导管口处气泡速率过快,合理的解决方法是_______ 。
(2)下列说法不正确的是_______。
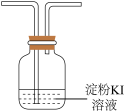
(3)若撤去装置C会导致 产率降低,原因是
产率降低,原因是_______ 。
(4)粗产品纯度的测定:称取5.00g粗产品溶于水配成100mL溶液,量取10.00mL于锥形瓶中,加入25.00mL 碘标准溶液,再加入适量
碘标准溶液,再加入适量 溶液。反应完全后加适量盐酸调节溶液的pH,立即用
溶液。反应完全后加适量盐酸调节溶液的pH,立即用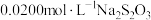 溶液滴定至淡黄色,加入淀粉指示剂,继续滴定至终点。重复上述操作3次,平均消耗
溶液滴定至淡黄色,加入淀粉指示剂,继续滴定至终点。重复上述操作3次,平均消耗 溶液20.00mL。(测定原理:
溶液20.00mL。(测定原理: 、
、 、
、 )
)
①选出正确的滴定操作并排序:检查是否漏水→蒸馏水洗涤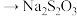 标准溶液润洗滴定管→
标准溶液润洗滴定管→_______ →到达滴定终点,停止滴定,记录读数。
a.调整管中液面至“0”或“0”刻度以下,记录读数
b.调整管中液面,用胶头滴管滴加标准液恰好到“0”刻度
c.锥形瓶放于滴定管下,边滴边摇动锥形瓶,眼睛注视锥形瓶内颜色变化
d.装入标准液至“0”刻度以上2~3mL,固定好滴定管
e.锥形瓶放于滴定管下,边滴边摇动锥形瓶,眼睛注视滴定管内液面变化
f.如图操作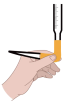 ,排出滴定管尖嘴部分的气泡
,排出滴定管尖嘴部分的气泡
g.如图操作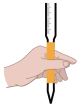 ,排出滴定管尖嘴部分的气泡
,排出滴定管尖嘴部分的气泡
②产品的纯度是_______ %(计算结果保留2位小数)
 )是无色油状液体,是制取农药的常用原料。某小组探究制备三氯乙醛的实验装置如图所示(夹持、加热装置均略去)。
)是无色油状液体,是制取农药的常用原料。某小组探究制备三氯乙醛的实验装置如图所示(夹持、加热装置均略去)。
已知:①制备原理:
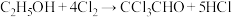 ,(保持70℃左右)
,(保持70℃左右)②有关物质的性质:
| 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度/ | |
| 乙醇 | 46 | -117 | 78.5 | 与水互溶 | 0.789 |
| 三氯乙醛 | 147.5 | -57.5 | 97.8 | 溶于水、乙醇 | 1.51 |
(1)仪器a的名称为
(2)下列说法不正确的是_______。

| A.本实验较合理的加热方式是水浴加热 |
| B.多孔球泡可以增大反应物接触面积,提高反应速率 |
| C.为证明D中产生HCl,需要在D和E之间增加装置(如图) |
| D.反应后的混合物可采用分液操作进一步分离、提纯三氯乙醛 |
 产率降低,原因是
产率降低,原因是(4)粗产品纯度的测定:称取5.00g粗产品溶于水配成100mL溶液,量取10.00mL于锥形瓶中,加入25.00mL
 碘标准溶液,再加入适量
碘标准溶液,再加入适量 溶液。反应完全后加适量盐酸调节溶液的pH,立即用
溶液。反应完全后加适量盐酸调节溶液的pH,立即用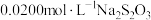 溶液滴定至淡黄色,加入淀粉指示剂,继续滴定至终点。重复上述操作3次,平均消耗
溶液滴定至淡黄色,加入淀粉指示剂,继续滴定至终点。重复上述操作3次,平均消耗 溶液20.00mL。(测定原理:
溶液20.00mL。(测定原理: 、
、 、
、 )
)①选出正确的滴定操作并排序:检查是否漏水→蒸馏水洗涤
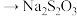 标准溶液润洗滴定管→
标准溶液润洗滴定管→a.调整管中液面至“0”或“0”刻度以下,记录读数
b.调整管中液面,用胶头滴管滴加标准液恰好到“0”刻度
c.锥形瓶放于滴定管下,边滴边摇动锥形瓶,眼睛注视锥形瓶内颜色变化
d.装入标准液至“0”刻度以上2~3mL,固定好滴定管
e.锥形瓶放于滴定管下,边滴边摇动锥形瓶,眼睛注视滴定管内液面变化
f.如图操作
 ,排出滴定管尖嘴部分的气泡
,排出滴定管尖嘴部分的气泡g.如图操作
 ,排出滴定管尖嘴部分的气泡
,排出滴定管尖嘴部分的气泡②产品的纯度是
您最近一年使用:0次
2 . 三草酸合铁酸钾晶体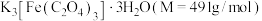 是一种感光剂和高效的污水处理剂。
是一种感光剂和高效的污水处理剂。
I.某研究小组同学查阅资料发现 加热后会分解产生CO和
加热后会分解产生CO和 ,于是设计了如下实验进行验证。
,于是设计了如下实验进行验证。
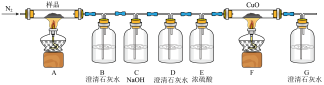
请回答:
(1)C装置中NaOH的作用为___________ 。
(2)证明有CO产生的现象为___________ 。
(3)该装置还存在的缺陷是___________ 。
Ⅱ.制备 的途径如下,请回答下列问题:
的途径如下,请回答下列问题:
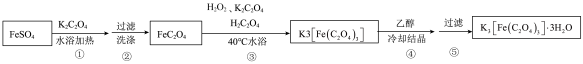
研究小组通过查阅资料得知:
a. 对光敏感,易溶于水,难溶于乙醇;
对光敏感,易溶于水,难溶于乙醇;
b.很多草酸盐(例如 、
、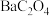 )难溶于水,但能溶解于稀硝酸。
)难溶于水,但能溶解于稀硝酸。
请回答:
(4)步骤③中,控制水浴温度不能超过40℃的原因为___________ 。
(5)研究小组的同学对 组成有两种看法,分别为:
组成有两种看法,分别为:
甲同学: 由
由 、
、 、
、 构成;
构成;
乙同学: 由
由 、
、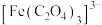 构成。
构成。
请设计实验,验证哪位同学的说法是正确的。___________ 。
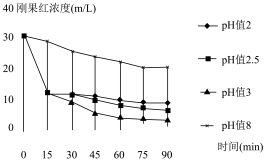
(6) 联合
联合 体系可用于降解染料,一定浓度的该混合溶液,在不同pH条件下降解刚果红的效率如图所示,在实际应用过程中,应选择pH=
体系可用于降解染料,一定浓度的该混合溶液,在不同pH条件下降解刚果红的效率如图所示,在实际应用过程中,应选择pH=___________ 。
(7)关于制备流程,下列说法正确的是___________
(8)制得的 含少量
含少量 ,为测定其纯度,进行如下实验:
,为测定其纯度,进行如下实验:
步骤I:称取5.000g三草酸合铁酸钾晶体,配制成1.000L溶液,固体完全溶解。
步骤Ⅱ:取20.00mL溶液,用 酸性
酸性 溶液滴定至终点,消耗2.46mL。
溶液滴定至终点,消耗2.46mL。
步骤Ⅲ:另取20.00mL溶液,加入过量铜粉,过滤,洗涤,将滤液和洗涤液合并。
步骤Ⅳ:用 酸性
酸性 溶液滴定合并后的溶液至终点,消耗2.86mL。
溶液滴定合并后的溶液至终点,消耗2.86mL。
已知 、
、 与
与 的反应如下:
的反应如下:


研究小组制得的 纯度为
纯度为___________ 。
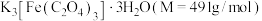 是一种感光剂和高效的污水处理剂。
是一种感光剂和高效的污水处理剂。I.某研究小组同学查阅资料发现
 加热后会分解产生CO和
加热后会分解产生CO和 ,于是设计了如下实验进行验证。
,于是设计了如下实验进行验证。
请回答:
(1)C装置中NaOH的作用为
(2)证明有CO产生的现象为
(3)该装置还存在的缺陷是
Ⅱ.制备
 的途径如下,请回答下列问题:
的途径如下,请回答下列问题:
研究小组通过查阅资料得知:
a.
 对光敏感,易溶于水,难溶于乙醇;
对光敏感,易溶于水,难溶于乙醇;b.很多草酸盐(例如
 、
、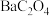 )难溶于水,但能溶解于稀硝酸。
)难溶于水,但能溶解于稀硝酸。请回答:
(4)步骤③中,控制水浴温度不能超过40℃的原因为
(5)研究小组的同学对
 组成有两种看法,分别为:
组成有两种看法,分别为:甲同学:
 由
由 、
、 、
、 构成;
构成;乙同学:
 由
由 、
、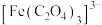 构成。
构成。请设计实验,验证哪位同学的说法是正确的。
(6)
 联合
联合 体系可用于降解染料,一定浓度的该混合溶液,在不同pH条件下降解刚果红的效率如图所示,在实际应用过程中,应选择pH=
体系可用于降解染料,一定浓度的该混合溶液,在不同pH条件下降解刚果红的效率如图所示,在实际应用过程中,应选择pH=
(7)关于制备流程,下列说法正确的是___________
| A.步骤①为复分解反应,步骤③为氧化还原反应 |
B.步骤②判断 是否洗涤干净,可以取少量最后一次洗涤液,加入氯化钡溶液,观察是否有白色沉淀产生 是否洗涤干净,可以取少量最后一次洗涤液,加入氯化钡溶液,观察是否有白色沉淀产生 |
C.步骤④,加入乙醇目的在于降低 的溶解度,使其结晶析出 的溶解度,使其结晶析出 |
| D.步骤④⑤可以在日光下进行 |
 含少量
含少量 ,为测定其纯度,进行如下实验:
,为测定其纯度,进行如下实验:步骤I:称取5.000g三草酸合铁酸钾晶体,配制成1.000L溶液,固体完全溶解。
步骤Ⅱ:取20.00mL溶液,用
 酸性
酸性 溶液滴定至终点,消耗2.46mL。
溶液滴定至终点,消耗2.46mL。步骤Ⅲ:另取20.00mL溶液,加入过量铜粉,过滤,洗涤,将滤液和洗涤液合并。
步骤Ⅳ:用
 酸性
酸性 溶液滴定合并后的溶液至终点,消耗2.86mL。
溶液滴定合并后的溶液至终点,消耗2.86mL。已知
 、
、 与
与 的反应如下:
的反应如下: 

研究小组制得的
 纯度为
纯度为
您最近一年使用:0次
3 . 四氮化四硫(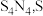 为
为 价)是重要的硫氮二元化合物,室温下为橙黄色固体,难溶于水,能溶于
价)是重要的硫氮二元化合物,室温下为橙黄色固体,难溶于水,能溶于 等有机溶剂,可用
等有机溶剂,可用 与
与 (红棕色液体)反应制备,反应装置如图所示(夹持装置略)。
(红棕色液体)反应制备,反应装置如图所示(夹持装置略)。
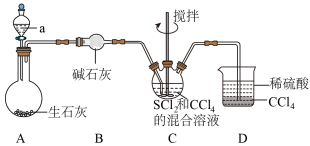
已知:
回答下列问题:
(1)试剂a是___________ 。
(2)装置C中生成 的同时,还生成一种常见固体单质和一种盐,该反应的化学方程式为
的同时,还生成一种常见固体单质和一种盐,该反应的化学方程式为___________ ;证明 反应完全的现象是
反应完全的现象是___________ 。
(3)分离产物后测定产品纯度:
i.蒸氨:取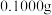 样品加入三颈烧瓶中,再加入足量
样品加入三颈烧瓶中,再加入足量 溶液并加热蒸出的
溶液并加热蒸出的 通入含有
通入含有 标准溶液的锥形瓶中。
标准溶液的锥形瓶中。
ii.滴定:用 溶液滴定剩余的
溶液滴定剩余的 ,消耗
,消耗 溶液。
溶液。
①滴定管的正确操作顺序:检漏 蒸馏水洗涤
蒸馏水洗涤
___________ (填标号) 开始滴定。
开始滴定。
a.装入滴定液至“0”刻度以上 b.调整滴定液液面至“0”刻度
c.排除气泡 d.用滴定液润洗2至3次 e.记录起始读数
② 的纯度表达式为
的纯度表达式为___________ 。
 为
为 价)是重要的硫氮二元化合物,室温下为橙黄色固体,难溶于水,能溶于
价)是重要的硫氮二元化合物,室温下为橙黄色固体,难溶于水,能溶于 等有机溶剂,可用
等有机溶剂,可用 与
与 (红棕色液体)反应制备,反应装置如图所示(夹持装置略)。
(红棕色液体)反应制备,反应装置如图所示(夹持装置略)。
已知:

回答下列问题:
(1)试剂a是
(2)装置C中生成
 的同时,还生成一种常见固体单质和一种盐,该反应的化学方程式为
的同时,还生成一种常见固体单质和一种盐,该反应的化学方程式为 反应完全的现象是
反应完全的现象是(3)分离产物后测定产品纯度:
i.蒸氨:取
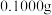 样品加入三颈烧瓶中,再加入足量
样品加入三颈烧瓶中,再加入足量 溶液并加热蒸出的
溶液并加热蒸出的 通入含有
通入含有 标准溶液的锥形瓶中。
标准溶液的锥形瓶中。ii.滴定:用
 溶液滴定剩余的
溶液滴定剩余的 ,消耗
,消耗 溶液。
溶液。①滴定管的正确操作顺序:检漏
 蒸馏水洗涤
蒸馏水洗涤
 开始滴定。
开始滴定。a.装入滴定液至“0”刻度以上 b.调整滴定液液面至“0”刻度
c.排除气泡 d.用滴定液润洗2至3次 e.记录起始读数
②
 的纯度表达式为
的纯度表达式为
您最近一年使用:0次
2024-03-16更新
|
34次组卷
|
2卷引用:浙江省杭州学军中学海创园学校2023-2024学年高二上学期期末考试化学试题
名校
4 . 无水四氯化锡( )常用作媒染剂和部分有机合成的催化剂。某化学兴趣小组利用如图装置(部分加热装置略)制备
)常用作媒染剂和部分有机合成的催化剂。某化学兴趣小组利用如图装置(部分加热装置略)制备 并测定产品中
并测定产品中 含量。
含量。 熔点为-33℃,沸点为114.1℃,在潮湿空气中极易潮解(水解生成
熔点为-33℃,沸点为114.1℃,在潮湿空气中极易潮解(水解生成 ),且熔融Sn与
),且熔融Sn与 反应生成
反应生成 时放出大量的热。
时放出大量的热。
②Sn熔点为232℃,无水 熔点为246℃、沸点为652℃。
熔点为246℃、沸点为652℃。
回答下列问题:
(1)a管的作用是___________ 。
(2)装置B、C中的试剂分别为___________ 、___________ (填名称)。
(3)为了获得较纯的产品,当D处具支试管中___________ 时,再点燃D处酒精灯。反应制得的产品中可能会含有杂质 ,为加快反应速率并防止产品中混有
,为加快反应速率并防止产品中混有 ,除了通入过量
,除了通入过量 外,还应控制反应的最佳温度范围为
外,还应控制反应的最佳温度范围为___________ 。
(4)甲同学欲证明装置A产生的气体中含有HCl,设计如图装置进行实验。___________ 。
(5)碘氧化法滴定分析产品中 的含量。准确称取ag产品于锥形瓶中,用蒸馏水溶解,淀粉溶液做指示剂,用b
的含量。准确称取ag产品于锥形瓶中,用蒸馏水溶解,淀粉溶液做指示剂,用b  碘标准溶液滴定,发生反应:
碘标准溶液滴定,发生反应: 。滴定终点消耗碘标准溶液V mL,则产品中
。滴定终点消耗碘标准溶液V mL,则产品中 的质量分数为
的质量分数为___________ (用含a、b、V的代数式表示)。
 )常用作媒染剂和部分有机合成的催化剂。某化学兴趣小组利用如图装置(部分加热装置略)制备
)常用作媒染剂和部分有机合成的催化剂。某化学兴趣小组利用如图装置(部分加热装置略)制备 并测定产品中
并测定产品中 含量。
含量。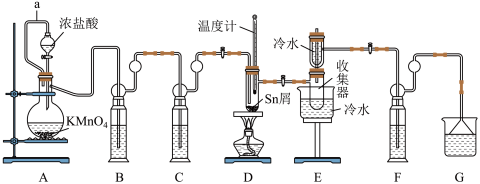
 熔点为-33℃,沸点为114.1℃,在潮湿空气中极易潮解(水解生成
熔点为-33℃,沸点为114.1℃,在潮湿空气中极易潮解(水解生成 ),且熔融Sn与
),且熔融Sn与 反应生成
反应生成 时放出大量的热。
时放出大量的热。②Sn熔点为232℃,无水
 熔点为246℃、沸点为652℃。
熔点为246℃、沸点为652℃。回答下列问题:
(1)a管的作用是
(2)装置B、C中的试剂分别为
(3)为了获得较纯的产品,当D处具支试管中
 ,为加快反应速率并防止产品中混有
,为加快反应速率并防止产品中混有 ,除了通入过量
,除了通入过量 外,还应控制反应的最佳温度范围为
外,还应控制反应的最佳温度范围为(4)甲同学欲证明装置A产生的气体中含有HCl,设计如图装置进行实验。

(5)碘氧化法滴定分析产品中
 的含量。准确称取ag产品于锥形瓶中,用蒸馏水溶解,淀粉溶液做指示剂,用b
的含量。准确称取ag产品于锥形瓶中,用蒸馏水溶解,淀粉溶液做指示剂,用b  碘标准溶液滴定,发生反应:
碘标准溶液滴定,发生反应: 。滴定终点消耗碘标准溶液V mL,则产品中
。滴定终点消耗碘标准溶液V mL,则产品中 的质量分数为
的质量分数为
您最近一年使用:0次
2023-12-05更新
|
255次组卷
|
5卷引用:浙江省宁波市2023-2024学年高二上学期九校联考化学试题
5 . I.某实验小组用酸性KMnO4标准溶液滴定未知浓度的草酸溶液,回答下列问题:
(1)滴定过程中操作滴定管的图示正确的是_______ 。
A. B.
B.  C.
C.
(2)滴定到达终点的判断标志是_______ 。
(3)下列操作可能造成测得草酸溶液浓度偏高的是_______。
II.
(4)如图是验证牺牲阳极的阴极保护法实验装置。在实验过程中可以看到电压表指针有偏移,Fe片上有气泡产生,如何证明Fe电极被保护,不发生反应的实验操作_______ 。

(1)滴定过程中操作滴定管的图示正确的是
A.
 B.
B.  C.
C.
(2)滴定到达终点的判断标志是
(3)下列操作可能造成测得草酸溶液浓度偏高的是_______。
| A.滴定终点读数时俯视 | B.滴定前有气泡,滴定后气泡消失 |
| C.没有润洗锥形瓶 | D.滴定过程中加入少量蒸馏水冲洗瓶壁 |
II.
(4)如图是验证牺牲阳极的阴极保护法实验装置。在实验过程中可以看到电压表指针有偏移,Fe片上有气泡产生,如何证明Fe电极被保护,不发生反应的实验操作

您最近一年使用:0次
6 . 某实验小组制备高铁酸钾(K2FeO4),并探究其性质。
已知:K2FeO4为紫色固体,微溶于KOH溶液中呈紫色溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
Ⅰ.制备K2FeO4(夹持装置略)

(1)装置A为氯气发生装置,装置C中得到紫色固体和溶液。请写出C中由Cl2参加反应生成高铁酸钾的化学方程式___ 。
(2)将装置C中所得混合物进行抽滤,请选择合适的操作并排序___ 。
a.倾析法转移溶液
b.转移固体至漏斗
c.使用玻璃砂漏斗
d.开大抽气装置水龙头
e.关闭抽气装置水龙头
f.断开抽气泵和吸滤瓶之间的橡皮管
g.选择比布氏漏斗内径略小又能将全部小孔盖住的滤纸
h.用蒸馏水润湿滤纸,微开水龙头,使滤纸与漏斗瓷板紧贴
Ⅱ.探究K2FeO4的性质
(3)取装置C中紫色溶液,加入稀硫酸,产生黄绿色气体,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
①用KOH溶液充分洗涤装置C中所得固体
②再用KOH溶液将固体K2FeO4溶出,得到紫色溶液a取少量a,滴加盐酸,有Cl2产生。该方案可证明K2FeO4氧化了Cl-,①中用KOH溶液洗涤的目的是___ 。
(4)资料表明,酸性溶液中的氧化性FeO >MnO
>MnO 。验证实验如下:将溶液a滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象可证明氧化性FeO
。验证实验如下:将溶液a滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象可证明氧化性FeO >MnO
>MnO 。请说明理由
。请说明理由___ 。
Ⅲ.K2FeO4产品纯度的测定
(5)准确称取3.00gK2FeO4样品于锥形瓶中,加入足量KOH溶液和50.00mL0.4200mol•L-1Na3AsO3溶液,充分反应后加入稀硫酸酸化,用0.1000mol•L-1KBrO3标准溶液滴定剩余的Na3AsO3溶液,恰好完全反应时消耗KBrO3标准溶液的体积为20.00mL。(K2FeO4摩尔质量为198gmol•L-1)
已知测定过程中发生的反应有:
FeO +AsO
+AsO +H2O→Fe(OH)3+AsO
+H2O→Fe(OH)3+AsO +OH-(未配平)
+OH-(未配平)
AsO +BrO
+BrO →AsO
→AsO +Br-(未配平)
+Br-(未配平)
样品中K2FeO4的质量分数为___ (保留三位有效数字,杂质不参与化学反应)。
已知:K2FeO4为紫色固体,微溶于KOH溶液中呈紫色溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
Ⅰ.制备K2FeO4(夹持装置略)

(1)装置A为氯气发生装置,装置C中得到紫色固体和溶液。请写出C中由Cl2参加反应生成高铁酸钾的化学方程式
(2)将装置C中所得混合物进行抽滤,请选择合适的操作并排序
a.倾析法转移溶液
b.转移固体至漏斗
c.使用玻璃砂漏斗
d.开大抽气装置水龙头
e.关闭抽气装置水龙头
f.断开抽气泵和吸滤瓶之间的橡皮管
g.选择比布氏漏斗内径略小又能将全部小孔盖住的滤纸
h.用蒸馏水润湿滤纸,微开水龙头,使滤纸与漏斗瓷板紧贴
Ⅱ.探究K2FeO4的性质
(3)取装置C中紫色溶液,加入稀硫酸,产生黄绿色气体,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
①用KOH溶液充分洗涤装置C中所得固体
②再用KOH溶液将固体K2FeO4溶出,得到紫色溶液a取少量a,滴加盐酸,有Cl2产生。该方案可证明K2FeO4氧化了Cl-,①中用KOH溶液洗涤的目的是
(4)资料表明,酸性溶液中的氧化性FeO
 >MnO
>MnO 。验证实验如下:将溶液a滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象可证明氧化性FeO
。验证实验如下:将溶液a滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象可证明氧化性FeO >MnO
>MnO 。请说明理由
。请说明理由Ⅲ.K2FeO4产品纯度的测定
(5)准确称取3.00gK2FeO4样品于锥形瓶中,加入足量KOH溶液和50.00mL0.4200mol•L-1Na3AsO3溶液,充分反应后加入稀硫酸酸化,用0.1000mol•L-1KBrO3标准溶液滴定剩余的Na3AsO3溶液,恰好完全反应时消耗KBrO3标准溶液的体积为20.00mL。(K2FeO4摩尔质量为198gmol•L-1)
已知测定过程中发生的反应有:
FeO
 +AsO
+AsO +H2O→Fe(OH)3+AsO
+H2O→Fe(OH)3+AsO +OH-(未配平)
+OH-(未配平)AsO
 +BrO
+BrO →AsO
→AsO +Br-(未配平)
+Br-(未配平)样品中K2FeO4的质量分数为
您最近一年使用:0次
2022高三·浙江·专题练习
解题方法
7 . 验证反应Fe2++Ag+⇌Ag+Fe3+可逆并测定其K。
实验I:将0.01mol/LAg2SO4溶液与0.04mo/LFeSO4溶液(pH=1)等体积混合,得到灰黑色的沉淀和黄色的溶液。
实验II:将少量Ag粉与0.01mol/LFe2(SO4)3溶液(pH=1)混合,Ag粉完全溶解。
(1)①向实验I所得溶液中加入浓硝酸,证实灰黑色固体是Ag。现象是___________ 。
②实验II使用的是Fe2(SO4)3溶液,而不是Fe(NO3)3溶液,原因是___________ 。使用如下装置从平衡移动的角度进行证明。补全试剂、操作及现象___________ 。
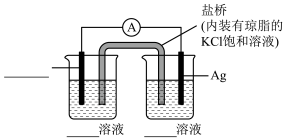
(2)取I中所得上清液VmL。用c1mol/L的KSCN溶液滴定,至溶液变为稳定浅红色时,消耗V1mL。
已知:Ag++SCN-⇌AgSCN,K=1012
Fe3++SCN-⇌FeSCN2+,K=102.3
①溶液中,Fe3+的作用是___________ 。
②反应的平衡常数是___________ 。
(3)①若取实验I所得浊液测定Ag+浓度,所得到的K___________ (填“偏大”、“无影响”、“偏小”)。
②不用实验II所得溶液进行测定并计算K的原因是___________ 。
实验I:将0.01mol/LAg2SO4溶液与0.04mo/LFeSO4溶液(pH=1)等体积混合,得到灰黑色的沉淀和黄色的溶液。
实验II:将少量Ag粉与0.01mol/LFe2(SO4)3溶液(pH=1)混合,Ag粉完全溶解。
(1)①向实验I所得溶液中加入浓硝酸,证实灰黑色固体是Ag。现象是
②实验II使用的是Fe2(SO4)3溶液,而不是Fe(NO3)3溶液,原因是

(2)取I中所得上清液VmL。用c1mol/L的KSCN溶液滴定,至溶液变为稳定浅红色时,消耗V1mL。
已知:Ag++SCN-⇌AgSCN,K=1012
Fe3++SCN-⇌FeSCN2+,K=102.3
①溶液中,Fe3+的作用是
②反应的平衡常数是
(3)①若取实验I所得浊液测定Ag+浓度,所得到的K
②不用实验II所得溶液进行测定并计算K的原因是
您最近一年使用:0次
2019高三·浙江·专题练习
名校
8 . 下列实验的反应原理用离子方程式表示正确的是
A.室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱: +2H2O=NH3·H2O+H3O+ +2H2O=NH3·H2O+H3O+ |
B.用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH−+2H2O=2 +3H2↑ +3H2↑ |
C.用碳酸氢钠溶液检验水杨酸中的羧基: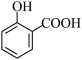 +2 +2 → →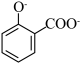 +2H2O+2CO2↑ +2H2O+2CO2↑ |
D.用高锰酸钾标准溶液滴定草酸:2 +16H++5 +16H++5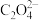 =2Mn2++10CO2↑+8H2O =2Mn2++10CO2↑+8H2O |
您最近一年使用:0次
2019-03-01更新
|
334次组卷
|
5卷引用:考点04 离子反应——备战2019年浙江新高考化学考点
(已下线)考点04 离子反应——备战2019年浙江新高考化学考点2019年秋高三化学复习强化练习—— 离子反应方程式及离子共存四川省遂宁市2020-2021学年高二下学期期末考试化学试题重庆市秀山高级中学校2021-2022学年高三上学期9月月考化学试题吉林省辉南县第六中学2022届高三上学期第一次月考化学试题
9 . 下列实验方法中,不能证明醋酸是弱电解质的是
| A.常温下,测定0.1 mol/LCH3COOH的pH |
| B.常温下,测一定浓度的CH3COONa溶液的pH |
| C.等体积的0.1mol/LHCl和0.1mol/L醋酸溶液,比较中和这两种酸所需等物质的量浓度的NaOH溶液的体积 |
| D.等体积的0.1 mol/LHCl和0.1 mol/L醋酸溶液,分别与等量的颗粒大小相同的Zn反应,观察产生气泡的速率 |
您最近一年使用:0次
2010·北京东城·一模
名校
10 . 氯气是一种重要的化工原料。
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是_________ 。
(2)资料显示:Ca(ClO)2+CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
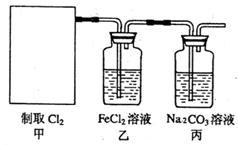
①在该实验中,甲部分的装置是_______ (填字母);
②乙装置中FeCl2溶液与Cl2反应的离子方程式是_______ 。证明FeCl2与Cl2发生了氧化还原反应的实验方法是_________ ;
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、清毒的物质。已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是_____________ ;
④该实验存在明显的缺陷,改进的方法是______________ 。
(3)为测定漂白粉中Ca(ClO)2的质量分数,该小组将2.0g漂白粉配制成250mL溶液,取出25mL并向其中依次加入过量稀H2SO4、过量KI溶液,完全反应后,再滴入0.1mol·L-1Na2S2O3溶液:2Na2S2O3+I2=Na2S4O6+2NaI,共消耗20mLNa2S2O3溶液,则漂白粉中Ca(ClO)2的质量分数为____________ 。
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是
(2)资料显示:Ca(ClO)2+CaCl2+2H2SO4
 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
①在该实验中,甲部分的装置是

②乙装置中FeCl2溶液与Cl2反应的离子方程式是
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、清毒的物质。已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是
④该实验存在明显的缺陷,改进的方法是
(3)为测定漂白粉中Ca(ClO)2的质量分数,该小组将2.0g漂白粉配制成250mL溶液,取出25mL并向其中依次加入过量稀H2SO4、过量KI溶液,完全反应后,再滴入0.1mol·L-1Na2S2O3溶液:2Na2S2O3+I2=Na2S4O6+2NaI,共消耗20mLNa2S2O3溶液,则漂白粉中Ca(ClO)2的质量分数为
您最近一年使用:0次



