名校
解题方法
1 . 近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下列事实中,不能证明氢硫酸是弱酸的是____________ (填字母)。
A.氢硫酸不能与碳酸氢钠溶液反应放出CO2气体
B.Na2S易溶于水且能完全电离:Na2S = 2Na+ + S2-
C.0.1mol/L的氢硫酸的pH为4.5
D.用等浓度的盐酸和氢硫酸做导电实验,盐酸导电性强于氢硫酸
(2)某学生在实验室测定NaHS溶液的pH时,发现溶液呈碱性,则该溶液中各离子浓度的大小顺序为_____________________________________ 。
(3)实验室中有一未知浓度的稀盐酸,某学生在实验室进行0.10 mol·L-1 NaOH标准溶液测定盐酸浓度的实验。请完成下列填空:
①取20.00 mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用___________________ (填仪器名称)装配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下:
②判断滴定达到终点的现象是__________________________________________________________ 。
③根据上述数据,可计算该盐酸的浓度约为____________ mol·L-1(保留两位小数)。
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有______________ (填字母)。
A.酸式滴定管使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.碱式滴定管滴定前读数时俯视读数
D.碱式滴定管滴定终点读数时俯视读数
E.碱式滴定管滴定前尖嘴部分有气泡,滴定后消失
(1)下列事实中,不能证明氢硫酸是弱酸的是
A.氢硫酸不能与碳酸氢钠溶液反应放出CO2气体
B.Na2S易溶于水且能完全电离:Na2S = 2Na+ + S2-
C.0.1mol/L的氢硫酸的pH为4.5
D.用等浓度的盐酸和氢硫酸做导电实验,盐酸导电性强于氢硫酸
(2)某学生在实验室测定NaHS溶液的pH时,发现溶液呈碱性,则该溶液中各离子浓度的大小顺序为
(3)实验室中有一未知浓度的稀盐酸,某学生在实验室进行0.10 mol·L-1 NaOH标准溶液测定盐酸浓度的实验。请完成下列填空:
①取20.00 mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用
| 滴定次数 | 待测盐酸的体积/mL | 标准NaOH溶液体积 | |
| 滴定前的刻度/mL | 滴定后的刻度/mL | ||
| 第一次 | 20.00 | 0.40 | 20.50 |
| 第二次 | 20.00 | 4.10 | 24.00 |
| 第三次 | 20.00 | 1.00 | 24.00 |
③根据上述数据,可计算该盐酸的浓度约为
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有
A.酸式滴定管使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.碱式滴定管滴定前读数时俯视读数
D.碱式滴定管滴定终点读数时俯视读数
E.碱式滴定管滴定前尖嘴部分有气泡,滴定后消失
您最近一年使用:0次
2021-01-26更新
|
147次组卷
|
2卷引用:安徽省合肥六校联盟2020-2021学年高二上学期期末联考化学试题
解题方法
2 . 某研究性学习小组为了探究醋酸的电离情况,进行了如下实验:
(1)取冰醋酸配制250 mL 0.4 mol·L-1的醋酸溶液,用0.4 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
①将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示。则稀释过程中溶液的pH由大到小的顺序______ (填字母)。

②配制250 mL 0.4 mol·L-1 醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和____________ 。
③为标定该醋酸溶液的准确浓度,用0.2000 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
该醋酸溶液的准确浓度为_____________ (保留小数点后四位),上述标定过程中,造成测定结果偏高的原因可能是_______________ (多选、错选不得分)。
a.未用标准液润洗碱式滴定管
b.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
c.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
d.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
(2)该小组同学探究浓度对醋酸电离程度的影响时,用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
①根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是______________________________________________________________ 。
②简述用pH试纸测 0.1mol·L-1 醋酸溶液pH的方法___________ 。
③利用水解理论设计实验证明醋酸的酸性比碳酸的强:______________________ 。
(1)取冰醋酸配制250 mL 0.4 mol·L-1的醋酸溶液,用0.4 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
①将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示。则稀释过程中溶液的pH由大到小的顺序

②配制250 mL 0.4 mol·L-1 醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和
③为标定该醋酸溶液的准确浓度,用0.2000 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
a.未用标准液润洗碱式滴定管
b.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
c.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
d.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
(2)该小组同学探究浓度对醋酸电离程度的影响时,用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
| 醋酸浓度( mol·L-1) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
②简述用pH试纸测 0.1mol·L-1 醋酸溶液pH的方法
③利用水解理论设计实验证明醋酸的酸性比碳酸的强:
您最近一年使用:0次
2017-12-17更新
|
301次组卷
|
4卷引用:安徽省滁州市定远县育才学校2019-2020学年高二上学期期末考试(实验班)化学试题
22-23高三上·山东济宁·开学考试
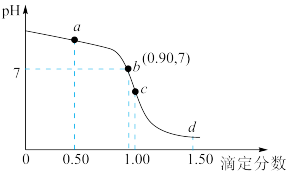
3 .  时,用
时,用 的盐酸滴定
的盐酸滴定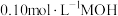 溶液的滴定曲线如图所示(已知:滴定剂与被滴定组分的物质的量之比为滴定分数)。下列说法错误的是
溶液的滴定曲线如图所示(已知:滴定剂与被滴定组分的物质的量之比为滴定分数)。下列说法错误的是
 时,用
时,用 的盐酸滴定
的盐酸滴定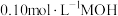 溶液的滴定曲线如图所示(已知:滴定剂与被滴定组分的物质的量之比为滴定分数)。下列说法错误的是
溶液的滴定曲线如图所示(已知:滴定剂与被滴定组分的物质的量之比为滴定分数)。下列说法错误的是
A. 时, 时, 的数量级为 的数量级为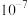 |
B.滴定过程,溶液中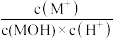 逐渐增大 逐渐增大 |
C.a点溶液中水电离出的 小于 小于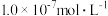 |
D.温度升高,c点溶液的 减小 减小 |
您最近一年使用:0次
4 . 室温下,向20.00mL0.1000mol•L-1盐酸中滴加0.1000mol•L-1NaOH溶液,溶液的pH随NaOH溶液体积的变化如图。已知lg5≈0.7。下列说法不正确的是
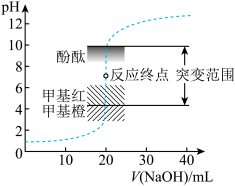
| A.NaOH与盐酸恰好完全反应时,pH=7 |
| B.选择变色范围在pH突变范围内的指示剂,可减小实验误差 |
| C.选择甲基红指示反应终点,误差比甲基橙的大 |
| D.V(NaOH)=30.00mL时,pH≈12.3 |
您最近一年使用:0次
2023-10-21更新
|
853次组卷
|
51卷引用:安徽师范大学附属中学2021-2022学年高二上学期期中考查化学试题
安徽师范大学附属中学2021-2022学年高二上学期期中考查化学试题(已下线)浙江省2020年1月选考(学考)化学试题2020年浙江省高考化学试卷(1月选考)浙江省丽水市松阳县第二中学2019-2020学年高二4月线上教学检测化学试题广东省化州市第一中学2019-2020学年高二4月线上统一测试化学试题江苏省启东中学2020-2021学年高二上学期第一次月考化学试题湖南省怀化市2020-2021学年高二上学期10月联考化学试题(已下线)【浙江新东方】【2020】【高二上】【期中】【HD-LP409】【化学】(已下线)【浙江新东方】99(已下线)小题必刷31 酸碱中和滴定及拓展应用——2021年高考化学一轮复习小题必刷(通用版本)山东省济南市大学城实验高级中学2021届高三1月阶段性考试化学试题(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)广西贵港市覃塘区覃塘高级中学2020-2021学年高二下学期3月月考化学试题浙江省杭州市长征中学2020-2021学年高二下学期第二学期阶段性练习化学试题选择性必修1(SJ)专题3专题培优专练选择性必修1 专题3素养检测(已下线)考点24 水的电离和溶液的酸碱性-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点24 水的电离和溶液的酸碱性-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时41 酸碱中和滴定及拓展应用-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题3.2.2 酸碱中和滴定和pH的计算(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)湖北省麻城市实验高级中学2021-2022学年高二上学期9月月考化学(B卷)试卷内蒙古鄂尔多斯市第一中学2021-2022学年高二上学期第一次月考化学试题(已下线)3.2.2 酸碱中和滴定和pH的计算-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)专题14.水溶液中的离子平衡-十年(2012-2021)高考化学真题分项汇编(浙江专用)浙江省浙北G2(湖州中学、嘉兴一中)2021-2022学年高二上学期期中联考化学试题(已下线)专题25 水的电离和溶液的酸碱性(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练(已下线)专题12 水溶液中的离子平衡-备战2022年高考化学学霸纠错(全国通用)内蒙古霍林郭勒市第一中学2021-2022学年高二上学期期中考试化学试题(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题18 酸碱混合图像为载体考查离子平衡-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)专题4 滴定终点专练(已下线)考点27 水的电离和溶液的pH-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第31练 水的电离和溶液的pH-2023年高考化学一轮复习小题多维练(全国通用)陕西省汉中中学2021-2022学年高二上学期第四次月考化学试题(已下线)第24讲 水的电离和溶液的pH(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第22讲 水的电离与溶液的pH(讲)-2023年高考化学一轮复习讲练测(新教材新高考)湖南省株洲市五雅中学2022-2023学年高二上学期11月期中考试化学试题 广西钦州市2022-2023学年高二上学期第2次教学质量监测化学试卷(已下线)题型133 酸碱中和滴定实验及误差分析(已下线)第八章 水溶液中的离子反应与平衡 第48练 酸碱中和反应及中和滴定上海市华东政法大学附属中学2022-2023学年高二下学期期中考试(等级考)化学试题(已下线)第12讲 酸碱中和滴定和氧化还原反应滴定-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)作业(十六) 酸碱中和滴定(已下线)考点27 水的电离与溶液的pH(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第3讲 酸碱中和滴定河北省衡水市第二中学2023-2024学年高三上学期学科素养评估(三调)化学试题【定心卷】3.2.3 酸碱中和滴定随堂练习-人教版2023-2024学年选择性必修1江苏省无锡市锡东高级中学2023-2024学年高二下学期期中考试化学试题天津市和平区2023-2024学年高三下学期第二次质量调查化学试卷
名校
解题方法
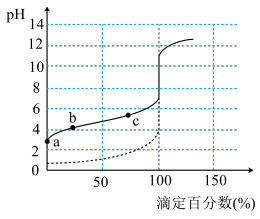
5 . 常温下,用 的
的 溶液分别滴定
溶液分别滴定 的
的 溶液和
溶液和 的醋酸溶液,滴定曲线如下图。下列有关说法正确的是
的醋酸溶液,滴定曲线如下图。下列有关说法正确的是
 的
的 溶液分别滴定
溶液分别滴定 的
的 溶液和
溶液和 的醋酸溶液,滴定曲线如下图。下列有关说法正确的是
的醋酸溶液,滴定曲线如下图。下列有关说法正确的是
| A.实线表示滴定盐酸的曲线 |
| B.酸的强弱是影响突跃范围大小的重要因素 |
C.ab段的离子反应式是 |
| D.两个体系滴定终点的确定都可用甲基橙作指示剂 |
您最近一年使用:0次
2023-04-16更新
|
384次组卷
|
2卷引用:安徽省池州市第一中学、 池州市第六中学、池州市第八中学2022-2023学年高二下学期4月期中联考化学试题
6 . 室温下,用标准液0.01mol·L-1NaOH溶液滴定20.00ml0.01mol·L-1H2C2O4(二元弱酸)溶液,在滴定过程中有关说法正确的是
A.当标准液滴到10.00mL时,溶液中存在[Na+]=[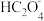 ] ] |
| B.滴定终点时,水电离的氢离子浓度为10-7mol·L-1 |
| C.pH=2的H2C2O4溶液中水电离的[H+]大于0.01mol·L-1NaOH溶液中水电离的[H+] |
D.滴定过程中始终存在[Na+]+[H+]=[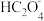 ]+2[ ]+2[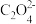 ]+[OH-] ]+[OH-] |
您最近一年使用:0次
2023-04-12更新
|
239次组卷
|
3卷引用:安徽省蚌埠市2022-2023学年高二下学期期末学业水平监测化学试题
22-23高三上·广东茂名·阶段练习
7 . 以酚酞为指示剂,用 的
的 溶液滴定
溶液滴定 未知浓度的二元酸
未知浓度的二元酸 溶液。溶液中,
溶液。溶液中, 、分布分数
、分布分数 随滴加
随滴加 溶液体积
溶液体积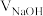 的变化关系如图所示。【比如
的变化关系如图所示。【比如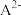 的分布分数:
的分布分数: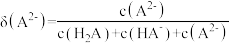 】,下列说法错误的是
】,下列说法错误的是

 的
的 溶液滴定
溶液滴定 未知浓度的二元酸
未知浓度的二元酸 溶液。溶液中,
溶液。溶液中, 、分布分数
、分布分数 随滴加
随滴加 溶液体积
溶液体积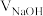 的变化关系如图所示。【比如
的变化关系如图所示。【比如 的分布分数:
的分布分数: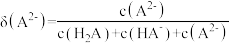 】,下列说法错误的是
】,下列说法错误的是
A.曲线①代表 ,曲线②代表 ,曲线②代表 |
B. 溶液的浓度为 溶液的浓度为 |
C. 的平衡常数为 的平衡常数为 |
D. 时,溶液中 时,溶液中 |
您最近一年使用:0次
名校
解题方法
8 . 常温下,向100mL NaOH溶液中逐滴加入稀硫酸时,溶液的pH随加入稀硫酸体积的变化如图所示。下列说法错误的是
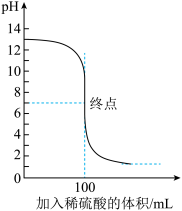

| A.所加稀硫酸的pH为1 |
| B.可以用酚酞作为判断滴定终点的指示剂 |
C.起始NaOH溶液的物质的量浓度为0.1 |
| D.水的电离程度随着稀硫酸的加入逐渐增大 |
您最近一年使用:0次
21-22高二·全国·课时练习
9 . PET( ,M链节=192g•mol-1)可用来生产合成纤维或塑料。测某PET样品的端基中羧基的物质的量,计算其平均聚合度:以酚酞溶液作指示剂,用cmol·L-1NaOH醇溶液滴定mgPET端基中的羧基至终点(现象与水溶液相同),消耗NaOH醇溶液VmL。下列说法不正确的是
,M链节=192g•mol-1)可用来生产合成纤维或塑料。测某PET样品的端基中羧基的物质的量,计算其平均聚合度:以酚酞溶液作指示剂,用cmol·L-1NaOH醇溶液滴定mgPET端基中的羧基至终点(现象与水溶液相同),消耗NaOH醇溶液VmL。下列说法不正确的是
 ,M链节=192g•mol-1)可用来生产合成纤维或塑料。测某PET样品的端基中羧基的物质的量,计算其平均聚合度:以酚酞溶液作指示剂,用cmol·L-1NaOH醇溶液滴定mgPET端基中的羧基至终点(现象与水溶液相同),消耗NaOH醇溶液VmL。下列说法不正确的是
,M链节=192g•mol-1)可用来生产合成纤维或塑料。测某PET样品的端基中羧基的物质的量,计算其平均聚合度:以酚酞溶液作指示剂,用cmol·L-1NaOH醇溶液滴定mgPET端基中的羧基至终点(现象与水溶液相同),消耗NaOH醇溶液VmL。下列说法不正确的是| A.PET可在碱性条件下水解 |
| B.滴定终点时,溶液变为浅红色 |
| C.合成PET的一种单体与乙醇互为同系物 |
D.PET的平均聚合度n为 (忽略端基的摩尔质量) (忽略端基的摩尔质量) |
您最近一年使用:0次
解题方法
10 . 电位滴定是利用溶液电位突变指示终点的滴定法。常温下,用cmol·L-1HCl标准溶液测定VmL未知浓度的Na2CO3溶液,得到滴定过程中溶液电位与V(HCl)的关系如图所示。下列说法不正确的是
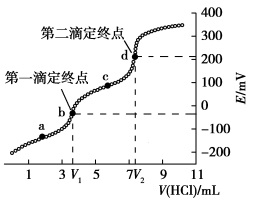

A.滴定过程b至c点对应溶液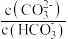 中逐渐减小 中逐渐减小 |
| B.若用稀盐酸滴定稀Na2CO3溶液时用酚酞作指示剂,反应终点为d点 |
C.c点溶液中存在:c(Na+)+c(H+)=c( )+2c( )+2c( )+c(OH-)+c(Cl-) )+c(OH-)+c(Cl-) |
D.原溶液的浓度为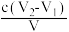 mol•L-1 mol•L-1 |
您最近一年使用:0次



