1 . 过氧化钙遇水放出氧气,且过氧化钙本身无毒,不污染环境,是一种用途广泛的优良供氧剂。以大理石(含有少量氧化亚铁和氧化铁杂质)为原料制备过氧化钙的工艺流程如图所示。

回答下列问题:
(1)为了加快大理石和盐酸的反应速率,可以采取的措施为_______ (写出一点)。
(2)为了验证“滤液M”中是否含有 ,可取少量“滤液M”于试管中,向其中加入
,可取少量“滤液M”于试管中,向其中加入_______ 溶液(填试剂名称),溶液变成血红色,则证明“滤液M”中有 。
。
(3)反应Ⅰ是放热反应,不同浓度的 溶液对反应生成
溶液对反应生成 的产率的影响如图所示,
的产率的影响如图所示, 的浓度大于20%后
的浓度大于20%后 的产率反而下降的原因是
的产率反而下降的原因是_______ 。

(4)制备所得的过氧化钙中常含有CaO杂质,实验室可按以下步骤测定 的质量分数:
的质量分数:
步骤1:准确称取0.3900g过氧化钙样品,置于250mL的锥形瓶中;
步骤2:加入10mL蒸馏水和适当过量的磷酸溶液,振荡使样品完全溶解;
步骤3:用 的酸性
的酸性 溶液滴定至终点,记录数据;
溶液滴定至终点,记录数据;
步骤4:平行测定3次(数据记录见下表),计算试样中 的质量分数。
的质量分数。
已知:上述实验过程中反应关系为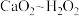 ,
,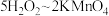 。
。
①滴定时,将酸性 标准液装在如图中的
标准液装在如图中的_______ (填“甲”或“乙”)滴定管中,滴定管用蒸馏水洗涤后,直接加入酸性 标准液进行滴定,则测定的
标准液进行滴定,则测定的 的质量分数会
的质量分数会_______ (填“偏高”“偏低”或“无影响”)。

②在滴定时,眼睛应观察________ 。在锥形瓶下垫一张白纸,其目的是_______ 。
③由表中数据可知,该样品中 的质量分数为
的质量分数为_______ %。(保留整数)
④有一支25mL的酸式滴定管,其中盛有溶液,液面恰好在5.00mL刻度处,现把管内液体全部放出,得到液体的体积_______ 20.00mL(填“大于”“小于”或“等于”)。

回答下列问题:
(1)为了加快大理石和盐酸的反应速率,可以采取的措施为
(2)为了验证“滤液M”中是否含有
 ,可取少量“滤液M”于试管中,向其中加入
,可取少量“滤液M”于试管中,向其中加入 。
。(3)反应Ⅰ是放热反应,不同浓度的
 溶液对反应生成
溶液对反应生成 的产率的影响如图所示,
的产率的影响如图所示, 的浓度大于20%后
的浓度大于20%后 的产率反而下降的原因是
的产率反而下降的原因是
(4)制备所得的过氧化钙中常含有CaO杂质,实验室可按以下步骤测定
 的质量分数:
的质量分数:步骤1:准确称取0.3900g过氧化钙样品,置于250mL的锥形瓶中;
步骤2:加入10mL蒸馏水和适当过量的磷酸溶液,振荡使样品完全溶解;
步骤3:用
 的酸性
的酸性 溶液滴定至终点,记录数据;
溶液滴定至终点,记录数据;步骤4:平行测定3次(数据记录见下表),计算试样中
 的质量分数。
的质量分数。| 实验 | 1 | 2 | 3 |
V(酸性 溶液)/mL 溶液)/mL | 19.50 | 19.48 | 19.52 |
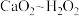 ,
,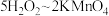 。
。①滴定时,将酸性
 标准液装在如图中的
标准液装在如图中的 标准液进行滴定,则测定的
标准液进行滴定,则测定的 的质量分数会
的质量分数会
②在滴定时,眼睛应观察
③由表中数据可知,该样品中
 的质量分数为
的质量分数为④有一支25mL的酸式滴定管,其中盛有溶液,液面恰好在5.00mL刻度处,现把管内液体全部放出,得到液体的体积
您最近一年使用:0次
2022-11-10更新
|
127次组卷
|
2卷引用:广西北海市2022-2023学年高二上学期期末考试化学试题
2 . 为测定某样品中 含量,取
含量,取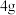 配成
配成 溶液(杂质不溶解),再用该溶液滴定
溶液(杂质不溶解),再用该溶液滴定
 盐酸,并用酚酞作为指示剂。下图是该滴定过程的滴定曲线。下列说法错误的是
盐酸,并用酚酞作为指示剂。下图是该滴定过程的滴定曲线。下列说法错误的是
 含量,取
含量,取 配成
配成 溶液(杂质不溶解),再用该溶液滴定
溶液(杂质不溶解),再用该溶液滴定
 盐酸,并用酚酞作为指示剂。下图是该滴定过程的滴定曲线。下列说法错误的是
盐酸,并用酚酞作为指示剂。下图是该滴定过程的滴定曲线。下列说法错误的是
| A.该反应还可以用甲基橙做指示剂 |
| B.溶液由无色变为浅红色且一段时间不褪色时为滴定终点 |
C.碱式滴定管用蒸馏水洗净后未润洗,则c( )偏大 )偏大 |
| D.NaOH的质量分数为62.5% |
您最近一年使用:0次
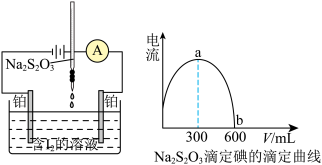
3 . 电流滴定法(电压10~100mV)是根据电流情况判断滴定终点,如图所示,仅 、
、 同时存在时才能产生电流。可用此法来测定
同时存在时才能产生电流。可用此法来测定 溶液的浓度。已知:
溶液的浓度。已知: 。下列说法错误的是
。下列说法错误的是
 、
、 同时存在时才能产生电流。可用此法来测定
同时存在时才能产生电流。可用此法来测定 溶液的浓度。已知:
溶液的浓度。已知: 。下列说法错误的是
。下列说法错误的是
| A.b为滴定终点 |
| B.ab段电流减小是因为离子浓度降低 |
| C.该反应可不用指示剂,电流就可以判断滴定情况 |
D.若碘液中含有38.1 g的 ,硫代硫酸钠溶液的浓度为0.5 mol⋅L ,硫代硫酸钠溶液的浓度为0.5 mol⋅L |
您最近一年使用:0次
4 . 常温常压下,某同学向20.00mLc0mol•L-1氨水中逐滴加入0.1000mol•L-1的盐酸,实验测得溶液的pH随加入盐酸体积的变化如图所示,其中N点为反应终点(此时盐酸与氨水恰好完全反应),此时消耗盐酸的体积为17.20mL。下列说法中正确的是
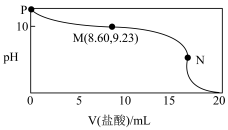

| A.选择甲基橙作指示剂,比选用酚酞作指示剂的误差大 |
B.M点的溶液中存在:c(NH3•H2O)>c(Cl-)>c(NH ) ) |
| C.N点溶液中:c(H+)-c(OH-)<c(Cl-)-c(NH3•H2O) |
| D.P、M、N三点对应溶液中水的电离程度最大的为M点 |
您最近一年使用:0次
5 . 室温下,向20.00mL0.1000mol•L-1盐酸中滴加0.1000mol•L-1NaOH溶液,溶液的pH随NaOH溶液体积的变化如图。已知lg5≈0.7。下列说法不正确的是
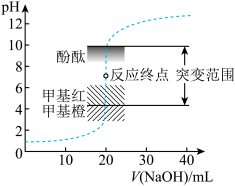
| A.NaOH与盐酸恰好完全反应时,pH=7 |
| B.选择变色范围在pH突变范围内的指示剂,可减小实验误差 |
| C.选择甲基红指示反应终点,误差比甲基橙的大 |
| D.V(NaOH)=30.00mL时,pH≈12.3 |
您最近一年使用:0次
2023-10-21更新
|
853次组卷
|
51卷引用:广西贵港市覃塘区覃塘高级中学2020-2021学年高二下学期3月月考化学试题
广西贵港市覃塘区覃塘高级中学2020-2021学年高二下学期3月月考化学试题 广西钦州市2022-2023学年高二上学期第2次教学质量监测化学试卷(已下线)浙江省2020年1月选考(学考)化学试题2020年浙江省高考化学试卷(1月选考)浙江省丽水市松阳县第二中学2019-2020学年高二4月线上教学检测化学试题广东省化州市第一中学2019-2020学年高二4月线上统一测试化学试题江苏省启东中学2020-2021学年高二上学期第一次月考化学试题湖南省怀化市2020-2021学年高二上学期10月联考化学试题(已下线)【浙江新东方】【2020】【高二上】【期中】【HD-LP409】【化学】(已下线)【浙江新东方】99(已下线)小题必刷31 酸碱中和滴定及拓展应用——2021年高考化学一轮复习小题必刷(通用版本)山东省济南市大学城实验高级中学2021届高三1月阶段性考试化学试题(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)浙江省杭州市长征中学2020-2021学年高二下学期第二学期阶段性练习化学试题选择性必修1(SJ)专题3专题培优专练选择性必修1 专题3素养检测(已下线)考点24 水的电离和溶液的酸碱性-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点24 水的电离和溶液的酸碱性-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时41 酸碱中和滴定及拓展应用-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题3.2.2 酸碱中和滴定和pH的计算(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)湖北省麻城市实验高级中学2021-2022学年高二上学期9月月考化学(B卷)试卷内蒙古鄂尔多斯市第一中学2021-2022学年高二上学期第一次月考化学试题(已下线)3.2.2 酸碱中和滴定和pH的计算-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)专题14.水溶液中的离子平衡-十年(2012-2021)高考化学真题分项汇编(浙江专用)安徽师范大学附属中学2021-2022学年高二上学期期中考查化学试题浙江省浙北G2(湖州中学、嘉兴一中)2021-2022学年高二上学期期中联考化学试题(已下线)专题25 水的电离和溶液的酸碱性(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练(已下线)专题12 水溶液中的离子平衡-备战2022年高考化学学霸纠错(全国通用)内蒙古霍林郭勒市第一中学2021-2022学年高二上学期期中考试化学试题(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题18 酸碱混合图像为载体考查离子平衡-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)专题4 滴定终点专练(已下线)考点27 水的电离和溶液的pH-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第31练 水的电离和溶液的pH-2023年高考化学一轮复习小题多维练(全国通用)陕西省汉中中学2021-2022学年高二上学期第四次月考化学试题(已下线)第24讲 水的电离和溶液的pH(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第22讲 水的电离与溶液的pH(讲)-2023年高考化学一轮复习讲练测(新教材新高考)湖南省株洲市五雅中学2022-2023学年高二上学期11月期中考试化学试题(已下线)题型133 酸碱中和滴定实验及误差分析(已下线)第八章 水溶液中的离子反应与平衡 第48练 酸碱中和反应及中和滴定上海市华东政法大学附属中学2022-2023学年高二下学期期中考试(等级考)化学试题(已下线)第12讲 酸碱中和滴定和氧化还原反应滴定-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)作业(十六) 酸碱中和滴定(已下线)考点27 水的电离与溶液的pH(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第3讲 酸碱中和滴定河北省衡水市第二中学2023-2024学年高三上学期学科素养评估(三调)化学试题【定心卷】3.2.3 酸碱中和滴定随堂练习-人教版2023-2024学年选择性必修1江苏省无锡市锡东高级中学2023-2024学年高二下学期期中考试化学试题天津市和平区2023-2024学年高三下学期第二次质量调查化学试卷
名校
6 . 下列与滴定实验有关的说法中正确的是
| A.用碱式滴定管准确量取20.00mL的高锰酸钾溶液 |
| B.NaOH标准液滴定盐酸,若滴定结束时俯视刻度,会导致测定结果偏高 |
| C.醋酸滴定未知浓度的NaOH溶液时,用甲基橙作指示剂,会导致测定结果偏高 |
D.用 滴定亚硫酸钠溶液时,当最后一滴高锰酸钾标准液滴入锥形瓶中,溶液颜色由无色变为粉红色时,即达滴定终点 滴定亚硫酸钠溶液时,当最后一滴高锰酸钾标准液滴入锥形瓶中,溶液颜色由无色变为粉红色时,即达滴定终点 |
您最近一年使用:0次
2021-05-02更新
|
298次组卷
|
5卷引用:广西钦州市2020-2021学年高二下学期期末考试化学试题
名校
7 . 25℃时,用浓度为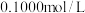 的NaOH溶液滴定体积均是20mL、浓度均为
的NaOH溶液滴定体积均是20mL、浓度均为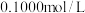 的三种酸HX、HY、HZ,滴定曲线如图所示:
的三种酸HX、HY、HZ,滴定曲线如图所示:

下列说法错误的是
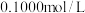 的NaOH溶液滴定体积均是20mL、浓度均为
的NaOH溶液滴定体积均是20mL、浓度均为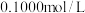 的三种酸HX、HY、HZ,滴定曲线如图所示:
的三种酸HX、HY、HZ,滴定曲线如图所示:
下列说法错误的是
| A.pH=2的HZ溶液加水稀释10倍,pH=3 |
B.酸性强弱顺序是: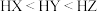 |
| C.加入20mLNaOH溶液时,只有HY溶液达到滴定终点 |
D.加入10mL NaOH溶液时,HY溶液中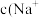 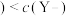 |
您最近一年使用:0次
2020-08-28更新
|
394次组卷
|
2卷引用:广西钦州市第一中学2021届高三8月月考理科综合化学试题
8 . 室温下,将0.100 0 mol·L-1盐酸滴入20.00 mL未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图所示。下列有关说法不 正确的是


| A.该一元碱溶液浓度为0.100 0 mol·L-1 |
| B.A、B、C三点的水溶液导电性依次增强 |
| C.室温下,MOH的电离常数Kb=1×10-5 |
| D.该一元碱溶液浓度为0.00100 0 mol·L-1 |
您最近一年使用:0次
2020-12-29更新
|
65次组卷
|
2卷引用:广西壮族自治区贺州市桂梧高中2020-2021学年高二上学期(12月)第二次月考化学试题
解题方法
9 . 25℃时,用0.1000mol·L-1的盐酸分别滴定20.00mL 0.1000mol·L-1氨水和20.00mL 0.1000mol·L-1 NaOH溶液,滴定曲线如图所示。下列说法不正确的是


| A.25℃,Kb(NH3·H2O)的数量级为10-5 |
B.N点处的溶液中:c(NH )>c(NH3·H2O) )>c(NH3·H2O) |
| C.曲线II滴定终点时所选的指示剂为酚酞 |
| D.Q点所加盐酸的体积为b mL,则b=20 |
您最近一年使用:0次
10 . 用AG表示溶液的酸度,其表达式为AG=lg[ ],298K时,向10mL0.1 mol▪L-1 HX溶液中滴加 0.1mol▪L-1NaOH 溶液。溶液的AG与NaOH溶液体积的关系如图所示。下列说法错误的是 ( )
],298K时,向10mL0.1 mol▪L-1 HX溶液中滴加 0.1mol▪L-1NaOH 溶液。溶液的AG与NaOH溶液体积的关系如图所示。下列说法错误的是 ( )
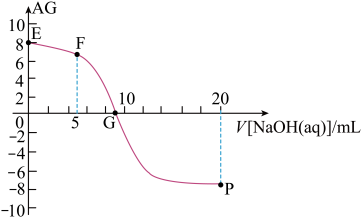
 ],298K时,向10mL0.1 mol▪L-1 HX溶液中滴加 0.1mol▪L-1NaOH 溶液。溶液的AG与NaOH溶液体积的关系如图所示。下列说法错误的是 ( )
],298K时,向10mL0.1 mol▪L-1 HX溶液中滴加 0.1mol▪L-1NaOH 溶液。溶液的AG与NaOH溶液体积的关系如图所示。下列说法错误的是 ( )
| A.溶液pH和AG的关系式为AG=14-2pH |
| B.对G点溶液,c(Na+) = c(X-) |
| C.298K时HX的电离常数Ka≈1.0×10-5 |
| D.溶液中水电离的c(OH-) F点<P点 |
您最近一年使用:0次
2019-12-04更新
|
469次组卷
|
3卷引用:广西柳州市高级中学2020届高三上学期第二次统测理综化学试题



