名校
1 . 下列无法证明某酸HA是弱酸的实验方案是
| A.室温下,测得0.1mol·L-1HA溶液的pH>1,证明HA是弱酸 |
| B.碳酸钠溶液中滴入0.1mol·L-1的HA溶液,产生大量无色气体 |
| C.室温下测得某HA溶液的pH=a,用蒸馏水稀释100倍测得溶液pH=b,且b-a<2 |
| D.室温下,用pH试纸测得0.1mol·L-1 NaA溶液的pH>7 |
您最近一年使用:0次
2018-01-20更新
|
228次组卷
|
3卷引用:黑龙江省大庆中学2017-2018学年高二上学期期末考试化学试题
名校
解题方法
2 . 室温时,将0.10 mol·L-1 NaOH溶液滴入20.00 mL未知浓度的某一元酸HA溶液中,溶液pH随加入NaOH溶液体积的变化曲线如图所示(忽略溶液混合时体积的变化)。当V(NaOH)=20.00 mL(图中c点),二者恰好完全反应。下列有关说法不正确的是

| A.HA为弱酸,其物质的量浓度为0.10 mol·L-1 |
| B.a点时:c(A-)+c(HA)=2c(H+)+2c(OH-) |
| C.c点时:c(Na+)> c(A-) >c(OH-)> c(H+) |
| D.d点时:3c(HA)+3c(A-)=2c(Na+) |
您最近一年使用:0次
2023-09-14更新
|
415次组卷
|
3卷引用:黑龙江省哈尔滨市第一中学校2023-2024学年高二上学期期中考试化学试题
名校
解题方法
3 . 25℃时,用20.00mL NaOH溶液滴定10.00mL
NaOH溶液滴定10.00mL 溶液,加入NaOH溶液的体积、混合溶液中的离子浓度与pH的变化关系如图所示。
溶液,加入NaOH溶液的体积、混合溶液中的离子浓度与pH的变化关系如图所示。

下列说法错误的是
 NaOH溶液滴定10.00mL
NaOH溶液滴定10.00mL 溶液,加入NaOH溶液的体积、混合溶液中的离子浓度与pH的变化关系如图所示。
溶液,加入NaOH溶液的体积、混合溶液中的离子浓度与pH的变化关系如图所示。
下列说法错误的是
A. 表示加入NaOH溶液的体积与pH的变化关系 表示加入NaOH溶液的体积与pH的变化关系 |
B. 的第二步电离常数 的第二步电离常数 的数量级为 的数量级为 |
| C.第二滴定终点可以选择酚酞做指示剂 |
D.M点中 相等 相等 |
您最近一年使用:0次
名校
解题方法
4 . I.某学生用 标准溶液滴定未知浓度盐酸时,选择甲基橙作指示剂。请回答下列问题:
标准溶液滴定未知浓度盐酸时,选择甲基橙作指示剂。请回答下列问题:
(1)若滴定开始和结束时,碱式滴定管中的液面如图1,则消耗 标准液的体积为
标准液的体积为____ mL。

(2)下列有关实验的说法不正确的是_______ 。

A.用酸式滴定管取 稀盐酸放入用蒸馏水洗涤后的锥形瓶中,再滴加几滴甲基橙试液进行滴定
稀盐酸放入用蒸馏水洗涤后的锥形瓶中,再滴加几滴甲基橙试液进行滴定
B.滴定前,锥形瓶和滴定管均须用标准溶液润洗
C.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
D.为除去碱式滴定管底部的气泡,应挤压玻璃球快速放出碱液,最后采用图2中的丙操作使尖嘴处充满碱液
E.滴定前碱式滴定管尖嘴部分有气泡,滴定后气泡消失,测定盐酸的物质的量浓度偏高
F.根据图3中 突变范围,选择甲基橙作指示剂时所产生的误差最小
突变范围,选择甲基橙作指示剂时所产生的误差最小
(3)某学生实验中记录的有关数据如下表:
依据表中数据,计算盐酸的物质的量浓度为_______ 。
II.氧化还原滴定实验与酸碱中和滴定类似。某学生用“间接硝量法”测定含有 晶体的试样纯度(不含与
晶体的试样纯度(不含与 发生反应的氧化性杂质)。过程如下:取
发生反应的氧化性杂质)。过程如下:取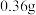 试样溶于水,加入过量
试样溶于水,加入过量 固体,充分反应:
固体,充分反应: 。用
。用 标准溶液滴定:
标准溶液滴定: ,到达滴定终点时,消耗
,到达滴定终点时,消耗 标准溶液
标准溶液 。
。
(4)选用_______ 作滴定指示剂,滴定终点的现象是_______ 。
(5)该试样中 的质量分数为
的质量分数为_______ 。
 标准溶液滴定未知浓度盐酸时,选择甲基橙作指示剂。请回答下列问题:
标准溶液滴定未知浓度盐酸时,选择甲基橙作指示剂。请回答下列问题:(1)若滴定开始和结束时,碱式滴定管中的液面如图1,则消耗
 标准液的体积为
标准液的体积为
(2)下列有关实验的说法不正确的是

A.用酸式滴定管取
 稀盐酸放入用蒸馏水洗涤后的锥形瓶中,再滴加几滴甲基橙试液进行滴定
稀盐酸放入用蒸馏水洗涤后的锥形瓶中,再滴加几滴甲基橙试液进行滴定B.滴定前,锥形瓶和滴定管均须用标准溶液润洗
C.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
D.为除去碱式滴定管底部的气泡,应挤压玻璃球快速放出碱液,最后采用图2中的丙操作使尖嘴处充满碱液
E.滴定前碱式滴定管尖嘴部分有气泡,滴定后气泡消失,测定盐酸的物质的量浓度偏高
F.根据图3中
 突变范围,选择甲基橙作指示剂时所产生的误差最小
突变范围,选择甲基橙作指示剂时所产生的误差最小(3)某学生实验中记录的有关数据如下表:
| 滴定次数 | 待测盐酸体积/mL | 标准 溶液体积 溶液体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 第1次 | 25.00 | 0.00 | 26.11 |
| 第2次 | 25.00 | 1.56 | 29.61 |
| 第3次 | 25.00 | 0.22 | 26.31 |
II.氧化还原滴定实验与酸碱中和滴定类似。某学生用“间接硝量法”测定含有
 晶体的试样纯度(不含与
晶体的试样纯度(不含与 发生反应的氧化性杂质)。过程如下:取
发生反应的氧化性杂质)。过程如下:取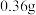 试样溶于水,加入过量
试样溶于水,加入过量 固体,充分反应:
固体,充分反应: 。用
。用 标准溶液滴定:
标准溶液滴定: ,到达滴定终点时,消耗
,到达滴定终点时,消耗 标准溶液
标准溶液 。
。(4)选用
(5)该试样中
 的质量分数为
的质量分数为
您最近一年使用:0次
2023-03-05更新
|
398次组卷
|
2卷引用:黑龙江省哈尔滨师范大学附属中学2022-2023学年高二上学期期末考试化学试题
名校
解题方法
5 . 25℃时,向20.00mL 盐酸中滴加
盐酸中滴加 的NaOH溶液,溶液的pH随NaOH溶液体积的变化如图。已知lg5≈0.7.下列说法错误的是
的NaOH溶液,溶液的pH随NaOH溶液体积的变化如图。已知lg5≈0.7.下列说法错误的是
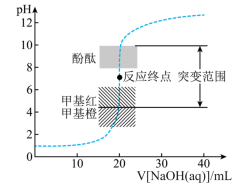
 盐酸中滴加
盐酸中滴加 的NaOH溶液,溶液的pH随NaOH溶液体积的变化如图。已知lg5≈0.7.下列说法错误的是
的NaOH溶液,溶液的pH随NaOH溶液体积的变化如图。已知lg5≈0.7.下列说法错误的是
| A.NaOH与盐酸恰好完全反应时,pH=7 |
| B.当接近终点时,需加快滴定速度便于观察颜色突变 |
| C.选择甲基红指示反应终点,误差比甲基橙的小 |
| D.V[NaOH(aq)]=30.00mL时,pH≈12.3 |
您最近一年使用:0次
2021-12-04更新
|
91次组卷
|
3卷引用:黑龙江省海伦市第一中学2022-2023学年高二上学期11月期中考试化学试题
名校
解题方法
6 . 25℃时,向20mL0.1mol/L 溶液中逐滴加入0.1mo/L NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化关系如图所示。下列说法错误的是
溶液中逐滴加入0.1mo/L NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化关系如图所示。下列说法错误的是

 溶液中逐滴加入0.1mo/L NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化关系如图所示。下列说法错误的是
溶液中逐滴加入0.1mo/L NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化关系如图所示。下列说法错误的是
| A.a点的pH>1 |
| B.c点时,V(NaOH)=20mL |
C.反应过程中 的值逐渐增大 的值逐渐增大 |
| D.a、b、c点溶液中,水的电离程度逐渐增大 |
您最近一年使用:0次
2022-07-10更新
|
1803次组卷
|
9卷引用:黑龙江省鹤岗市第一中学2022-2023学年高二上学期11月期中考试化学试题
黑龙江省鹤岗市第一中学2022-2023学年高二上学期11月期中考试化学试题四川省南充市2021-2022学年高二下学期期末考试化学试题(已下线)3.2.3 酸碱中和滴定-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)甘肃省兰州市第二中学2022-2023学年高二上学期期中考试化学试题吉林省吉林松花江中学2022-2023学年高二上学期1月期末考试化学试题(已下线)考点巩固卷09 水溶液中的离子反应与平衡(4大考点62题)-2024年高考化学一轮复习考点通关卷(新高考通用)宁夏吴忠中学2023-2024学年高二上学期11月期中考试化学试题(已下线)宁夏石嘴山市第三中学2023-2024学年高二上学期11月期中考试化学试题四川省遂宁市射洪中学校2023-2024学年高二上学期10月月考化学试题
名校
7 . 用0.1mol/LNaOH标准溶液滴定20mL等浓度的三元酸H3A,得到pH与V(NaOH)、lgX[X=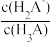 或
或 或
或 ]的关系分别如图1、图2所示。
]的关系分别如图1、图2所示。

下列说法错误的是
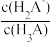 或
或 或
或 ]的关系分别如图1、图2所示。
]的关系分别如图1、图2所示。
下列说法错误的是
A.曲线I表示pH与lg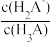 的变化关系 的变化关系 |
| B.由图1知中和Na2HA溶液时,未出现pH突跃 |
C.当体系中溶液的pH=9时, =1.8 =1.8 |
| D.当滴入20mLNaOH溶液时,c(Na+)>c(H2A-)>c(H+)>c(HA2-)>c(OH-) |
您最近一年使用:0次
2021-05-28更新
|
724次组卷
|
6卷引用:黑龙江省大庆铁人中学2021-2022学年高三上学期第二次月考化学试题
黑龙江省大庆铁人中学2021-2022学年高三上学期第二次月考化学试题河北省武邑中学2021届高三二模化学试题河北省石家庄市第二中学2021-2022学年高三上学期10月联考化学试题(已下线)押新高考卷13题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(新高考通版)(已下线)专题21 电解质溶液图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)河南省驻马店高级中学2023-2024学年高二上学期12月测试化学试题
8 . 常温下,向二元弱酸H2A溶液中滴加NaOH溶液,所得混合溶液的pH与离子浓度变化的关系如图所示,下列说法错误的是
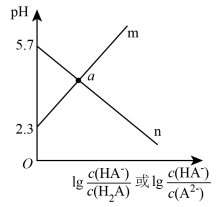

A.曲线n表示pH与lg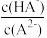 |
| B.Ka1(H2A)=10-2.3 |
| C.交点a的溶液中:c(H2A)>c(A2-) |
| D.NaHA溶液中:c(HA-)>c(A2-)>c(H2A) |
您最近一年使用:0次
2021-09-18更新
|
754次组卷
|
8卷引用:黑龙江省哈尔滨师范大学青冈实验中学2021-2022学年高二10月月考化学试题
名校
9 . t℃时,向20.00mL0.1mol/L二元弱酸H2X溶液中滴入0.1mol/LNaOH溶液,溶液中由水电离出的c水(OH-)的负对数[−lgc水(OH-)]与所加NaOH溶液体积的关系如图所示。下列说法中不正确的是


| A.水的电离程度:P>N=Q>M |
| B.P点溶液中:c(OH-)−c(H+)=c(HX-)+2c(H2X) |
| C.溶液中 c(H2X)/c(X2-):Q>P>N>M |
| D.M点溶液中:c(Na+)>c(HX-)>c(X2-)>c(H2X) |
您最近一年使用:0次
2021-07-13更新
|
336次组卷
|
2卷引用:黑龙江省哈尔滨市尚志中学2022-2023学年高三上学期12月月考化学试题
名校
10 . 以酚酞为指示剂,用0.100 0 mol·L-1的NaOH溶液滴定10.00 mL未知浓度的二元酸H2A溶液,溶液pH和温度随加入NaOH溶液体积的变化曲线如图所示(忽略滴定过程中的热量损失)。下列有关说法正确的是

| A.H2A溶液的浓度为0.200 0 mol·L-1 |
| B.a、c、d三点对应的溶液中,水的电离程度大小关系:d>c>a |
| C.滴定终点时,溶液中c(Na+)>2c(A2-)+c(HA-) |
| D.b点对应的温度下:Ka(HA-)=1.0×10-2 |
您最近一年使用:0次
2022-05-15更新
|
1300次组卷
|
6卷引用:黑龙江省哈尔滨师范大学附属中学2022-2023学年高二上学期期中考试化学试题
黑龙江省哈尔滨师范大学附属中学2022-2023学年高二上学期期中考试化学试题吉林省吉林市普通中学2022届高三第三次调研测试理综化学试题(已下线)专题10水溶液中的离子平衡-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题10水溶液中的离子平衡-2022年高考真题+模拟题汇编(全国卷)(已下线)专题10水溶液中的离子平衡-五年(2018~2022)高考真题汇编(全国卷)江苏省江阴市某校2023-2024学年高二下学期3月学情调研化学试题



