名校
1 . 某小组拟用标准KMnO4溶液滴定某浓度的草酸溶液(装在锥形瓶中),下列有关说法正确的是
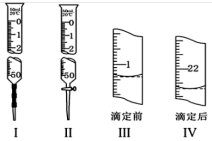

| A.标准KMnO4溶液和草酸溶液分别用滴定管I、Ⅱ盛装或量取 |
| B.检漏后即可将标准KMnO4溶液直接倒入滴定管中 |
| C.达到滴定终点时,溶液颜色由红色变为无色,且30s不变色 |
| D.本次实验消耗标准KMnO4溶液的体积约为21.30mL |
您最近一年使用:0次
解题方法
2 . 25℃下,某同学按图1所示,边用磁力搅拌器搅拌边向20.00mL浓度为 的
的 溶液中逐滴加入0.1000 mol∙L−1的NaOH溶液,用pH传感器和滴数传感器同时测定溶液的pH和所用NaOH溶液的体积。实验测得溶液的pH随NaOH溶液体积的变化如图2所示。其中N点为反应终点,此时消耗NaOH溶液的体积为17.20mL。下列说法中错误的是
溶液中逐滴加入0.1000 mol∙L−1的NaOH溶液,用pH传感器和滴数传感器同时测定溶液的pH和所用NaOH溶液的体积。实验测得溶液的pH随NaOH溶液体积的变化如图2所示。其中N点为反应终点,此时消耗NaOH溶液的体积为17.20mL。下列说法中错误的是

 的
的 溶液中逐滴加入0.1000 mol∙L−1的NaOH溶液,用pH传感器和滴数传感器同时测定溶液的pH和所用NaOH溶液的体积。实验测得溶液的pH随NaOH溶液体积的变化如图2所示。其中N点为反应终点,此时消耗NaOH溶液的体积为17.20mL。下列说法中错误的是
溶液中逐滴加入0.1000 mol∙L−1的NaOH溶液,用pH传感器和滴数传感器同时测定溶液的pH和所用NaOH溶液的体积。实验测得溶液的pH随NaOH溶液体积的变化如图2所示。其中N点为反应终点,此时消耗NaOH溶液的体积为17.20mL。下列说法中错误的是
| A.选择酚酞指示反应终点,误差比甲基橙的小 |
| B.N点溶液中:c(Na+)>c(CH3COO-) >c(OH-) >c(H+) |
| C.M点溶液中:c(CH3COOH) >c(Na+)>c(CH3COO-) |
| D.水的电离程度:N>M>P |
您最近一年使用:0次
名校
3 . 室温下,向20.00mL0.1000mol/L盐酸中逐滴滴加0.1000mol/L的NaOH溶液,pH变化如图所示。已知lg5=0.7,下列说法错误的是
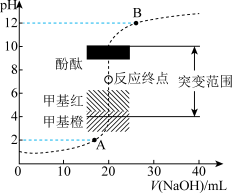

| A.溶液中水的电离程度:B=A |
| B.滴定开始时溶液的pH=1,滴定终点时溶液的pH=7 |
| C.当V(NaOH)=30.00mL时,溶液的pH=12.3 |
| D.酚酞、甲基橙和甲基红均可以作为滴定指示剂 |
您最近一年使用:0次
2022-01-20更新
|
302次组卷
|
3卷引用:云南省昆明市第一中学2023-2024学年高二上学期期中化学试题
名校
4 . 室温下用 溶液分别滴定20.00mL浓度均为
溶液分别滴定20.00mL浓度均为 的HA,HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH溶液体积的变化如图所示(溶液体积变化忽略不计)。下列说法不正确的是
的HA,HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH溶液体积的变化如图所示(溶液体积变化忽略不计)。下列说法不正确的是
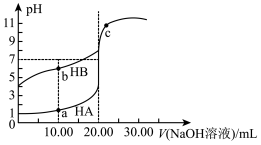
 溶液分别滴定20.00mL浓度均为
溶液分别滴定20.00mL浓度均为 的HA,HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH溶液体积的变化如图所示(溶液体积变化忽略不计)。下列说法不正确的是
的HA,HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH溶液体积的变化如图所示(溶液体积变化忽略不计)。下列说法不正确的是
| A.导电能力:a点溶液>b点溶液 |
B.b点溶液中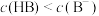 |
C.a点溶液中由水电离出的 约为 约为 |
D.HA对应曲线上c点溶液呈碱性因是 |
您最近一年使用:0次
2022-03-05更新
|
648次组卷
|
5卷引用:云南省腾冲市第八中学2022-2023学年高二下学期第三次月考化学试题
云南省腾冲市第八中学2022-2023学年高二下学期第三次月考化学试题天津市市区重点中学2022届高三一模联考化学试题(已下线)押新高考卷13题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(新高考通版)辽宁省葫芦岛市2022届高三第二次模拟考试化学试题宁夏回族自治区银川一中2022-2023学年高二上学期期中考试化学试题
名校
5 . 25℃时,用0.1mol·L−1NaOH溶液滴定20mL0.1mol·L−1HX溶液,溶液的pH随加入的NaOH溶液体积的变化如图所示。下列说法错误的是
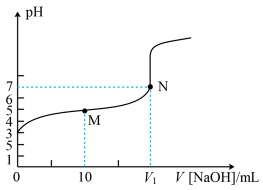

| A.HX的Ka约为1×10−5 |
| B.V1 < 20 |
| C.M点溶液中c(HX)+c(H+)= c(OH-)+c(X−) |
| D.V(NaOH)=20mL时,溶液中c(Na+)>c(X−)>c(OH−)>c(H+) |
您最近一年使用:0次
2021-07-14更新
|
379次组卷
|
2卷引用:云南省云天化中学2022届高三摸底测试化学试题
名校
6 . 电位滴定法是根据滴定过程中指示电极电位的变化来确定滴定终点的一种滴定分析方法。在化学计量点附近,被测离子浓度产生突跃,指示电极电位(ERC)也产生了突跃,进而确定滴定终点的位置。现利用盐酸滴定某溶液中碳酸钠的含量,其电位滴定曲线如图所示。下列说法错误的是
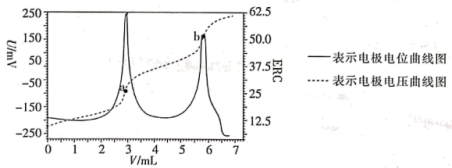

| A.根据图象可知,该滴定过程中不需滴加指示剂 |
B.a点溶液中存在: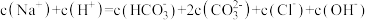 |
| C.b点溶液中溶质为NaCl,此时溶液一定呈中性 |
| D.从a点到b点的过程中,水的电离程度逐渐减小 |
您最近一年使用:0次
2021-07-15更新
|
658次组卷
|
5卷引用:云南省部分名校2020-2021学年高二下学期期末联考化学试题
云南省部分名校2020-2021学年高二下学期期末联考化学试题河南省2020-2021学年高二下学期期末考试化学试题贵州省黔西南州2020-2021学年高二下学期期末检测理科化学试题(已下线)必考点07 盐类的水解-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)四川省宜宾市第四中学校2022-2023学年高二下学期6月期末化学试题
名校
解题方法
7 . 常温下,将0.1 mol/L的NaOH溶液逐滴滴入20 mL0.1 mol/L的CH3COOH溶液中,所得溶液pH变化如图所示,下列有关说法正确的是( )
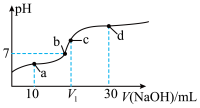

| A.a点:c(CH3COOH)>c(CH3COO-) |
| B.b点为滴定终点 |
| C.若V1=20,则c点处水的电离程度最大 |
| D.d点:c(CH3COO-)+2c(CH3COOH)=2c(OH-)-2c(H+) |
您最近一年使用:0次
2020-03-20更新
|
301次组卷
|
3卷引用:云南省大理州祥云四中2020届高三下学期3月线上模拟考试理综化学试题
名校
解题方法
8 . 25℃时,进行下图所示滴定并得到对应曲线。下列说法错误的是


| A.Ka2(H2C2O4)=10-4.19 |
B.直线Ⅰ中X=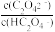 |
| C.在NaHC2O4溶液中c(H2C2O4)+c(H+)=c(OH-)+c(C2O42-) |
| D.Ⅰ、Ⅱ两条直线的斜率均为1 |
您最近一年使用:0次
2020-01-12更新
|
771次组卷
|
3卷引用:云南省丘北县第一中学校2021-2022学年高二下学期开学考试化学试题
9 . 用AG表示溶液的酸度,其表达式为AG=lg[ ],298K时,向10mL0.1 mol▪L-1 HX溶液中滴加 0.1mol▪L-1NaOH 溶液。溶液的AG与NaOH溶液体积的关系如图所示。下列说法错误的是 ( )
],298K时,向10mL0.1 mol▪L-1 HX溶液中滴加 0.1mol▪L-1NaOH 溶液。溶液的AG与NaOH溶液体积的关系如图所示。下列说法错误的是 ( )
 ],298K时,向10mL0.1 mol▪L-1 HX溶液中滴加 0.1mol▪L-1NaOH 溶液。溶液的AG与NaOH溶液体积的关系如图所示。下列说法错误的是 ( )
],298K时,向10mL0.1 mol▪L-1 HX溶液中滴加 0.1mol▪L-1NaOH 溶液。溶液的AG与NaOH溶液体积的关系如图所示。下列说法错误的是 ( )
| A.溶液pH和AG的关系式为AG=14-2pH |
| B.对G点溶液,c(Na+) = c(X-) |
| C.298K时HX的电离常数Ka≈1.0×10-5 |
| D.溶液中水电离的c(OH-) F点<P点 |
您最近一年使用:0次
2019-12-04更新
|
469次组卷
|
3卷引用:云南省曲靖市陆良县2020届高三上学期第二次适应性考试化学试题
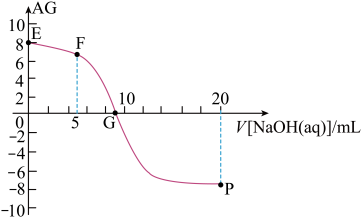
10 . I.无水MgBr2可用作催化剂,实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图所示(夹持装置省略)。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性
②MgBr2+3C2H5OC2H5 MgBr2·3C2H5OC2H5。
MgBr2·3C2H5OC2H5。
主要步骤如下:
步骤1:三颈烧瓶中装入10g镁屑和150mL无水乙醚;装置C中加入15mL液溴;
步骤2:缓慢通入干燥的氩气,直至溴完全导入三颈烧瓶中;
步骤3:反应完毕后恢复至室温,过滤除去镁,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品;
步骤4:常温下用CCl4溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
请回答下列问题
⑴仪器A的名称是___________ 。B的作用为___________ 。
⑵下列有关步骤4的说法正确的是___________ (填选项字母)
A.可用75%的乙醇代替CCl4溶解粗品
B.加热至160℃的主要目的是除去CCl4
C.洗涤晶体可选用0℃的CCl4
D.该步骤只除去了可能残留的溴
⑶若将装置C改为装置D,可能会导致的后果是___________ 。
⑷为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,以铬黑T(简写为In)为指示剂。已知Mg2+与铬黑T和EDTA均能形成配合物,且EDTA与Mg2+配合更稳定:
反应的离子方程式为Mg2++Y4-=MgY2-
①滴定终点的现象为______________________ 。
②测定前,先称取0.2500g无水MgBr2产品,溶解后,加入2滴铬黑T试液作指示剂,用0.0500mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50mL,则测得无水MgBr2产品的纯度是_______________ (用质量分数表示)。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性
②MgBr2+3C2H5OC2H5
 MgBr2·3C2H5OC2H5。
MgBr2·3C2H5OC2H5。
主要步骤如下:
步骤1:三颈烧瓶中装入10g镁屑和150mL无水乙醚;装置C中加入15mL液溴;
步骤2:缓慢通入干燥的氩气,直至溴完全导入三颈烧瓶中;
步骤3:反应完毕后恢复至室温,过滤除去镁,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品;
步骤4:常温下用CCl4溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
请回答下列问题
⑴仪器A的名称是
⑵下列有关步骤4的说法正确的是
A.可用75%的乙醇代替CCl4溶解粗品
B.加热至160℃的主要目的是除去CCl4
C.洗涤晶体可选用0℃的CCl4
D.该步骤只除去了可能残留的溴
⑶若将装置C改为装置D,可能会导致的后果是
⑷为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,以铬黑T(简写为In)为指示剂。已知Mg2+与铬黑T和EDTA均能形成配合物,且EDTA与Mg2+配合更稳定:
| 物质 | 颜色 | 物质 | 颜色 |
| Y4- | 无色 | MgY2- | 无色 |
| In | 纯蓝色 | MgIn- | 酒红色 |
①滴定终点的现象为
②测定前,先称取0.2500g无水MgBr2产品,溶解后,加入2滴铬黑T试液作指示剂,用0.0500mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50mL,则测得无水MgBr2产品的纯度是
您最近一年使用:0次



