名校
解题方法
1 . 常温下,向20mL0.1mol/L一元碱MOH溶液中滴加等浓度的一元酸HX溶液,滴定过程中溶液pH值的变化曲线如下图所示,已知4<m<6,下列说法不正确的是

| A.该滴定过程中应选用酚酞作指示剂 | B.一元酸HX的Ka=5×10-5 |
| C.溶液中水的电离程度:b>c>a | D.c点溶液中:c(M+)>c(X-)>c(H+)>c(OH-) |
您最近一年使用:0次
2024-01-15更新
|
340次组卷
|
4卷引用:湖南省常德市第一中学2023-2024学年高二上学期期末考试化学试题
湖南省常德市第一中学2023-2024学年高二上学期期末考试化学试题广东省梅州市大埔县虎山中学2023-2024学年高二下学期4月期中考试化学试题2024届陕西省宝鸡市高考模拟监测(一) 理科综合试题(已下线)专题07 水溶液中的离子反应与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
名校
解题方法
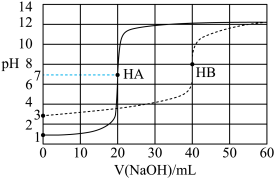
2 . 25℃时,等体积两种一元酸HA和HB分别用等浓度的 溶液滴定,滴定曲线如图所示。下列说法正确的是
溶液滴定,滴定曲线如图所示。下列说法正确的是
 溶液滴定,滴定曲线如图所示。下列说法正确的是
溶液滴定,滴定曲线如图所示。下列说法正确的是
| A.酸性:HA<HB |
| B.酸HB的电离度约为0.5% |
C.起始浓度: , , |
D.用 溶液滴定HB可用甲基橙作指示剂 溶液滴定HB可用甲基橙作指示剂 |
您最近一年使用:0次
2023-10-28更新
|
1199次组卷
|
8卷引用:湖南省长沙市实验中学2023-2024学年高二上学期期中考试化学试题
2020·浙江·模拟预测
3 . 室温下,向20.00mL0.1000mol•L-1盐酸中滴加0.1000mol•L-1NaOH溶液,溶液的pH随NaOH溶液体积的变化如图。已知lg5≈0.7。下列说法不正确的是
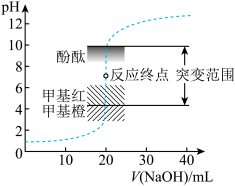
| A.NaOH与盐酸恰好完全反应时,pH=7 |
| B.选择变色范围在pH突变范围内的指示剂,可减小实验误差 |
| C.选择甲基红指示反应终点,误差比甲基橙的大 |
| D.V(NaOH)=30.00mL时,pH≈12.3 |
您最近一年使用:0次
2023-10-21更新
|
880次组卷
|
51卷引用:湖南省怀化市2020-2021学年高二上学期10月联考化学试题
湖南省怀化市2020-2021学年高二上学期10月联考化学试题湖南省株洲市五雅中学2022-2023学年高二上学期11月期中考试化学试题浙江省丽水市松阳县第二中学2019-2020学年高二4月线上教学检测化学试题广东省化州市第一中学2019-2020学年高二4月线上统一测试化学试题江苏省启东中学2020-2021学年高二上学期第一次月考化学试题(已下线)【浙江新东方】【2020】【高二上】【期中】【HD-LP409】【化学】(已下线)【浙江新东方】99广西贵港市覃塘区覃塘高级中学2020-2021学年高二下学期3月月考化学试题浙江省杭州市长征中学2020-2021学年高二下学期第二学期阶段性练习化学试题选择性必修1(SJ)专题3专题培优专练选择性必修1 专题3素养检测(已下线)专题3.2.2 酸碱中和滴定和pH的计算(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)湖北省麻城市实验高级中学2021-2022学年高二上学期9月月考化学(B卷)试卷内蒙古鄂尔多斯市第一中学2021-2022学年高二上学期第一次月考化学试题(已下线)3.2.2 酸碱中和滴定和pH的计算-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)安徽师范大学附属中学2021-2022学年高二上学期期中考查化学试题浙江省浙北G2(湖州中学、嘉兴一中)2021-2022学年高二上学期期中联考化学试题内蒙古霍林郭勒市第一中学2021-2022学年高二上学期期中考试化学试题陕西省汉中中学2021-2022学年高二上学期第四次月考化学试题 广西钦州市2022-2023学年高二上学期第2次教学质量监测化学试卷上海市华东政法大学附属中学2022-2023学年高二下学期期中考试(等级考)化学试题(已下线)第12讲 酸碱中和滴定和氧化还原反应滴定-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)作业(十六) 酸碱中和滴定【定心卷】3.2.3 酸碱中和滴定随堂练习-人教版2023-2024学年选择性必修1江苏省无锡市锡东高级中学2023-2024学年高二下学期期中考试化学试题(已下线)浙江省2020年1月选考(学考)化学试题2020年浙江省高考化学试卷(1月选考)(已下线)小题必刷31 酸碱中和滴定及拓展应用——2021年高考化学一轮复习小题必刷(通用版本)山东省济南市大学城实验高级中学2021届高三1月阶段性考试化学试题(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)考点24 水的电离和溶液的酸碱性-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点24 水的电离和溶液的酸碱性-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时41 酸碱中和滴定及拓展应用-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题14.水溶液中的离子平衡-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)专题25 水的电离和溶液的酸碱性(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练(已下线)专题12 水溶液中的离子平衡-备战2022年高考化学学霸纠错(全国通用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题18 酸碱混合图像为载体考查离子平衡-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)专题4 滴定终点专练(已下线)考点27 水的电离和溶液的pH-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第31练 水的电离和溶液的pH-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第24讲 水的电离和溶液的pH(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第22讲 水的电离与溶液的pH(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)题型133 酸碱中和滴定实验及误差分析(已下线)第八章 水溶液中的离子反应与平衡 第48练 酸碱中和反应及中和滴定(已下线)考点27 水的电离与溶液的pH(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第3讲 酸碱中和滴定河北省衡水市第二中学2023-2024学年高三上学期学科素养评估(三调)化学试题天津市和平区2023-2024学年高三下学期第二次质量调查化学试卷
4 . 下列实验方案能达到实验目的的是
选项 | 实验目的 | 实验方案 |
A | 探究葡萄糖的还原性 | 在一支试管中先加入2mL10%NaOH溶液,滴入5滴 溶液,再加入2mL10%葡萄糖溶液,加热,观察实验现象 溶液,再加入2mL10%葡萄糖溶液,加热,观察实验现象 |
B | 探究过氧化氢能否将亚硫酸盐氧化 | 向过氧化氢和氯化钡混合液中滴加亚硫酸钠溶液,观察是否产生白色沉淀 |
C | 验证草酸为二元弱酸 | 用0.1mol/LNaOH标准溶液滴定等浓度草酸溶液,使用酚酞作指示剂,到达滴定终点时消耗NaOH的体积为草酸的2倍 |
D | 探究水解程度: | 用pH计分别测定饱和 和 和 溶液的pH,前者pH大 溶液的pH,前者pH大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
5 . 某水样中含一定浓度的 和其它不与酸碱反应的离子。取
和其它不与酸碱反应的离子。取 水样,用
水样,用 盐酸进行滴定,溶液
盐酸进行滴定,溶液 随滴加盐酸体积
随滴加盐酸体积 的变化关系如图(混合后浴液体积变化忽略不计)。下列说法正确的是
的变化关系如图(混合后浴液体积变化忽略不计)。下列说法正确的是
 和其它不与酸碱反应的离子。取
和其它不与酸碱反应的离子。取 水样,用
水样,用 盐酸进行滴定,溶液
盐酸进行滴定,溶液 随滴加盐酸体积
随滴加盐酸体积 的变化关系如图(混合后浴液体积变化忽略不计)。下列说法正确的是
的变化关系如图(混合后浴液体积变化忽略不计)。下列说法正确的是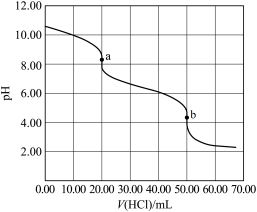
A.该水样中 |
B.在整个滴定过程中可能存在以下等量关系 |
C.滴加盐酸 过程中,溶液中 过程中,溶液中 明显增大 明显增大 |
| D.滴定分析时,a点可使用甲基橙作指示剂指示滴定终点 |
您最近一年使用:0次
名校
6 . 氧化还原滴定实验与中和滴定原理相似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之),也是分析化学中常用的分析手段。
I.用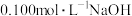 溶液滴定
溶液滴定 浓度约为0.100mol/L
浓度约为0.100mol/L 溶液。
溶液。
(1)该酸碱中和滴定实验最好选用_______ (填标号)作指示剂。
A.酚酞 B.石蕊 C.甲基橙
(2)实验所用仪器如下图所示。仪器A盛装_______ (填“ ”或“
”或“ ”)溶液。
”)溶液。

(3)若滴定开始和结束时,盛装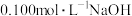 溶液的滴定管中的液面如图所示,终点读数为
溶液的滴定管中的液面如图所示,终点读数为_______  。
。

II.用氧化还原滴定方法测定粗品中 的质量分数。
的质量分数。
实验步骤:称取 粗品配制
粗品配制 的溶液待用。用酸式滴定管取
的溶液待用。用酸式滴定管取 溶液于锥形瓶中,然后加入过量的KI溶液并酸化,加几滴淀粉溶液,立即用配制的
溶液于锥形瓶中,然后加入过量的KI溶液并酸化,加几滴淀粉溶液,立即用配制的 溶液滴定至终点(反应为
溶液滴定至终点(反应为 ),消耗
),消耗 溶液
溶液 。回答下列问题:
。回答下列问题:
(4)向 溶液中加入过量的
溶液中加入过量的 溶液并酸化,
溶液并酸化, 被还原成
被还原成 ,写出该反应的离子方程式:
,写出该反应的离子方程式:_______ 。
(5)用 溶液滴定至终点的现象为
溶液滴定至终点的现象为_______ 。
(6)粗品中 的质量分数为
的质量分数为_______ 。
(7)若在取 溶液时有部分溶液滴到了锥形瓶外。则测定结果
溶液时有部分溶液滴到了锥形瓶外。则测定结果_______ (填“偏高”“偏低”或“不变”)
I.用
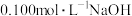 溶液滴定
溶液滴定 浓度约为0.100mol/L
浓度约为0.100mol/L 溶液。
溶液。(1)该酸碱中和滴定实验最好选用
A.酚酞 B.石蕊 C.甲基橙
(2)实验所用仪器如下图所示。仪器A盛装
 ”或“
”或“ ”)溶液。
”)溶液。
(3)若滴定开始和结束时,盛装
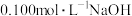 溶液的滴定管中的液面如图所示,终点读数为
溶液的滴定管中的液面如图所示,终点读数为 。
。
II.用氧化还原滴定方法测定粗品中
 的质量分数。
的质量分数。实验步骤:称取
 粗品配制
粗品配制 的溶液待用。用酸式滴定管取
的溶液待用。用酸式滴定管取 溶液于锥形瓶中,然后加入过量的KI溶液并酸化,加几滴淀粉溶液,立即用配制的
溶液于锥形瓶中,然后加入过量的KI溶液并酸化,加几滴淀粉溶液,立即用配制的 溶液滴定至终点(反应为
溶液滴定至终点(反应为 ),消耗
),消耗 溶液
溶液 。回答下列问题:
。回答下列问题:(4)向
 溶液中加入过量的
溶液中加入过量的 溶液并酸化,
溶液并酸化, 被还原成
被还原成 ,写出该反应的离子方程式:
,写出该反应的离子方程式:(5)用
 溶液滴定至终点的现象为
溶液滴定至终点的现象为(6)粗品中
 的质量分数为
的质量分数为(7)若在取
 溶液时有部分溶液滴到了锥形瓶外。则测定结果
溶液时有部分溶液滴到了锥形瓶外。则测定结果
您最近一年使用:0次
2023-02-06更新
|
401次组卷
|
3卷引用:湖南省长沙市第一中学2022-2023学年高二下学期入学考试化学试题
10-11高二下·浙江杭州·阶段练习
名校
解题方法
7 . 下列是一段关于中和滴定的实验叙述,其中错误的是
①取一锥形瓶,用待测NaOH溶液润洗两次;
②在锥形瓶中放入25.00 mL待测NaOH溶液;
③加入几滴石蕊溶液作指示剂;
④取一支酸式滴定管,洗涤干净;
⑤直接往酸式滴定管中注入标准酸溶液,进行滴定;
⑥左手旋转滴定管的玻璃活塞,右手不停地摇动锥形瓶;
⑦两眼注视着滴定管内盐酸液面下降,直至滴定终点.
①取一锥形瓶,用待测NaOH溶液润洗两次;
②在锥形瓶中放入25.00 mL待测NaOH溶液;
③加入几滴石蕊溶液作指示剂;
④取一支酸式滴定管,洗涤干净;
⑤直接往酸式滴定管中注入标准酸溶液,进行滴定;
⑥左手旋转滴定管的玻璃活塞,右手不停地摇动锥形瓶;
⑦两眼注视着滴定管内盐酸液面下降,直至滴定终点.
| A.④⑥⑦ | B.①⑤⑥⑦ | C.③⑤⑦ | D.①③⑤⑦ |
您最近一年使用:0次
2023-01-12更新
|
852次组卷
|
23卷引用:湖南省嘉禾县第一中学2021-2022学年高二上学期10月月考化学试题
湖南省嘉禾县第一中学2021-2022学年高二上学期10月月考化学试题(已下线)2010—2011届浙江省杭州市西湖高级中学高二4月月考化学试卷(已下线)2014秋广东省揭阳一中高二上学期期中考试(理)化学试卷2015-2016学年安徽省铜陵一中高二上期中测试化学试卷天津市静海区第四中学等四校2019-2020学年高二11月联考化学试题甘肃省张掖市第二中学2019-2020学年高二上学期10月月考化学试题云南省福贡县一中2019-2020学年高二上学期期末考试化学试题湖北省武汉市武昌区武汉中学2019-2020学年高二上学期化学(人教版选修4)期末复习试题:专题4 酸碱中和滴定(已下线)【南昌新东方】2019 南昌一中 高二上 第二次月考(已下线)练习12 酸碱中和滴定-2020-2021学年【补习教材·寒假作业】高二化学(苏教版)广西梧州市蒙山中学2020-2021学年高二下学期4月月考化学试题(已下线)3.2.2 pH计算和酸碱中和滴定-同步学习必备知识四川省成都市树德中学2022-2023学年高二上学期期末考试化学试题甘肃天祝藏族自治县第一中学2022-2023学年高二上学期1月期末考试化学试题四川省凉山州宁南中学2022-2023学年高二上学期期末考试化学试题黑龙江省哈尔滨市德强学校2022-2023学年高二上学期期末考试化学试题内蒙古呼伦贝尔市满洲里市第一中学2022-2023学年高二下学期第一次月考化学试题第3课时 酸碱中和滴定作业(二十五) 酸碱中和滴定第三章 水溶液中的离子反应与平衡 第二节 水的电离和溶液的pH 第2课时 酸碱中和滴定【精品卷】3.2.3 酸碱中和滴定课堂例题-人教版2023-2024学年选择性必修1(已下线)2013届安徽省蚌埠二中高三12月月考化学试卷(已下线)易错15 酸碱中和滴定及应用-备战2021年高考化学一轮复习易错题
名校
解题方法
8 . 用0.100mol·L-1的NaOH溶液分别滴定体积均为10.00mL、浓度均为0.100mol·L-1的HCl和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率(电导率越大表示溶液导电性越强)变化如图所示。下列说法正确的是


| A.曲线①代表向HCl中滴加NaOH | B.A点溶液的pH小于C点溶液的pH |
| C.A、B两点水的电离程度:A>B | D.C→D发生了反应:H++OH-=H2O |
您最近一年使用:0次
2022-07-23更新
|
1324次组卷
|
10卷引用:湖南省株洲市九方中学2021-2022学年高二下学期期末考试化学试题
湖南省株洲市九方中学2021-2022学年高二下学期期末考试化学试题黑龙江省哈尔滨师范大学附属中学2022-2023学年高二上学期期中考试化学试题北京市房山区2022届高三第二次模拟测试化学试题北京市一零一中学2022届高三三模化学试题(已下线)2022年浙江1月高考真题变式题(11-20)北京市第一七一中学2022届高三下学期三模化学试题(已下线)第23讲 弱电解质的电离平衡(讲)-2023年高考化学一轮复习讲练测(全国通用)(已下线)易错点24 水的电离平衡-备战2023年高考化学考试易错题北京市顺义一中2023届高三下学期保温练习模拟考试化学试题(已下线)考点2 水的电离与溶液的pH (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
名校
9 . 无水FeCl2为黄绿色晶体,在空气中易被氧化和易吸水,不溶于氯仿等有机溶剂。回答下列问题:
I.FeCl2的制备及产率测定:制备反应原理为2FeCl3+C6H5Cl 2FeCl2+C6H4Cl2+HCl(C6H5Cl为氯苯,沸点132℃),产率通过测定HCl的量进行计算。制备装置如图所示(夹持及加热装置略去):
2FeCl2+C6H4Cl2+HCl(C6H5Cl为氯苯,沸点132℃),产率通过测定HCl的量进行计算。制备装置如图所示(夹持及加热装置略去):
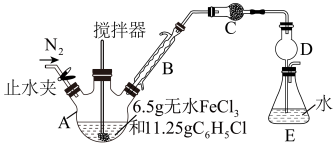
(1)仪器A的名称是____ ,仪器B的作用是____ ,装置C中的试剂是____ (填化学式)。
(2)为测定FeCl2的产率,用1.00mol·L-1NaOH溶液滴定溶于水的HCl,达到滴定终点时消耗NaOH溶液19.00mL,则FeCl2的产率为____ 。下列操作中,导致产率测定值偏低的是____ 。
a.滴定终点时俯视读数
b.滴定管未用NaOH标准溶液润洗
c.配制NaOH标准溶液时,转移溶液未洗涤烧杯
d.滴定前滴定管内无气泡,滴定结束后有气泡
II.FeCl2性质探究:将FeCl2晶体配成溶液后进行如表实验。
已知:Ba2+与SCN-可在溶液中大量共存;SCN-易被氧化为SO 。
。
(3)对实验ⅰ中溶液为浅红色的原因,甲同学提出以下假设:
假设1:加入氯水的量少,生成的Fe3+浓度低;
假设2:氯水氧化性强,____ 。
取实验ⅰ中浅红色溶液,____ (填实验操作),溶液浅红色消失,从而排除了假设1;向2mL水中滴加0.5mL0.1mol·L-1KSCN溶液,滴加0.5mL饱和氯水,加入____ ,产生白色沉淀,说明假设2正确。
(4)分析实验ⅱ“一段时间后,溶液褪为无色”的原因是____ (用离子方程式表示,已知SCN-中C元素为+4价)。
I.FeCl2的制备及产率测定:制备反应原理为2FeCl3+C6H5Cl
 2FeCl2+C6H4Cl2+HCl(C6H5Cl为氯苯,沸点132℃),产率通过测定HCl的量进行计算。制备装置如图所示(夹持及加热装置略去):
2FeCl2+C6H4Cl2+HCl(C6H5Cl为氯苯,沸点132℃),产率通过测定HCl的量进行计算。制备装置如图所示(夹持及加热装置略去):
(1)仪器A的名称是
(2)为测定FeCl2的产率,用1.00mol·L-1NaOH溶液滴定溶于水的HCl,达到滴定终点时消耗NaOH溶液19.00mL,则FeCl2的产率为
a.滴定终点时俯视读数
b.滴定管未用NaOH标准溶液润洗
c.配制NaOH标准溶液时,转移溶液未洗涤烧杯
d.滴定前滴定管内无气泡,滴定结束后有气泡
II.FeCl2性质探究:将FeCl2晶体配成溶液后进行如表实验。
| 序号 | 装置 | 试剂 | 实验现象 | |
| 实验ⅰ |  | 0.5mL0.1mol·L-1 KSCN溶液、1mL0.1mol·L-1 FeCl2(pH=1)溶液 | 0.5mL饱和氯水 | 溶液立即变为浅红色 |
| 实验ⅱ | 1mLl.5mol·L-1 HNO3溶液 | 滴入硝酸后,溶液变为红色,一段时间后,溶液褪为无色,且溶液中产生无色气泡,试管上方呈红棕色。 | ||
 。
。(3)对实验ⅰ中溶液为浅红色的原因,甲同学提出以下假设:
假设1:加入氯水的量少,生成的Fe3+浓度低;
假设2:氯水氧化性强,
取实验ⅰ中浅红色溶液,
(4)分析实验ⅱ“一段时间后,溶液褪为无色”的原因是
您最近一年使用:0次
2022-05-11更新
|
483次组卷
|
3卷引用:湖南省益阳市第一中学2021-2022学年高二下学期期末考试化学试题
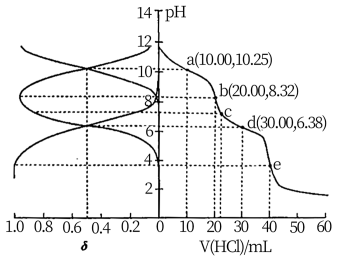
10 . 用 盐酸滴定
盐酸滴定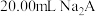 溶液,溶液中
溶液,溶液中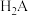 、
、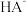 、
、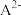 的分布分数
的分布分数 随pH变化曲线及滴定曲线如图。下列说法正确的是【如
随pH变化曲线及滴定曲线如图。下列说法正确的是【如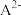 分布分数:
分布分数: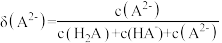 】
】
 盐酸滴定
盐酸滴定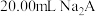 溶液,溶液中
溶液,溶液中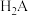 、
、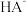 、
、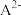 的分布分数
的分布分数 随pH变化曲线及滴定曲线如图。下列说法正确的是【如
随pH变化曲线及滴定曲线如图。下列说法正确的是【如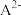 分布分数:
分布分数: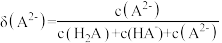 】
】
A.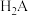 的 的 为 为 | B.c点: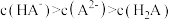 |
| C.第一次突变,可选酚酞作指示剂 | D.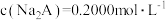 |
您最近一年使用:0次
2021-09-13更新
|
12213次组卷
|
29卷引用:湖南省长沙市周南中学2023-2024学年高二下学期第一次月考化学试题
湖南省长沙市周南中学2023-2024学年高二下学期第一次月考化学试题辽宁省实验中学2021-2022学年高二上学期11月期中阶段测化学试题辽宁省实验中学2021-2022学年高二上学期期中考试化学试题辽宁省朝阳市建平县实验中学2021-2022学年高二上学期第三次月考化学试题四川省绵阳南山中学2021-2022学年高二下学期3月月考理综化学试题湖南省衡阳市衡阳县第一中学2021-2022学年高三下学期期中考试化学试题山东省鄄城县第一中学2022-2023学年高二上学期期末考试化学试题微专题(12) 电解质溶液中的两类特殊图像黑龙江省大庆市肇州县第二中学2023-2024学年高二上学期12月月考化学试题辽宁省大连市第十二中学2023-2024学年高二上学期12月学情反馈化学试题2021年新高考辽宁化学高考真题2021年辽宁高考化学试题变式题11-192020年全国卷Ⅰ理综化学高考真题变式题(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)内蒙古海拉尔第二中学2021-2022学年高三上学期第三次阶段考化学试题(已下线)押新高考卷13题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(新高考通版)(已下线)回归教材重难点07 图像数据和结果的分析-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)专题10 水溶液中的离子平衡-三年(2020-2022)高考真题分项汇编(已下线)第32练 盐类的水解-2023年高考化学一轮复习小题多维练(全国通用)(已下线)微专题39 水溶液中平衡图像的拓展与探析-备战2023年高考化学一轮复习考点微专题(已下线)易错点24 水的电离平衡-备战2023年高考化学考试易错题(已下线)素养卷05 电解质溶液中微粒变化图像题-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)专题16 水溶液中的离子平衡(已下线)专题16 水溶液中的离子平衡(已下线)考点27 水的电离与溶液的pH(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点2 水的电离与溶液的pH (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点3 盐类水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)四川省仁寿第一中学校南校区2023-2024学年高三上学期11月期中考试理综化学试题



