名校
1 . 在实验中通常用滴定法测量物质的浓度或进行定量实验。
(1)用氧化还原滴定法测定某样品中草酸的含量。称量草酸H2C2O4样品1.0000g并溶于水,用0.200mol·L-1的酸性KMnO4溶液进行滴定,终点时消耗KMnO4标准溶液20.00mL(假设样品中杂质不与酸性KMnO4溶液反应)。
①滴定过程中发生反应的离子方程式为_______ 。
②滴定时_______ (填“需要”或“不需要”)使用指示剂。
③高锰酸钾溶液用_______ (填“酸式”或“碱式”)滴定管盛放。
④样品中草酸的质量分数是_______ 。
(2)某小组同学为了测定某中性溶液中Cl-的含量,用AgNO3溶液进行滴定。
下列物质能用作指示剂的是_______ (填物质名称)。
①K2CrO4②Na2S ③KI ④KBr
达到滴定终点的实验现象为_______ 。
(3)25° C时,向NaHA溶液中滴入盐酸,混合溶液的pH与粒子浓度变化的关系如图所示,则HA- +H2O H2A+OH-的水解平衡常数为
H2A+OH-的水解平衡常数为_______ 。

(1)用氧化还原滴定法测定某样品中草酸的含量。称量草酸H2C2O4样品1.0000g并溶于水,用0.200mol·L-1的酸性KMnO4溶液进行滴定,终点时消耗KMnO4标准溶液20.00mL(假设样品中杂质不与酸性KMnO4溶液反应)。
①滴定过程中发生反应的离子方程式为
②滴定时
③高锰酸钾溶液用
④样品中草酸的质量分数是
(2)某小组同学为了测定某中性溶液中Cl-的含量,用AgNO3溶液进行滴定。
| 物质 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| Ksp | 2×10-10 | 5.4×10-13 | 8.3×10-17 | 6.3×10-50 | 1.12×10-12 |
| 颜色 | 白色 | 淡黄色 | 黄色 | 黑色 | 砖红色 |
①K2CrO4②Na2S ③KI ④KBr
达到滴定终点的实验现象为
(3)25° C时,向NaHA溶液中滴入盐酸,混合溶液的pH与粒子浓度变化的关系如图所示,则HA- +H2O
 H2A+OH-的水解平衡常数为
H2A+OH-的水解平衡常数为
您最近一年使用:0次
2022-05-04更新
|
201次组卷
|
2卷引用:河南省名校联盟2021-2022学年高二下学期期中考试化学试题
2 . 自然界中含 、
、 较多的水称为硬水,容易形成水垢。柠檬酸(用
较多的水称为硬水,容易形成水垢。柠檬酸(用 表示)是一种较强的有机酸,可作高效除垢剂。用一定浓度柠檬酸溶液去除水垢,溶液中
表示)是一种较强的有机酸,可作高效除垢剂。用一定浓度柠檬酸溶液去除水垢,溶液中 、
、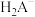 、
、 、
、 的百分含量随pH的变化曲线如图所示。回答下列问题:
的百分含量随pH的变化曲线如图所示。回答下列问题:__________ (写出其中一个离子方程式即可);加热能降低这种硬水中的 、
、 含量,其中
含量,其中 发生反应的化学方程式为
发生反应的化学方程式为_________ 。
(2)表示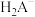 变化曲线的是
变化曲线的是_______ (填字母标号); 为
为_______ 。
(3)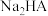 溶液显
溶液显____ (填“酸性”、“中性”或“碱性”),溶液中的电荷守恒关系式为________ 。
(4)向硬水中加入NaF固体可除去溶液中的 、
、 。若
。若 ,取等体积的NaF溶液加入体系中发生反应,则加入的NaF溶液的浓度至少为
,取等体积的NaF溶液加入体系中发生反应,则加入的NaF溶液的浓度至少为________  。[已知
。[已知 ,
,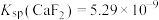 ]
]
 、
、 较多的水称为硬水,容易形成水垢。柠檬酸(用
较多的水称为硬水,容易形成水垢。柠檬酸(用 表示)是一种较强的有机酸,可作高效除垢剂。用一定浓度柠檬酸溶液去除水垢,溶液中
表示)是一种较强的有机酸,可作高效除垢剂。用一定浓度柠檬酸溶液去除水垢,溶液中 、
、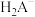 、
、 、
、 的百分含量随pH的变化曲线如图所示。回答下列问题:
的百分含量随pH的变化曲线如图所示。回答下列问题:
 、
、 含量,其中
含量,其中 发生反应的化学方程式为
发生反应的化学方程式为(2)表示
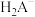 变化曲线的是
变化曲线的是 为
为(3)
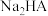 溶液显
溶液显(4)向硬水中加入NaF固体可除去溶液中的
 、
、 。若
。若 ,取等体积的NaF溶液加入体系中发生反应,则加入的NaF溶液的浓度至少为
,取等体积的NaF溶液加入体系中发生反应,则加入的NaF溶液的浓度至少为 。[已知
。[已知 ,
,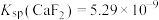 ]
]
您最近一年使用:0次
名校
3 . 酸、碱、盐是中学化学学习的重要化合物,请依据其性质回答下列问题。
(1)将0.5mol•L-1的NaClO溶液加热蒸干灼烧最后所得的固体是_______ 。
(2)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3•6H2O和NH4Cl固体混合物的方法来制备,其中NH4Cl的作用是________ 。
(3)为了除去氨氮废水中的NH3,得到低浓度的氨氮废水,采取以下措施:加入NaOH溶液,调节pH至9后,升温至30℃,通空气将氨赶出并回收,用化学平衡原理解释通空气的目的:_________ 。
(4)甲、乙两瓶氨水的浓度分别为1mol•L-1和0.1mol•L-1,则甲、乙两瓶氨水中c(OH-)之比_______ (填“大于”、“等于”或“小于”)。
(5)25℃时,将amolNH4NO3溶于水,溶液显酸性,向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将________ (填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为_______ mol•L-1。(NH3•H2O的电离平衡常数:Kb=2×10-5)
(6)已知NH2OH•H2O与NH3•H2O相似,水溶液具有弱碱性,其电离方程式为:NH2OH•H2O NH3OH++OH-。常温下,现用盐酸滴定NH2OH•H2O溶液,溶液中由水电离出的c(H+)的负对数[-lg水c(H+)]与所加盐酸体积的关系如图所示(已知:Kb(NH2OH•H2O)=10-9)
NH3OH++OH-。常温下,现用盐酸滴定NH2OH•H2O溶液,溶液中由水电离出的c(H+)的负对数[-lg水c(H+)]与所加盐酸体积的关系如图所示(已知:Kb(NH2OH•H2O)=10-9)
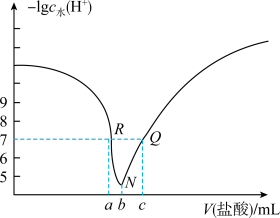
①R、Q两点溶液pH关系是:R________ Q(填“>”、“=”或“<”)。
②滴定过程中,若c(NH3OH+)=c(NH2OH•H2O),则此时溶液中pH=________ 。
③N点离子浓度由大到小的顺序为________ 。
(1)将0.5mol•L-1的NaClO溶液加热蒸干灼烧最后所得的固体是
(2)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3•6H2O和NH4Cl固体混合物的方法来制备,其中NH4Cl的作用是
(3)为了除去氨氮废水中的NH3,得到低浓度的氨氮废水,采取以下措施:加入NaOH溶液,调节pH至9后,升温至30℃,通空气将氨赶出并回收,用化学平衡原理解释通空气的目的:
(4)甲、乙两瓶氨水的浓度分别为1mol•L-1和0.1mol•L-1,则甲、乙两瓶氨水中c(OH-)之比
(5)25℃时,将amolNH4NO3溶于水,溶液显酸性,向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将
(6)已知NH2OH•H2O与NH3•H2O相似,水溶液具有弱碱性,其电离方程式为:NH2OH•H2O
 NH3OH++OH-。常温下,现用盐酸滴定NH2OH•H2O溶液,溶液中由水电离出的c(H+)的负对数[-lg水c(H+)]与所加盐酸体积的关系如图所示(已知:Kb(NH2OH•H2O)=10-9)
NH3OH++OH-。常温下,现用盐酸滴定NH2OH•H2O溶液,溶液中由水电离出的c(H+)的负对数[-lg水c(H+)]与所加盐酸体积的关系如图所示(已知:Kb(NH2OH•H2O)=10-9)
①R、Q两点溶液pH关系是:R
②滴定过程中,若c(NH3OH+)=c(NH2OH•H2O),则此时溶液中pH=
③N点离子浓度由大到小的顺序为
您最近一年使用:0次
名校
解题方法
4 . 按要求回答下列问题:
(1)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH )=c(Cl-),则溶液显
)=c(Cl-),则溶液显___________ (填“酸”“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb=_________ 。常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡___________ 移动(填“向左”“向右”或“不”)。试计算溶液中 =
=___________ (常温下H2SO3的电离平衡常数K2=6.0×10-8)。
(2)水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化,MnO(OH)2被I-还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(2S2O +I2=2I-+S4O
+I2=2I-+S4O )。
)。
取100.00 mL水样经固氧、酸化后,用a mol·L-1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为___________ ;若消耗Na2S2O3溶液的体积为b mL,则水样中溶解氧的含量为___________ mg·L-1。上述滴定完成时,若滴定管尖嘴处留有气泡会导致测定结果偏___________ 。(填“高”或“低”)
(1)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH
 )=c(Cl-),则溶液显
)=c(Cl-),则溶液显 =
=(2)水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化,MnO(OH)2被I-还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(2S2O
 +I2=2I-+S4O
+I2=2I-+S4O )。
)。取100.00 mL水样经固氧、酸化后,用a mol·L-1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为
您最近一年使用:0次
5 . 人体内尿酸(HUr)含量偏高,关节滑液中产生尿酸钠晶体(NaUr)会引发痛风,NaUr(s) Na+(aq)+Ur−(aq),∆H>0。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
Na+(aq)+Ur−(aq),∆H>0。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
已知:
①37℃时,Ka(HUr)=4×10−6,Kw=2.4×10−14,Ksp(NaUr)=6.4×10−5
②37℃时,模拟关节滑液pH=7.4,c(Ur-)=4.6×10−4mol∙L−1
(1)尿酸电离方程式为___________
(2)37℃时,向HUr溶液中加入NaOH溶液配制“模拟关节滑液”,溶液当中c(Na+)___________ c(Ur−)(填“>”、“<”或“=”),写出溶液中电荷守恒的等式:___________ 。
(3)37℃时,向模拟关节滑液中加入NaCl(s)至c(Na+)=0.2mol∙L−1时,通过计算溶液Q=c(Na+)∙c(Ur-)=___________ 。判断是否有NaUr晶体析出___________ (填是/否)。
(4)对于尿酸偏高的人群,下列建议正确的是___________ 。
a.加强锻炼,注意关节保暖
b.多饮酒,利用乙醇杀菌消毒
c.多喝水,饮食宜少盐、少脂
d.减少摄入易代谢出尿酸的食物
 Na+(aq)+Ur−(aq),∆H>0。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
Na+(aq)+Ur−(aq),∆H>0。某课题组配制“模拟关节滑液”进行研究,回答下列问题:已知:
①37℃时,Ka(HUr)=4×10−6,Kw=2.4×10−14,Ksp(NaUr)=6.4×10−5
②37℃时,模拟关节滑液pH=7.4,c(Ur-)=4.6×10−4mol∙L−1
(1)尿酸电离方程式为
(2)37℃时,向HUr溶液中加入NaOH溶液配制“模拟关节滑液”,溶液当中c(Na+)
(3)37℃时,向模拟关节滑液中加入NaCl(s)至c(Na+)=0.2mol∙L−1时,通过计算溶液Q=c(Na+)∙c(Ur-)=
(4)对于尿酸偏高的人群,下列建议正确的是
a.加强锻炼,注意关节保暖
b.多饮酒,利用乙醇杀菌消毒
c.多喝水,饮食宜少盐、少脂
d.减少摄入易代谢出尿酸的食物
您最近一年使用:0次
6 . 为研究某企业冲洗电路板后的废水( ,主要含
,主要含 、
、 等)中处理铜元素的最佳pH,取5份等量的废水,分别加入
等)中处理铜元素的最佳pH,取5份等量的废水,分别加入 的
的 溶液,调至不同的pH,静置后,分析上层清液中铜元素的含量,实验结果如图所示:
溶液,调至不同的pH,静置后,分析上层清液中铜元素的含量,实验结果如图所示:

关于 信息:
信息:
Ⅰ. 完全沉淀的
完全沉淀的
Ⅱ.废水中存在以下平衡:
①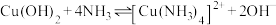 ;
;
②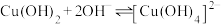
请回答下列问题
(1)结合图像可知,处理含铜废水的最佳
_____ 。
(2)该废水中含有污染环境的主要微粒除了 外,还有
外,还有_____ 。
(3)加入 溶液,使
溶液,使 转化为沉淀的离子方程式是
转化为沉淀的离子方程式是_____ 。
(4)从平衡原理分析, 段铜元素含量下降的原因是
段铜元素含量下降的原因是_____ 。
(5)分析 段,铜元素含量变化的可能原因是
段,铜元素含量变化的可能原因是_____ 。
(6)实际在加入 溶液调节pH除去铜元素过程中,从环境友好角度考虑,还需要进行的操作是
溶液调节pH除去铜元素过程中,从环境友好角度考虑,还需要进行的操作是_____ 。
 ,主要含
,主要含 、
、 等)中处理铜元素的最佳pH,取5份等量的废水,分别加入
等)中处理铜元素的最佳pH,取5份等量的废水,分别加入 的
的 溶液,调至不同的pH,静置后,分析上层清液中铜元素的含量,实验结果如图所示:
溶液,调至不同的pH,静置后,分析上层清液中铜元素的含量,实验结果如图所示:
关于
 信息:
信息:Ⅰ.
 完全沉淀的
完全沉淀的
Ⅱ.废水中存在以下平衡:
①
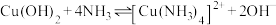 ;
;②
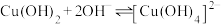
请回答下列问题
(1)结合图像可知,处理含铜废水的最佳

(2)该废水中含有污染环境的主要微粒除了
 外,还有
外,还有(3)加入
 溶液,使
溶液,使 转化为沉淀的离子方程式是
转化为沉淀的离子方程式是(4)从平衡原理分析,
 段铜元素含量下降的原因是
段铜元素含量下降的原因是(5)分析
 段,铜元素含量变化的可能原因是
段,铜元素含量变化的可能原因是(6)实际在加入
 溶液调节pH除去铜元素过程中,从环境友好角度考虑,还需要进行的操作是
溶液调节pH除去铜元素过程中,从环境友好角度考虑,还需要进行的操作是
您最近一年使用:0次
7 . 人体内尿酸(HUr)含量偏高,关节滑液中产生尿酸钠晶体(NaUr)会引发痛风和关节炎,有关平衡有:①HUr(尿酸,aq) (尿酸根,aq)
(尿酸根,aq) 、
、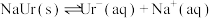 ②。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
②。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
已知:①37℃时, ,
, ,
,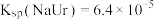 。
。
②37℃时,模拟关节滑液pH=7.4, 。
。
(1)37℃时, HUr溶液的pH约为
HUr溶液的pH约为_______ (已知 )。
)。
(2)下列事实可以证明尿酸是弱电解质的是_______(填字母)。
(3)37℃时,向HUr溶液中加入NaOH溶液配制“模拟关节滑液”,溶液中
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(4)37℃时,向模拟关节滑液中加入NaCl(s)至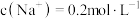 时,通过计算判断是否有NaUr晶体析出,请写出判断过程:
时,通过计算判断是否有NaUr晶体析出,请写出判断过程:_______ 。
(5)关节炎发作大都在脚趾和手指的关节处,反应②是_______ (填“放热”或“吸热”)反应。
(6)对于尿酸偏高的人群,下列建议正确的是_______(填字母)。
 (尿酸根,aq)
(尿酸根,aq) 、
、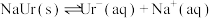 ②。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
②。某课题组配制“模拟关节滑液”进行研究,回答下列问题:已知:①37℃时,
 ,
, ,
,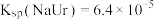 。
。②37℃时,模拟关节滑液pH=7.4,
 。
。(1)37℃时,
 HUr溶液的pH约为
HUr溶液的pH约为 )。
)。(2)下列事实可以证明尿酸是弱电解质的是_______(填字母)。
| A.NaUr溶液显碱性 |
| B.HUr溶液可使石蕊溶液变红 |
| C.常温下,等浓度的尿酸溶液导电性比盐酸弱 |
D.10mL 溶液与10mL 溶液与10mL NaOH溶液完全反应 NaOH溶液完全反应 |

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(4)37℃时,向模拟关节滑液中加入NaCl(s)至
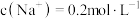 时,通过计算判断是否有NaUr晶体析出,请写出判断过程:
时,通过计算判断是否有NaUr晶体析出,请写出判断过程:(5)关节炎发作大都在脚趾和手指的关节处,反应②是
(6)对于尿酸偏高的人群,下列建议正确的是_______(填字母)。
| A.多喝水,食用新鲜蔬果 |
| B.饮食宜多盐、多脂 |
| C.适度运动,注意关节保暖 |
| D.减少摄入易代谢出尿酸的食物 |
您最近一年使用:0次
2022-12-16更新
|
109次组卷
|
2卷引用:山西省运城市教育发展联盟20222023学年高二上学期12月联考化学试题
8 . 以下元素及物质与人类的生产生活紧密相关。完成下列填空:
(1)氯元素原子结构示意图为_______ ,其与钠元素组成的化合物的电子式为_______ 。
(2)铝是地壳中含量最高的金属元素,其在周期表中位于第_______ 周期_______ 族。
(3)以下不是铝和铁的共同性质的是_______ 。
a.导电性 b.导热性 c.延展性 d.两性
(4)下列能说明氯元素的非金属性比硫元素强的事实是_____ 。
a.稳定性 HCl>H2S b.氧化性 HClO>H2SO4
c.酸性HClO4>H2SO4强 d.HCl溶液是强酸,H2S溶液是弱酸
(5)氨水呈碱性,写出氨水的电离方程式。_______
(1)氯元素原子结构示意图为
(2)铝是地壳中含量最高的金属元素,其在周期表中位于第
(3)以下不是铝和铁的共同性质的是
a.导电性 b.导热性 c.延展性 d.两性
(4)下列能说明氯元素的非金属性比硫元素强的事实是
a.稳定性 HCl>H2S b.氧化性 HClO>H2SO4
c.酸性HClO4>H2SO4强 d.HCl溶液是强酸,H2S溶液是弱酸
(5)氨水呈碱性,写出氨水的电离方程式。
您最近一年使用:0次
9 . 人体内尿酸(HUr)含量偏高,关节滑液中产生尿酸钠晶体(NaUr)会引发痛风,NaUr(s)  Na+(aq)+Ur−(aq) ∆H >0。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
Na+(aq)+Ur−(aq) ∆H >0。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
已知:①37℃时,Ka(HUr) = 4×10−6,Kw = 2.4×10−14,Ksp(NaUr) = 6.4×10−5
②37℃时,模拟关节滑液pH =7.4,c(Ur-) =4.6×10−4 mol∙L−1
(1)尿酸电离方程式为_______
(2)Kh为盐的水解常数,37℃时,Kh(Ur−)=_______ 。
(3)37℃时,向HUr溶液中加入NaOH溶液配制“模拟关节滑液”,溶液中c(Na+)_______ c(Ur−) (填“>”、“<”或“=”)。
(4)37℃时,向模拟关节滑液中加入NaCl(s)至c(Na+) = 0.2 mol∙L−1时,通过计算判断是否有NaUr晶体析出,请写出判断过程_______
(5)对于尿酸偏高的人群,下列建议正确的是_______ 。
a.加强锻炼,注意关节保暖 b.多饮酒,利用乙醇杀菌消毒
c.多喝水,饮食宜少盐、少脂 d.减少摄入易代谢出尿酸的食物
 Na+(aq)+Ur−(aq) ∆H >0。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
Na+(aq)+Ur−(aq) ∆H >0。某课题组配制“模拟关节滑液”进行研究,回答下列问题:已知:①37℃时,Ka(HUr) = 4×10−6,Kw = 2.4×10−14,Ksp(NaUr) = 6.4×10−5
②37℃时,模拟关节滑液pH =7.4,c(Ur-) =4.6×10−4 mol∙L−1
(1)尿酸电离方程式为
(2)Kh为盐的水解常数,37℃时,Kh(Ur−)=
(3)37℃时,向HUr溶液中加入NaOH溶液配制“模拟关节滑液”,溶液中c(Na+)
(4)37℃时,向模拟关节滑液中加入NaCl(s)至c(Na+) = 0.2 mol∙L−1时,通过计算判断是否有NaUr晶体析出,请写出判断过程
(5)对于尿酸偏高的人群,下列建议正确的是
a.加强锻炼,注意关节保暖 b.多饮酒,利用乙醇杀菌消毒
c.多喝水,饮食宜少盐、少脂 d.减少摄入易代谢出尿酸的食物
您最近一年使用:0次
2021-05-27更新
|
709次组卷
|
7卷引用:海南省海口市2020届高三6月等级模拟试卷化学试题
海南省海口市2020届高三6月等级模拟试卷化学试题(已下线)第03章 物质在水溶液中的行为(A卷基础强化卷)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材鲁科版)海南省北京师范大学万宁附属中学2021届高三上学期第一次月考化学试题福建省福州一中2021届高三第五次模拟考试化学试题(已下线)第25讲 盐类水解(精练)-2022年高考化学一轮复习讲练测(已下线)第25讲 盐类水解(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第4讲 盐类的水解
名校
解题方法
10 . I.根据下列图象,进行分析:
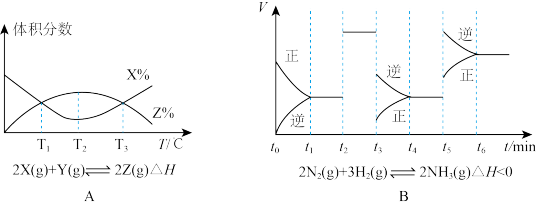
(1)由图A知,该反应的K值随温度的升高而_____ (填“增大”、“减小”或“不变”)。
(2)由图B知,t3时采取的措施为_____ ,t1~t6中,氨气的含量最低的是_____ 。
II.已知H2A在水中电离:H2A=HA-+H+,HA- A2-+H+。
A2-+H+。
(1)常温下NaHA溶液的pH__ (填序号)。
A.大于7 B.小于7 C.等于7 D.无法确定
(2)某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/LKOH溶液至溶液呈中性(稀溶液体积可以加和),此时该混合溶液中的下列关系一定正确的是______ 。
A.c(H+)·c(OH-)=1×10-14 B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+) D.c(Na+)+c(K+)=0.05 mol/L
(3)已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s) Ca2+(aq)+A2-(aq)∆H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有
Ca2+(aq)+A2-(aq)∆H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有______ 。
A.升高温度 B.加入Na2A固体 C.加入NH4Cl晶体

(1)由图A知,该反应的K值随温度的升高而
(2)由图B知,t3时采取的措施为
II.已知H2A在水中电离:H2A=HA-+H+,HA-
 A2-+H+。
A2-+H+。(1)常温下NaHA溶液的pH
A.大于7 B.小于7 C.等于7 D.无法确定
(2)某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/LKOH溶液至溶液呈中性(稀溶液体积可以加和),此时该混合溶液中的下列关系一定正确的是
A.c(H+)·c(OH-)=1×10-14 B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+) D.c(Na+)+c(K+)=0.05 mol/L
(3)已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)
 Ca2+(aq)+A2-(aq)∆H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有
Ca2+(aq)+A2-(aq)∆H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有A.升高温度 B.加入Na2A固体 C.加入NH4Cl晶体
您最近一年使用:0次



