1 . 以下元素及物质与人类的生产生活紧密相关。完成下列填空:
(1)氯元素原子结构示意图为_______ ,其与钠元素组成的化合物的电子式为_______ 。
(2)铝是地壳中含量最高的金属元素,其在周期表中位于第_______ 周期_______ 族。
(3)以下不是铝和铁的共同性质的是_______ 。
a.导电性 b.导热性 c.延展性 d.两性
(4)下列能说明氯元素的非金属性比硫元素强的事实是_____ 。
a.稳定性 HCl>H2S b.氧化性 HClO>H2SO4
c.酸性HClO4>H2SO4强 d.HCl溶液是强酸,H2S溶液是弱酸
(5)氨水呈碱性,写出氨水的电离方程式。_______
(1)氯元素原子结构示意图为
(2)铝是地壳中含量最高的金属元素,其在周期表中位于第
(3)以下不是铝和铁的共同性质的是
a.导电性 b.导热性 c.延展性 d.两性
(4)下列能说明氯元素的非金属性比硫元素强的事实是
a.稳定性 HCl>H2S b.氧化性 HClO>H2SO4
c.酸性HClO4>H2SO4强 d.HCl溶液是强酸,H2S溶液是弱酸
(5)氨水呈碱性,写出氨水的电离方程式。
您最近一年使用:0次
解题方法
2 . 草酸 是一种白色粉末,
是一种白色粉末,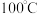 左右开始少量升华,熔点为
左右开始少量升华,熔点为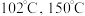 左右分解产生
左右分解产生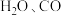 和
和 ;可与酸性
;可与酸性 溶液反应;其钠盐易溶于水,钙盐难溶于水;电离平衡常数为
溶液反应;其钠盐易溶于水,钙盐难溶于水;电离平衡常数为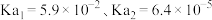 。
。
1.草酸可用于实验室制备少量 气体,应选择的发生装置为
气体,应选择的发生装置为___________ 。
常温下,向某浓度的草酸溶液中加入一定量等浓度的 溶液。
溶液。
3.当 时,溶液呈___________。
时,溶液呈___________。
A.酸性 B.碱性 C.中性 D.无法判断
此时,溶液中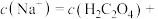
___________ 。
4.当 时,计算该溶液的
时,计算该溶液的
___________ 。(结果保留两位小数)计算过程。
 是一种白色粉末,
是一种白色粉末,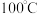 左右开始少量升华,熔点为
左右开始少量升华,熔点为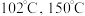 左右分解产生
左右分解产生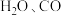 和
和 ;可与酸性
;可与酸性 溶液反应;其钠盐易溶于水,钙盐难溶于水;电离平衡常数为
溶液反应;其钠盐易溶于水,钙盐难溶于水;电离平衡常数为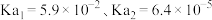 。
。1.草酸可用于实验室制备少量
 气体,应选择的发生装置为
气体,应选择的发生装置为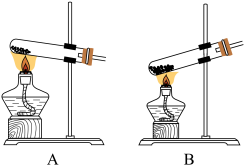
A.用足量的 溶液充分吸收后,可收集得到纯净的 溶液充分吸收后,可收集得到纯净的 |
| B.通过灼热的氧化铜,若出现黑色变红色现象,则产生的气体中一定有CO |
C.通入足量的澄清石灰水中,若能产生白色沉淀,则产生的气体中一定有 |
D.通入酸性 溶液中,若能使溶液褪色,说明草酸具有还原性 溶液中,若能使溶液褪色,说明草酸具有还原性 |
常温下,向某浓度的草酸溶液中加入一定量等浓度的
 溶液。
溶液。3.当
 时,溶液呈___________。
时,溶液呈___________。A.酸性 B.碱性 C.中性 D.无法判断
此时,溶液中
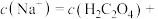
4.当
 时,计算该溶液的
时,计算该溶液的
您最近一年使用:0次
名校
3 . I.次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元弱酸,写出其电离方程式:___________ 。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于对器皿实现化学镀银。
①H3PO2中,P元素的化合价为___________ 。
②利用H3PO2进行化学镀银反应中,氧化产物为H3PO4,则氧化剂与还原剂的物质的量之比为___________ 。
③NaH2PO2为___________ (填“正盐”或“酸式盐”)。
II.现有下列反应:
①2H2O+Cl2+SO2=H2SO4+2HCl
②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
针对上述两个反应回答:
(1)用单线桥标出①中电子转移的方向和数目___________ ;
(2)Cl2、SO2和KMnO4的氧化性由强到弱的顺序为___________ ;
(1)H3PO2是一元弱酸,写出其电离方程式:
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于对器皿实现化学镀银。
①H3PO2中,P元素的化合价为
②利用H3PO2进行化学镀银反应中,氧化产物为H3PO4,则氧化剂与还原剂的物质的量之比为
③NaH2PO2为
II.现有下列反应:
①2H2O+Cl2+SO2=H2SO4+2HCl
②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
针对上述两个反应回答:
(1)用单线桥标出①中电子转移的方向和数目
(2)Cl2、SO2和KMnO4的氧化性由强到弱的顺序为
您最近一年使用:0次
名校
4 . 填空。
(1)25℃时,浓度为0.1mol·L-1的6种溶液:①HCl,②CH3COOH,③Ba(OH)2,④Na2CO3,⑤KCl,⑥NH4Cl。溶液pH由小到大的顺序为_______ (填写编号)。
(2)25℃时,醋酸的电离常数Ka=2×10-5mol·L-1,则该温度下CH3COONa的水解平衡常数Kh=_______ 。
(3)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈_______ (填“酸性”“中性”或“碱性”),请写出溶液中离子 浓度间的一个等式:_______ 。
(4)25℃时,将mmol·L-1的醋酸和nmol·L-1的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中c(CH3COO-)+c(CH3COOH)=_____ mol·L-1,m与n的大小关系是m______ n(填“>”“=”或“<”)。
(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3·H2O的电离常数Kb=_______ 。
(6)设计一个简单的实验,怎样证明醋酸是弱酸?_______ 。
(1)25℃时,浓度为0.1mol·L-1的6种溶液:①HCl,②CH3COOH,③Ba(OH)2,④Na2CO3,⑤KCl,⑥NH4Cl。溶液pH由小到大的顺序为
(2)25℃时,醋酸的电离常数Ka=2×10-5mol·L-1,则该温度下CH3COONa的水解平衡常数Kh=
(3)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈
(4)25℃时,将mmol·L-1的醋酸和nmol·L-1的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中c(CH3COO-)+c(CH3COOH)=
(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3·H2O的电离常数Kb=
(6)设计一个简单的实验,怎样证明醋酸是弱酸?
您最近一年使用:0次
5 . 生物质铁炭纳米材料可以活化过一硫酸盐,降解废水中有机污染物.
(1)生物质铁炭纳米材料活化过—硫酸钾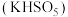 降解有机污染物的反应历程如图-1所示.图中
降解有机污染物的反应历程如图-1所示.图中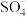 和
和 分别表示硫酸根自由基和羟基自由基.
分别表示硫酸根自由基和羟基自由基. (S的化合价为
(S的化合价为 )在水中的电离过程为:
)在水中的电离过程为: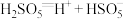 、
、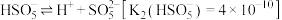 .写出
.写出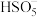 的结构式:
的结构式:_______ 。
②生物质铁炭纳米材料降解有机污染物的机理可描述为______ 。
③若有机污染物为苯酚,写出酸性条件下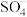 与苯酚反应的化学方程式:
与苯酚反应的化学方程式:______ 。
(2)与直接使用纳米铁颗粒相比,使用生物质铁炭纳米材料降解的优点是:______ 。
(3)铁炭纳米材料在不同 对有机污染物去除率(
对有机污染物去除率( 溶液有机物浓度与初始有机物浓度的比值)的影响如图-2所示,
溶液有机物浓度与初始有机物浓度的比值)的影响如图-2所示, 越小有机污染物去除率越高的原因是:
越小有机污染物去除率越高的原因是:______ 。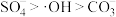 。水中存在一定量
。水中存在一定量 和无
和无 存在时对铁炭纳米材料降解有机污染物的影响如图-3所示.
存在时对铁炭纳米材料降解有机污染物的影响如图-3所示. 的存在对有机污染物的降解有影响,原因是:
的存在对有机污染物的降解有影响,原因是:______ 。
(1)生物质铁炭纳米材料活化过—硫酸钾
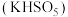 降解有机污染物的反应历程如图-1所示.图中
降解有机污染物的反应历程如图-1所示.图中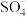 和
和 分别表示硫酸根自由基和羟基自由基.
分别表示硫酸根自由基和羟基自由基.
 (S的化合价为
(S的化合价为 )在水中的电离过程为:
)在水中的电离过程为: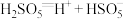 、
、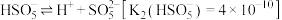 .写出
.写出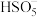 的结构式:
的结构式:②生物质铁炭纳米材料降解有机污染物的机理可描述为
③若有机污染物为苯酚,写出酸性条件下
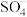 与苯酚反应的化学方程式:
与苯酚反应的化学方程式:(2)与直接使用纳米铁颗粒相比,使用生物质铁炭纳米材料降解的优点是:
(3)铁炭纳米材料在不同
 对有机污染物去除率(
对有机污染物去除率( 溶液有机物浓度与初始有机物浓度的比值)的影响如图-2所示,
溶液有机物浓度与初始有机物浓度的比值)的影响如图-2所示, 越小有机污染物去除率越高的原因是:
越小有机污染物去除率越高的原因是: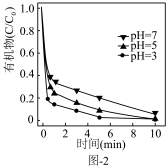
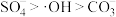 。水中存在一定量
。水中存在一定量 和无
和无 存在时对铁炭纳米材料降解有机污染物的影响如图-3所示.
存在时对铁炭纳米材料降解有机污染物的影响如图-3所示. 的存在对有机污染物的降解有影响,原因是:
的存在对有机污染物的降解有影响,原因是: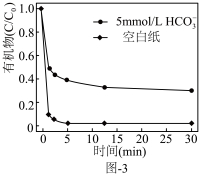
您最近一年使用:0次
6 . 阅读如下资料:
i.乙烯可在加热条件下催化氧化制得环氧乙烷( );具有强穿透力的环氧乙烷在常温下能杀灭微生物。
);具有强穿透力的环氧乙烷在常温下能杀灭微生物。
ii.环氧乙烷与水在加压、加热的条件下化合为乙二醇;乙二醇的熔点为-12.9℃,沸点197.3℃;能与水、丙酮等互溶。
iii.汽车铝制水箱(即散热器)中盛装的某防冻液(乙二醇与水是主要成分,体积比约1:1),沸点为108℃,冰点为-38℃;其中常加入适量NaH2PO4,用来消除水箱中严生的碱性水垢,从而提高散热效果。
iv.25℃ H3PO4Ka1=6.9×10-3,Ka2=6.2×10-8,Ka3=4.8×10-13。
结合题干信息,请按要求回答下列问题:
(1)环氧乙烷的分子式:____ ,其含有的官能团名称:____ 。
(2)乙二醇能与丙酮互溶的原因可能是乙二醇与丙酮都是极性分子,符合“相似相溶”的规律,还可能是____ 。
(3)结合ii、iii、iv中数据信息解释如下问题。
①NaH2PO4能除水垢的原因为____ ;故NaH2PO4水溶液显弱酸性,可消除碱性水垢。
②防冻液在使用一段时间后pH会降低的可能原因为____ 。
(4)结合已学知识及i、ii中信息,将如下两种合成乙二醇的路线补充完整(方框内填有机产物,箭头上填无机试剂及其反应条件)
①CH2=CH2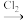
 →CH2OHCH2OH
→CH2OHCH2OH____
②CH2=CH2→ →CH2OHCH2OH
→CH2OHCH2OH____
生产乙二醇常采用路线②而不采用路线①,其可能原因(写出一种)是____ 。
i.乙烯可在加热条件下催化氧化制得环氧乙烷(
 );具有强穿透力的环氧乙烷在常温下能杀灭微生物。
);具有强穿透力的环氧乙烷在常温下能杀灭微生物。ii.环氧乙烷与水在加压、加热的条件下化合为乙二醇;乙二醇的熔点为-12.9℃,沸点197.3℃;能与水、丙酮等互溶。
iii.汽车铝制水箱(即散热器)中盛装的某防冻液(乙二醇与水是主要成分,体积比约1:1),沸点为108℃,冰点为-38℃;其中常加入适量NaH2PO4,用来消除水箱中严生的碱性水垢,从而提高散热效果。
iv.25℃ H3PO4Ka1=6.9×10-3,Ka2=6.2×10-8,Ka3=4.8×10-13。
结合题干信息,请按要求回答下列问题:
(1)环氧乙烷的分子式:
(2)乙二醇能与丙酮互溶的原因可能是乙二醇与丙酮都是极性分子,符合“相似相溶”的规律,还可能是
(3)结合ii、iii、iv中数据信息解释如下问题。
①NaH2PO4能除水垢的原因为
②防冻液在使用一段时间后pH会降低的可能原因为
(4)结合已学知识及i、ii中信息,将如下两种合成乙二醇的路线补充完整(方框内填有机产物,箭头上填无机试剂及其反应条件)
①CH2=CH2
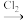
 →CH2OHCH2OH
→CH2OHCH2OH②CH2=CH2→
 →CH2OHCH2OH
→CH2OHCH2OH生产乙二醇常采用路线②而不采用路线①,其可能原因(写出一种)是
您最近一年使用:0次
2022-03-13更新
|
184次组卷
|
2卷引用:天津市河西区2021-2022学年高三上学期期末考试 化学试题
7 . I.常温下将0.01 mol NH4Cl和0.002 mol NaOH溶于水配成1 L溶液。
(1)该溶液中存在的平衡体系有(用离子反应方程式表示)________
(2)溶液中共有________ 种不同的微粒。
(3)这些微粒中浓度为0.01 mol·L-1的是_____ ,浓度为0.002 mol·L-1的是___ 。
(4)______ 和_______ 两种微粒的物质的量之和比OH-的物质的量多0.008 mol。
II.(5)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。
①在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________ 。
A.KMnO4 B.H2O2 C.氯水 D.HNO3
②然后再加入适当物质调整溶液至pH=4,使Fe3+转化为Fe(OH)3,调整溶液pH可选用下列中的______ 。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(6)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=1.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1.0×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________ ,Fe3+完全沉淀[即c(Fe3+)≤1.0×10-5 mol·L-1]时溶液的pH为________ 。
(1)该溶液中存在的平衡体系有(用离子反应方程式表示)
(2)溶液中共有
(3)这些微粒中浓度为0.01 mol·L-1的是
(4)
II.(5)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。
①在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是
A.KMnO4 B.H2O2 C.氯水 D.HNO3
②然后再加入适当物质调整溶液至pH=4,使Fe3+转化为Fe(OH)3,调整溶液pH可选用下列中的
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(6)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=1.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1.0×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为
您最近一年使用:0次
8 . 磷能形成次磷酸(H3PO2)、亚磷酸(H3PO3)等多种含氧酸。
(1)次磷酸(H3PO2)属于元酸,是一种精细化工产品。设计一种实验方案,证明H3PO2是弱酸:____ 。(可选择的试剂为:0.1mol·L-1NaH2PO2溶液、0.1mol·L-1的H3PO2溶液、0.1ml·L-1的盐酸)
(2)亚磷酸(H3PO3)是二元弱酸,常温下向1L0.5mol·LH3PO3溶液中滴加等浓度的NaOH溶液,混合溶液中含磷粒子的物质的量分数(δ)与溶液pH的关系如图所示:
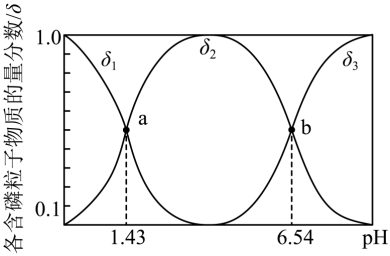
①当溶液pH从6.54变为7时发生反应的离子方程式为____ 。
②Na2HPO3溶液显碱性,原因是(用离子方程式表示)____ 。
③室温下,H3PO3的电离平衡常数为Ka1和Ka2,则pKa2=____ (pKa2=lgKa2)。
④0.1mol·L-1NaH2PO3溶液中各离子浓度由大到小顺序为____ 。
(1)次磷酸(H3PO2)属于元酸,是一种精细化工产品。设计一种实验方案,证明H3PO2是弱酸:
(2)亚磷酸(H3PO3)是二元弱酸,常温下向1L0.5mol·LH3PO3溶液中滴加等浓度的NaOH溶液,混合溶液中含磷粒子的物质的量分数(δ)与溶液pH的关系如图所示:

①当溶液pH从6.54变为7时发生反应的离子方程式为
②Na2HPO3溶液显碱性,原因是(用离子方程式表示)
③室温下,H3PO3的电离平衡常数为Ka1和Ka2,则pKa2=
④0.1mol·L-1NaH2PO3溶液中各离子浓度由大到小顺序为
您最近一年使用:0次
9 . 砷(33As)在元素周期表中与氮同主族,砷及其化合物被运用在农药、防腐剂、染料和医药等领域,及其多种合金中。
(1)砷原子次外层上的电子数为_____ ,砷化氢的电子式为_______ 。
(2)成语“饮鸩止渴”中的“鸩”是指放了砒霜(As2O3)的酒。As2O3是两性偏酸性的氧化物,写出As2O3溶于浓盐酸的化学方程式__________ 。
(3)As2O3溶于热水生成的亚砷酸(H3AsO3),具有较强的还原性,分可用于治疗白血病,其水溶液存在多种微粒形态,各微粒的分布分数与溶液pH的关系如图:
①向亚砷酸溶液中缓缓加入NaOH溶液至pH=11时,反应的离子方程式为_________ 。
②电离平衡常数Ka1(H3AsO3)=________ 。
③Na2HAsO3溶液呈碱性,该溶液中c(H2AsO3-)_____ c(AsO33-)(填“>”、“<”或“=”)。
④向含有HAsO32-的溶液中滴加氯水反应的离子方程式为_________ 。
(1)砷原子次外层上的电子数为
(2)成语“饮鸩止渴”中的“鸩”是指放了砒霜(As2O3)的酒。As2O3是两性偏酸性的氧化物,写出As2O3溶于浓盐酸的化学方程式
(3)As2O3溶于热水生成的亚砷酸(H3AsO3),具有较强的还原性,分可用于治疗白血病,其水溶液存在多种微粒形态,各微粒的分布分数与溶液pH的关系如图:

①向亚砷酸溶液中缓缓加入NaOH溶液至pH=11时,反应的离子方程式为
②电离平衡常数Ka1(H3AsO3)=
③Na2HAsO3溶液呈碱性,该溶液中c(H2AsO3-)
④向含有HAsO32-的溶液中滴加氯水反应的离子方程式为
您最近一年使用:0次
名校
解题方法
10 . 按要求回答下列问题:
(1)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH )=c(Cl-),则溶液显
)=c(Cl-),则溶液显___________ (填“酸”“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb=_________ 。常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡___________ 移动(填“向左”“向右”或“不”)。试计算溶液中 =
=___________ (常温下H2SO3的电离平衡常数K2=6.0×10-8)。
(2)水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化,MnO(OH)2被I-还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(2S2O +I2=2I-+S4O
+I2=2I-+S4O )。
)。
取100.00 mL水样经固氧、酸化后,用a mol·L-1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为___________ ;若消耗Na2S2O3溶液的体积为b mL,则水样中溶解氧的含量为___________ mg·L-1。上述滴定完成时,若滴定管尖嘴处留有气泡会导致测定结果偏___________ 。(填“高”或“低”)
(1)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH
 )=c(Cl-),则溶液显
)=c(Cl-),则溶液显 =
=(2)水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化,MnO(OH)2被I-还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(2S2O
 +I2=2I-+S4O
+I2=2I-+S4O )。
)。取100.00 mL水样经固氧、酸化后,用a mol·L-1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为
您最近一年使用:0次



