名校
1 . 常温下,有四种溶液:①0.1 mol·L-1 CH3COOH溶液 ②0.1 mol·L-1 CH3COONa溶液 ③0.1 mol·L-1 NaHSO3溶液 ④0.1 mol·L-1 NaHCO3溶液
(1)溶液①中离子的电荷守恒关系式是___________ 。
(2)下列有关①和②两种溶液的说法正确的是___________ (填字母)。
a.两种溶液中c(CH3COO-) 都等于0.1 mol·L-1
b.两种溶液中c(CH3COO-) 都小于0.1 mol·L-1
c.CH3COOH溶液中c(CH3COO-) 小于CH3COONa溶液中c(CH3COO-)
(3)NaHSO3溶液的pH<7,NaHCO3溶液的pH>7,则NaHSO3溶液中c(H2SO3)___________ (填“>”“<”或“=”,下同)c( ),NaHCO3溶液中c(H2CO3)
),NaHCO3溶液中c(H2CO3)___________ c( ),某同学将
),某同学将 溶液和
溶液和 溶液混合在一起,发现产生了红褐色沉淀和无色气体,该反应的离子方程式为:
溶液混合在一起,发现产生了红褐色沉淀和无色气体,该反应的离子方程式为:___________ 。
(4)某温度时, ,
, ,
, 。某溶液含有
。某溶液含有 、
、 和
和 ,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的
,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的 溶液,三种阴离子产生沉淀的先后顺序为
溶液,三种阴离子产生沉淀的先后顺序为___________ (用阴离子符号表示)。
(1)溶液①中离子的电荷守恒关系式是
(2)下列有关①和②两种溶液的说法正确的是
a.两种溶液中c(CH3COO-) 都等于0.1 mol·L-1
b.两种溶液中c(CH3COO-) 都小于0.1 mol·L-1
c.CH3COOH溶液中c(CH3COO-) 小于CH3COONa溶液中c(CH3COO-)
(3)NaHSO3溶液的pH<7,NaHCO3溶液的pH>7,则NaHSO3溶液中c(H2SO3)
 ),NaHCO3溶液中c(H2CO3)
),NaHCO3溶液中c(H2CO3) ),某同学将
),某同学将 溶液和
溶液和 溶液混合在一起,发现产生了红褐色沉淀和无色气体,该反应的离子方程式为:
溶液混合在一起,发现产生了红褐色沉淀和无色气体,该反应的离子方程式为:(4)某温度时,
 ,
, ,
, 。某溶液含有
。某溶液含有 、
、 和
和 ,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的
,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的 溶液,三种阴离子产生沉淀的先后顺序为
溶液,三种阴离子产生沉淀的先后顺序为
您最近一年使用:0次
2 .  时,三种酸的电离平衡常数如下:
时,三种酸的电离平衡常数如下:
回答下列问题:
(1)一般情况下,当温度升高时,
_____ (填“增大”“减小”或“不变”)。
(2)用蒸馏水稀释 的次氯酸,下列各式表示的数值随水量的增加而增大的是_____。(填字母序号,下同)
的次氯酸,下列各式表示的数值随水量的增加而增大的是_____。(填字母序号,下同)
(3)下列能使醋酸溶液中 的电离程度增大,而电离平衡常数不变的是_____。
的电离程度增大,而电离平衡常数不变的是_____。
(4)依上表数据写出向NaClO溶液中通少量 的离子方程式:
的离子方程式:_____ 。
 时,三种酸的电离平衡常数如下:
时,三种酸的电离平衡常数如下:| 化学式 | HClO |  |  |
| 电离平衡常数 |  |  | 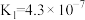 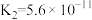 |
(1)一般情况下,当温度升高时,

(2)用蒸馏水稀释
 的次氯酸,下列各式表示的数值随水量的增加而增大的是_____。(填字母序号,下同)
的次氯酸,下列各式表示的数值随水量的增加而增大的是_____。(填字母序号,下同)A. | B. | C.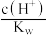 | D. |
 的电离程度增大,而电离平衡常数不变的是_____。
的电离程度增大,而电离平衡常数不变的是_____。| A.升高温度 | B.加水稀释 |
C.加少量的 固体 固体 | D.加少量氢氧化钠浓溶液 |
 的离子方程式:
的离子方程式:
您最近一年使用:0次
2023-06-24更新
|
212次组卷
|
2卷引用:广东省惠州市龙门县高级中学2021-2022学年高二下学期开学测试化学试题
名校
3 . 请回答下列问题:
(1)常温下, 溶液的
溶液的
①该溶液中由水电离出的 浓度是
浓度是___________  。
。
②计算 的电离平衡常数
的电离平衡常数
___________ 。
(2)现有常温下 的盐酸(甲)和
的盐酸(甲)和 的醋酸溶液(乙),回答下列问题:
的醋酸溶液(乙),回答下列问题:
①常温下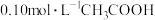 溶液加水稀释过程中,下列表达式的数值一定变小的是
溶液加水稀释过程中,下列表达式的数值一定变小的是___________ (填标号)。
A. B.
B. C.
C.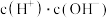 D.
D.
②取等体积的盐酸、醋酸,分别与足量的锌反应,若生成的 在相同条件下体积相同,则
在相同条件下体积相同,则 (盐酸)
(盐酸)___________  (醋酸)(填“>”“<”或“=”)。
(醋酸)(填“>”“<”或“=”)。
(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示:
根据电离常数判断下列反应不可能发生的是___________
(1)常温下,
 溶液的
溶液的
①该溶液中由水电离出的
 浓度是
浓度是 。
。②计算
 的电离平衡常数
的电离平衡常数
(2)现有常温下
 的盐酸(甲)和
的盐酸(甲)和 的醋酸溶液(乙),回答下列问题:
的醋酸溶液(乙),回答下列问题:①常温下
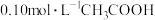 溶液加水稀释过程中,下列表达式的数值一定变小的是
溶液加水稀释过程中,下列表达式的数值一定变小的是A.
 B.
B. C.
C.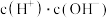 D.
D.
②取等体积的盐酸、醋酸,分别与足量的锌反应,若生成的
 在相同条件下体积相同,则
在相同条件下体积相同,则 (盐酸)
(盐酸) (醋酸)(填“>”“<”或“=”)。
(醋酸)(填“>”“<”或“=”)。(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示:
| 化学式 |  |  |  |
| 电离平衡常数 |  |  | 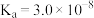 |
A. |
B. |
C. |
D.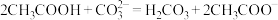 |
您最近一年使用:0次
2023-04-24更新
|
489次组卷
|
2卷引用:山东省济宁市育才中学2022-2023学年高二上学期第二次学情检测化学试题
4 . 人体内尿酸(HUr)含量偏高,关节滑液中产生尿酸钠晶体(NaUr)会引发痛风和关节炎,有关平衡有:①HUr(尿酸,aq) (尿酸根,aq)
(尿酸根,aq) 、
、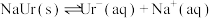 ②。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
②。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
已知:①37℃时, ,
, ,
,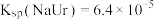 。
。
②37℃时,模拟关节滑液pH=7.4, 。
。
(1)37℃时, HUr溶液的pH约为
HUr溶液的pH约为_______ (已知 )。
)。
(2)下列事实可以证明尿酸是弱电解质的是_______(填字母)。
(3)37℃时,向HUr溶液中加入NaOH溶液配制“模拟关节滑液”,溶液中
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(4)37℃时,向模拟关节滑液中加入NaCl(s)至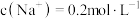 时,通过计算判断是否有NaUr晶体析出,请写出判断过程:
时,通过计算判断是否有NaUr晶体析出,请写出判断过程:_______ 。
(5)关节炎发作大都在脚趾和手指的关节处,反应②是_______ (填“放热”或“吸热”)反应。
(6)对于尿酸偏高的人群,下列建议正确的是_______(填字母)。
 (尿酸根,aq)
(尿酸根,aq) 、
、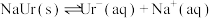 ②。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
②。某课题组配制“模拟关节滑液”进行研究,回答下列问题:已知:①37℃时,
 ,
, ,
,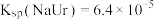 。
。②37℃时,模拟关节滑液pH=7.4,
 。
。(1)37℃时,
 HUr溶液的pH约为
HUr溶液的pH约为 )。
)。(2)下列事实可以证明尿酸是弱电解质的是_______(填字母)。
| A.NaUr溶液显碱性 |
| B.HUr溶液可使石蕊溶液变红 |
| C.常温下,等浓度的尿酸溶液导电性比盐酸弱 |
D.10mL 溶液与10mL 溶液与10mL NaOH溶液完全反应 NaOH溶液完全反应 |

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(4)37℃时,向模拟关节滑液中加入NaCl(s)至
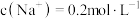 时,通过计算判断是否有NaUr晶体析出,请写出判断过程:
时,通过计算判断是否有NaUr晶体析出,请写出判断过程:(5)关节炎发作大都在脚趾和手指的关节处,反应②是
(6)对于尿酸偏高的人群,下列建议正确的是_______(填字母)。
| A.多喝水,食用新鲜蔬果 |
| B.饮食宜多盐、多脂 |
| C.适度运动,注意关节保暖 |
| D.减少摄入易代谢出尿酸的食物 |
您最近一年使用:0次
2022-12-16更新
|
109次组卷
|
2卷引用:山西省运城市教育发展联盟20222023学年高二上学期12月联考化学试题
5 . 弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问题:
(1)生活中明矾常作净水剂,其净水的原理是_______ (用离子方程式表示)。
(2)某温度下, 和
和 的电离常数数值相等,物质的量浓度相同的
的电离常数数值相等,物质的量浓度相同的 溶液和氨水混合后,溶液中
溶液和氨水混合后,溶液中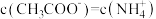 ,则所加入
,则所加入 溶液的体积
溶液的体积_______ (填“大于”“小于”或“等于”)氨水的体积。
(3)常温下,取 溶液与
溶液与 溶液等体积混合,测得混合后溶液的
溶液等体积混合,测得混合后溶液的 。写出
。写出 的电离方程式
的电离方程式_______ ,并写出所得溶液中离子浓度大小关系_______ 。
(4)含 的废水毒性较大,某工厂废水中含
的废水毒性较大,某工厂废水中含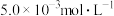 的
的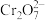 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理:

①绿矾为 ,反应(I)中
,反应(I)中 与
与 的物质的量之比为
的物质的量之比为_______ 。
②常温下若处理后的废水中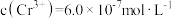 ,则处理后的废水的pH=
,则处理后的废水的pH=_______ 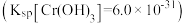 。
。
(1)生活中明矾常作净水剂,其净水的原理是
(2)某温度下,
 和
和 的电离常数数值相等,物质的量浓度相同的
的电离常数数值相等,物质的量浓度相同的 溶液和氨水混合后,溶液中
溶液和氨水混合后,溶液中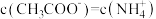 ,则所加入
,则所加入 溶液的体积
溶液的体积(3)常温下,取
 溶液与
溶液与 溶液等体积混合,测得混合后溶液的
溶液等体积混合,测得混合后溶液的 。写出
。写出 的电离方程式
的电离方程式(4)含
 的废水毒性较大,某工厂废水中含
的废水毒性较大,某工厂废水中含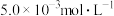 的
的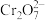 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理:
①绿矾为
 ,反应(I)中
,反应(I)中 与
与 的物质的量之比为
的物质的量之比为②常温下若处理后的废水中
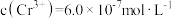 ,则处理后的废水的pH=
,则处理后的废水的pH=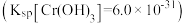 。
。
您最近一年使用:0次
6 . 现有下列物质 ①熔化的NaCl ②盐酸 ③氯气 ④冰醋酸 ⑤铜 ⑥酒精 ⑦硫酸氢钠 ⑧液氨 ⑨SO2,请按要求回答下列问题。
(1)属于强电解质的是_______ (填序号)
(2)在上述状态下能导电的是_______ (填序号)
(3)属于弱电解质的是_______ (填序号)
(4)属于非电解质,但溶于水后的水溶液能导电的是_______ (填序号)
(5)可以证明④是弱酸的事实是_______(填序号)
(6)有下列物质的溶液:a.CH3COOH、b.HCl、c.H2SO4、d.NaHSO4,若四种溶液的物质的量浓度相同,其由水电离c(H+)由大到小顺序为_______ (用字母序号表示,下同)。若四种溶液的c(H+)相同,其物质的量浓度由大到小顺序为_______ 。
(7)常温下,有 相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是
相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是_______ (填字母)。(①表示盐酸,②表示醋酸)
a.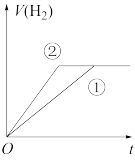 b.
b. 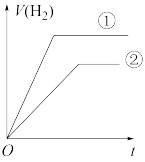 c.
c. 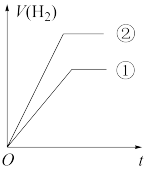 d.
d. 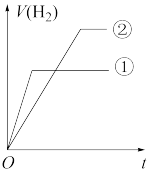
(1)属于强电解质的是
(2)在上述状态下能导电的是
(3)属于弱电解质的是
(4)属于非电解质,但溶于水后的水溶液能导电的是
(5)可以证明④是弱酸的事实是_______(填序号)
| A.乙酸和水能以任意比例混溶 |
| B.在乙酸水溶液中含有未电离的乙酸分子 |
| C.乙酸与Na2CO3溶液反应放出CO2气体 |
| D.1 mol·L-1的乙酸水溶液能使紫色石蕊溶液变红色 |
(7)常温下,有
 相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是
相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是a.
 b.
b.  c.
c.  d.
d. 
您最近一年使用:0次
2022-12-06更新
|
532次组卷
|
7卷引用:宁夏银川市第二中学2021-2022学年高二下学期第一次月考化学试题
宁夏银川市第二中学2021-2022学年高二下学期第一次月考化学试题(已下线)1.2.1 电解质及其电离(好题帮)-备战2023年高考化学一轮复习考点帮(新教材新高考)(已下线)3.1.1 电离平衡-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)湖北省武汉市武钢三中2022-2023学年高二上学期第一次月考化学试题广东省清远市四校联盟2022-2023学年高二上学期期中考试化学试题广东省广州市第三中学2022-2023学年高二上学期期末测试化学试题四川省成都市第八中学校2022-2023学年高二上学期11月期中考试化学试题
名校
解题方法
7 . 常温下,有四种溶液:
①0.1 mol·L-1 CH3COOH溶液 ②0.1 mol·L-1 CH3COONa溶液 ③0.1 mol·L-1 NaHSO3溶液④0.1 mol·L-1 NaHCO3溶液
(1)溶液①的pH____ (填“>”“<”或“=”)7,溶液中离子的电荷守恒关系式是___ 。
(2)溶液②呈______ (填“酸”“碱”或“中”)性。其原因是___ (用离子方程式说明)。
(3)下列有关①和②两种溶液的说法正确的是____ (填字母)。
a. 两种溶液中c(CH3COO-) 都小于0.1 mol·L-1
b. 两种溶液中c(CH3COO-) 都等于0.1 mol·L-1
c. CH3COOH溶液中c(CH3COO-) 小于CH3COONa溶液中c(CH3COO-)
(4)NaHCO3溶液的pH>7,NaHSO3溶液的pH<7,则,NaHCO3溶液中c(H2CO3)______ (填“>”“<”或“=”,下同)c( ),NaHSO3溶液中c(H2SO3)
),NaHSO3溶液中c(H2SO3)____ c( )
)
①0.1 mol·L-1 CH3COOH溶液 ②0.1 mol·L-1 CH3COONa溶液 ③0.1 mol·L-1 NaHSO3溶液④0.1 mol·L-1 NaHCO3溶液
(1)溶液①的pH
(2)溶液②呈
(3)下列有关①和②两种溶液的说法正确的是
a. 两种溶液中c(CH3COO-) 都小于0.1 mol·L-1
b. 两种溶液中c(CH3COO-) 都等于0.1 mol·L-1
c. CH3COOH溶液中c(CH3COO-) 小于CH3COONa溶液中c(CH3COO-)
(4)NaHCO3溶液的pH>7,NaHSO3溶液的pH<7,则,NaHCO3溶液中c(H2CO3)
 ),NaHSO3溶液中c(H2SO3)
),NaHSO3溶液中c(H2SO3) )
)
您最近一年使用:0次
2022-12-05更新
|
581次组卷
|
9卷引用:广东省广州市第八十六中学2022-2023学年高二上学期期中考试化学试题
广东省广州市第八十六中学2022-2023学年高二上学期期中考试化学试题黑龙江省哈尔滨市宾县第二中学2022-2023学年高二上学期期中考试化学试题江苏省海安市2020-2021学年高二上学期期中考试化学试题(已下线)第03章 水溶液中的离子反应与平衡(A卷基础强化篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)云南省通海县一中2020-2021学年高二下学期期中考试化学试题(已下线)第3章 水溶液中的离子反应与平衡(基础过关卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)【石家庄新东方】2021-2022石家庄23中高二10月月考化学试题辽宁省朝阳市建平县高级中学2021-2022学年高二上学期第二次月考化学试题(已下线)专题突破卷09 水溶液中的离子反应与平衡 ?-2024年高考化学一轮复习考点通关卷(新教材新高考)
8 . I.现有以下物质:①NaCl晶体② ③液态醋酸④铜⑤固体
③液态醋酸④铜⑤固体 ⑥纯蔗糖(
⑥纯蔗糖( )⑦乙醇(
)⑦乙醇( )⑧熔化的
)⑧熔化的 ⑨盐酸⑩液氨。请回答下列问题(填相应序号):
⑨盐酸⑩液氨。请回答下列问题(填相应序号):
(1)以上物质能导电的是_______ ;
(2)以上物质属于非电解质的是_______ ;
(3)以上物质属于强电解质的是_______ 。
II.在一定温度下,冰醋酸稀释过程中溶液的导电能力变化如图所示,请填写下列空白。

(4)加水前导电能力约为零的原因是_______ 。
(5)写出醋酸电离方程式_______ 。
(6)a、b、c三点对应的溶液中,pH最大的是_______ 。
(7)若使b点对应的溶液中 增大,可采用的方法是
增大,可采用的方法是_______ (填序号)。
①加入 ②加入NaOH固体 ③加入
②加入NaOH固体 ③加入 固体 ④加入Zn粒
固体 ④加入Zn粒
 ③液态醋酸④铜⑤固体
③液态醋酸④铜⑤固体 ⑥纯蔗糖(
⑥纯蔗糖( )⑦乙醇(
)⑦乙醇( )⑧熔化的
)⑧熔化的 ⑨盐酸⑩液氨。请回答下列问题(填相应序号):
⑨盐酸⑩液氨。请回答下列问题(填相应序号):(1)以上物质能导电的是
(2)以上物质属于非电解质的是
(3)以上物质属于强电解质的是
II.在一定温度下,冰醋酸稀释过程中溶液的导电能力变化如图所示,请填写下列空白。

(4)加水前导电能力约为零的原因是
(5)写出醋酸电离方程式
(6)a、b、c三点对应的溶液中,pH最大的是
(7)若使b点对应的溶液中
 增大,可采用的方法是
增大,可采用的方法是①加入
 ②加入NaOH固体 ③加入
②加入NaOH固体 ③加入 固体 ④加入Zn粒
固体 ④加入Zn粒
您最近一年使用:0次
9 . 回答下列问题:
(1)常温下,向20 mL 0.010 mol·L-1的HA溶液中逐滴加入0.010 mol·L-1的NaOH溶液,溶液中lg c(OH-)与所加NaOH溶液的体积(V)的关系如图。
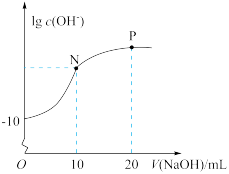
HA是__________ (“强酸”或“弱酸”)。N点溶液中2c(H+)-2c(OH-)=____________ (用含A微粒的符号表示)
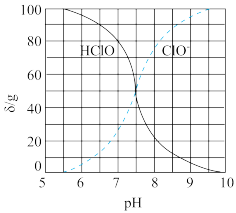
(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ(X)= ,X为HClO或ClO-与pH的关系如图所示。HClO的电离常数Ka值为
,X为HClO或ClO-与pH的关系如图所示。HClO的电离常数Ka值为__________ 。常温下向0.1 mol·L-1的HClO溶液中加入等体积的0.1mol·L-1的NaOH溶液后,c(ClO-)+c(HClO)=__________ mol·L-1。
(3)PH相同、等体积的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是____ (填序号)。
①反应所需要的时间B>A ②开始反应时的速率A>B
③参加反应的锌的物质的量A=B ④反应过程的平均速率B>A
⑤A中有锌剩余 ⑥B中有锌剩余
(4)已知草酸为二元弱酸:H2C2O4 HC2O
HC2O +H+ Ka1,HC2O
+H+ Ka1,HC2O
 C2O
C2O +H+ Ka2,常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O
+H+ Ka2,常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O 、C2O
、C2O 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。
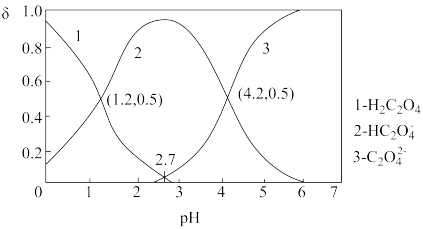
①则常温下0.1 mol/L的NaHC2O4溶液显_________ 填酸性、碱性或中性)
②pH=2.7时,溶液中 =
=______ 。
(1)常温下,向20 mL 0.010 mol·L-1的HA溶液中逐滴加入0.010 mol·L-1的NaOH溶液,溶液中lg c(OH-)与所加NaOH溶液的体积(V)的关系如图。

HA是
(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ(X)=
 ,X为HClO或ClO-与pH的关系如图所示。HClO的电离常数Ka值为
,X为HClO或ClO-与pH的关系如图所示。HClO的电离常数Ka值为
(3)PH相同、等体积的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是
①反应所需要的时间B>A ②开始反应时的速率A>B
③参加反应的锌的物质的量A=B ④反应过程的平均速率B>A
⑤A中有锌剩余 ⑥B中有锌剩余
(4)已知草酸为二元弱酸:H2C2O4
 HC2O
HC2O +H+ Ka1,HC2O
+H+ Ka1,HC2O
 C2O
C2O +H+ Ka2,常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O
+H+ Ka2,常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O 、C2O
、C2O 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。
①则常温下0.1 mol/L的NaHC2O4溶液显
②pH=2.7时,溶液中
 =
=
您最近一年使用:0次
2022-11-21更新
|
327次组卷
|
3卷引用:宁夏回族自治区银川一中2022-2023学年高二上学期期中考试化学试题
10 . 溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用化学方程式表示盐碱地产生碱性的原因:_______ ;
(2)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m_______ n。
(3)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中水电离出来的c(OH-)=_______ 。
(4)25℃时,将a mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,反应平衡时溶液中c(NH )=c(Cl-),则溶液显
)=c(Cl-),则溶液显_______ (填酸,碱或中)性。用含a的代数式表示NH3·H2O的电离常数Kb=_______ 。
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用化学方程式表示盐碱地产生碱性的原因:
(2)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m
(3)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中水电离出来的c(OH-)=
(4)25℃时,将a mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,反应平衡时溶液中c(NH
 )=c(Cl-),则溶液显
)=c(Cl-),则溶液显
您最近一年使用:0次



