名校
解题方法
1 . 常温下,有四种溶液:
①0.1 mol·L-1 CH3COOH溶液 ②0.1 mol·L-1 CH3COONa溶液 ③0.1 mol·L-1 NaHSO3溶液④0.1 mol·L-1 NaHCO3溶液
(1)溶液①的pH____ (填“>”“<”或“=”)7,溶液中离子的电荷守恒关系式是___ 。
(2)溶液②呈______ (填“酸”“碱”或“中”)性。其原因是___ (用离子方程式说明)。
(3)下列有关①和②两种溶液的说法正确的是____ (填字母)。
a. 两种溶液中c(CH3COO-) 都小于0.1 mol·L-1
b. 两种溶液中c(CH3COO-) 都等于0.1 mol·L-1
c. CH3COOH溶液中c(CH3COO-) 小于CH3COONa溶液中c(CH3COO-)
(4)NaHCO3溶液的pH>7,NaHSO3溶液的pH<7,则,NaHCO3溶液中c(H2CO3)______ (填“>”“<”或“=”,下同)c(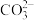 ),NaHSO3溶液中c(H2SO3)
),NaHSO3溶液中c(H2SO3)____ c(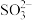 )
)
①0.1 mol·L-1 CH3COOH溶液 ②0.1 mol·L-1 CH3COONa溶液 ③0.1 mol·L-1 NaHSO3溶液④0.1 mol·L-1 NaHCO3溶液
(1)溶液①的pH
(2)溶液②呈
(3)下列有关①和②两种溶液的说法正确的是
a. 两种溶液中c(CH3COO-) 都小于0.1 mol·L-1
b. 两种溶液中c(CH3COO-) 都等于0.1 mol·L-1
c. CH3COOH溶液中c(CH3COO-) 小于CH3COONa溶液中c(CH3COO-)
(4)NaHCO3溶液的pH>7,NaHSO3溶液的pH<7,则,NaHCO3溶液中c(H2CO3)
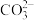 ),NaHSO3溶液中c(H2SO3)
),NaHSO3溶液中c(H2SO3)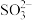 )
)
您最近一年使用:0次
2022-12-05更新
|
581次组卷
|
9卷引用:江苏省海安市2020-2021学年高二上学期期中考试化学试题
江苏省海安市2020-2021学年高二上学期期中考试化学试题(已下线)第03章 水溶液中的离子反应与平衡(A卷基础强化篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)云南省通海县一中2020-2021学年高二下学期期中考试化学试题(已下线)第3章 水溶液中的离子反应与平衡(基础过关卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)【石家庄新东方】2021-2022石家庄23中高二10月月考化学试题辽宁省朝阳市建平县高级中学2021-2022学年高二上学期第二次月考化学试题广东省广州市第八十六中学2022-2023学年高二上学期期中考试化学试题(已下线)专题突破卷09 水溶液中的离子反应与平衡 ?-2024年高考化学一轮复习考点通关卷(新教材新高考)黑龙江省哈尔滨市宾县第二中学2022-2023学年高二上学期期中考试化学试题
名校
2 . 已知如表数据(25℃):
(1)25℃时,将等体积等浓度的醋酸和氨水混合,混合溶液的pH___ 7(填“>”、“=”或“<”,该混合溶液中水的电离会受到____ (填“促进”、“抑制”、“既不促进也不抑制”)。
(2)NaCN溶液呈___ 性,用离子方程式解释原因____ 。
(3)25℃时,相同物质的量浓度的下列溶液①CH3COOH②NH3·H2O③NaCN④Na2CO3⑤H2A中pH由大到小的顺序是___ (填序号)。
(4)下列溶液中,分别是由等体积0.1mol/L的2种溶液混合而成.①NH4Cl和H2A②NH4Cl和Na2CO3③NH4Cl和CH3COONa溶液中NH3·H2O浓度由大到小的排列顺序是:____ 。(用序号排列)
(5)写出泡沫灭火器原理____ (离子方程式)。
(6)现有浓度为0.02mol/L的HCN溶液与0.01mol/LNaOH溶液等体积混合之后(忽略混合过程中溶液体积的改变),测得c(Na+)>c(CN-),下列关系正确的是___ 。
| 物质 | CH3COOH | NH3·H2O | HCN | H2CO3 | H2A |
| 电离常数(K) | 1.7×10-5 | 1.7×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 | K1=1×106 K2=1×10-2 |
(1)25℃时,将等体积等浓度的醋酸和氨水混合,混合溶液的pH
(2)NaCN溶液呈
(3)25℃时,相同物质的量浓度的下列溶液①CH3COOH②NH3·H2O③NaCN④Na2CO3⑤H2A中pH由大到小的顺序是
(4)下列溶液中,分别是由等体积0.1mol/L的2种溶液混合而成.①NH4Cl和H2A②NH4Cl和Na2CO3③NH4Cl和CH3COONa溶液中NH3·H2O浓度由大到小的排列顺序是:
(5)写出泡沫灭火器原理
(6)现有浓度为0.02mol/L的HCN溶液与0.01mol/LNaOH溶液等体积混合之后(忽略混合过程中溶液体积的改变),测得c(Na+)>c(CN-),下列关系正确的是
| A.c(H+)>c(OH-) |
| B.c(HCN)>c(CN-) |
| C.c(H+)+c(HCN)=c(OH-)+c(CN-) |
| D.c(HCN)+c(CN-)=0.01mol/L |
您最近一年使用:0次
2022-03-16更新
|
226次组卷
|
3卷引用:天津市滨海新区大港油田第三中学2020-2021学年高二上学期期中考试化学试题
3 . 水是生命的源泉、工业的血液、城市的命脉。河水是主要的饮用水源,污染物通过饮用水可宵接毒害人体,也可通过食物链和灌溉农田间接危及健康。请回答下列问题:
(1)纯水在100℃时,pH=6,该温度下1mol·L-1的NaOH溶液中,由水电离出的c(OH-)=_____ mol·L-1。
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为___________ 。
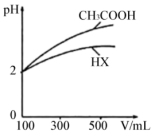
(3)体积均为100mLpH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则相同温度时,HX的电离平衡常数___________ (填“大于”或“小于”或“等于”)CH3COOH的电离平衡常数,理由是___________ 。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
①25℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三种溶液的pH由大到小的顺序为___________ 。
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为___________ 。
(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=___________ mol·L-1(填精确值)。
(1)纯水在100℃时,pH=6,该温度下1mol·L-1的NaOH溶液中,由水电离出的c(OH-)=
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为
(3)体积均为100mLpH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则相同温度时,HX的电离平衡常数

(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为
(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=
您最近一年使用:0次
2021-12-25更新
|
358次组卷
|
7卷引用:河南省洛阳市2019-2020学年高二上学期期末考试化学试题
河南省洛阳市2019-2020学年高二上学期期末考试化学试题(已下线)3.2.1 水的电离 溶液的酸碱性与pH 练习-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)山东省2021-2022学年高二12月“山东学情”联考(鲁科版)化学试题江西省赣州市信丰中学2021-2022学年高二下学期A+班段考化学试题江西省吉安市2021-2022学年高二上学期期末教学质量检测化学试题甘肃省白银市白银区大成学校2022-2023学年高二下学期开学考试(上期末)化学试题四川省江油市太白中学2023-2024学年高二下学期开学考试化学试题
4 . 最近几年雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一、
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g) 2CO2(g)+N2(g),在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。据此判断:
2CO2(g)+N2(g),在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。据此判断:

①该反应的ΔH___________ 0(选填“>”、“<”)。
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在图甲中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线________ 。
③研究表明在紫外线照射下,由于TiO2的催化作用,空气中的某些物质会产生OH自由基,如图乙所示,OH与NO2反应为NO2+OH=HNO3,写出NO与OH反应的化学方程式___________ 。

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。NH3与CO2在120oC,催化剂作用下反应生成尿素:CO2(g)+2NH3(g)⇌(NH2)2CO(s)+H2O(g)。现将物质的量为1︰1的NH3与CO2混合在密闭固体容器中反应,平衡后,NH3的体积分数为20%,则NH3的平衡转化率为___________ 。
②25℃时,将amol•L-1的氨水与bmol•L-1盐酸等体积混合,反应后溶液恰好显中性,用a、b表示NH3•H2O的电离平衡常数为___________ 。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)
 2CO2(g)+N2(g),在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。据此判断:
2CO2(g)+N2(g),在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。据此判断:
①该反应的ΔH
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在图甲中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线
③研究表明在紫外线照射下,由于TiO2的催化作用,空气中的某些物质会产生OH自由基,如图乙所示,OH与NO2反应为NO2+OH=HNO3,写出NO与OH反应的化学方程式

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。NH3与CO2在120oC,催化剂作用下反应生成尿素:CO2(g)+2NH3(g)⇌(NH2)2CO(s)+H2O(g)。现将物质的量为1︰1的NH3与CO2混合在密闭固体容器中反应,平衡后,NH3的体积分数为20%,则NH3的平衡转化率为
②25℃时,将amol•L-1的氨水与bmol•L-1盐酸等体积混合,反应后溶液恰好显中性,用a、b表示NH3•H2O的电离平衡常数为
您最近一年使用:0次
5 . 25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)H2CO3的第二级电离平衡常数的表达式K2=___________ 。
(2)相同温度下,等pH的CH3COONa溶液、NaHCO3溶液和Na2SO3溶液,三种溶液的物质的量浓度c(CH3COONa)、c(NaHCO3)、c(Na2SO3)由大到小排序为___________ 。
(3)25℃时,向0.1mol•L﹣1的氨水中缓缓通入少量CO2气体的过程中(忽略溶液体积的变化), 将
将___________ 。(填增大、减小、不变)
(4)能证明醋酸是弱酸的实验事实是___________ (填写序号)。
①相同条件下,浓度均为0.1mol•L﹣1的盐酸和醋酸,醋酸的导电能力更弱
②25℃时,一定浓度的CH3COOH、CH3COONa混合溶液的pH等于7
③CH3COOH溶液能与NaHCO3反应生成CO2
④0.1mol·L﹣1CH3COOH溶液可使紫色石蕊试液变红
(5)向冰醋酸中逐滴加水,溶液导电能力随加入水的体积变化如图所示。

①a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是___________ 。
②25℃,a、c两点对应的溶液分别吸收氨气,若两溶液最终pH均为7,则a点溶液中的c(CH3COO﹣)___________ c点溶液中的c(NH )。(填“大于”、“小于”或“等于”)。
)。(填“大于”、“小于”或“等于”)。
| 化学式 | CH3COOH | NH3•H2O | H2CO3 | H2SO3 |
| 电离平衡常数 | 1.7×10﹣5 | 1.7×10﹣5 | K1=4.3×10﹣7 K2=5.6×10﹣11 | K1=1.3×10﹣2 K2=6.3×10﹣8 |
请回答下列问题:
(1)H2CO3的第二级电离平衡常数的表达式K2=
(2)相同温度下,等pH的CH3COONa溶液、NaHCO3溶液和Na2SO3溶液,三种溶液的物质的量浓度c(CH3COONa)、c(NaHCO3)、c(Na2SO3)由大到小排序为
(3)25℃时,向0.1mol•L﹣1的氨水中缓缓通入少量CO2气体的过程中(忽略溶液体积的变化),
 将
将(4)能证明醋酸是弱酸的实验事实是
①相同条件下,浓度均为0.1mol•L﹣1的盐酸和醋酸,醋酸的导电能力更弱
②25℃时,一定浓度的CH3COOH、CH3COONa混合溶液的pH等于7
③CH3COOH溶液能与NaHCO3反应生成CO2
④0.1mol·L﹣1CH3COOH溶液可使紫色石蕊试液变红
(5)向冰醋酸中逐滴加水,溶液导电能力随加入水的体积变化如图所示。

①a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是
②25℃,a、c两点对应的溶液分别吸收氨气,若两溶液最终pH均为7,则a点溶液中的c(CH3COO﹣)
 )。(填“大于”、“小于”或“等于”)。
)。(填“大于”、“小于”或“等于”)。
您最近一年使用:0次
6 . 表是几种常见物质的电离平衡常数 。
。
回答下列问题:
(1)NaHS溶液中存在的平衡有_______  用方程式表示
用方程式表示
(2)上述所列酸中酸性最强的是_______
(3)若 与
与 等体积混合,当
等体积混合,当 时,混合后溶液呈
时,混合后溶液呈_______ 性;若 时,
时,
________ 
(4)NaH2PO4溶液中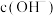
__________  ,其理由是
,其理由是_______
(5)实验测得某 和
和 混合溶液的
混合溶液的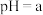 ,则该溶液中
,则该溶液中
_______
(6)过量的 与
与 反应的离子方程式为
反应的离子方程式为_______
 。
。| 电解质 |  |  |  |  |  |
电离平衡常数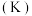 | K | K K  | K K  K  | K , ,K  | K=1.76×10-5 |
回答下列问题:
(1)NaHS溶液中存在的平衡有
 用方程式表示
用方程式表示
(2)上述所列酸中酸性最强的是
(3)若
 与
与 等体积混合,当
等体积混合,当 时,混合后溶液呈
时,混合后溶液呈 时,
时,

(4)NaH2PO4溶液中
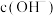
 ,其理由是
,其理由是(5)实验测得某
 和
和 混合溶液的
混合溶液的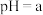 ,则该溶液中
,则该溶液中
(6)过量的
 与
与 反应的离子方程式为
反应的离子方程式为
您最近一年使用:0次
7 . 人体内尿酸(HUr)含量偏高,关节滑液中产生尿酸钠晶体(NaUr)会引发痛风,NaUr(s)  Na+(aq)+Ur−(aq) ∆H >0。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
Na+(aq)+Ur−(aq) ∆H >0。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
已知:①37℃时,Ka(HUr) = 4×10−6,Kw = 2.4×10−14,Ksp(NaUr) = 6.4×10−5
②37℃时,模拟关节滑液pH =7.4,c(Ur-) =4.6×10−4 mol∙L−1
(1)尿酸电离方程式为_______
(2)Kh为盐的水解常数,37℃时,Kh(Ur−)=_______ 。
(3)37℃时,向HUr溶液中加入NaOH溶液配制“模拟关节滑液”,溶液中c(Na+)_______ c(Ur−) (填“>”、“<”或“=”)。
(4)37℃时,向模拟关节滑液中加入NaCl(s)至c(Na+) = 0.2 mol∙L−1时,通过计算判断是否有NaUr晶体析出,请写出判断过程_______
(5)对于尿酸偏高的人群,下列建议正确的是_______ 。
a.加强锻炼,注意关节保暖 b.多饮酒,利用乙醇杀菌消毒
c.多喝水,饮食宜少盐、少脂 d.减少摄入易代谢出尿酸的食物
 Na+(aq)+Ur−(aq) ∆H >0。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
Na+(aq)+Ur−(aq) ∆H >0。某课题组配制“模拟关节滑液”进行研究,回答下列问题:已知:①37℃时,Ka(HUr) = 4×10−6,Kw = 2.4×10−14,Ksp(NaUr) = 6.4×10−5
②37℃时,模拟关节滑液pH =7.4,c(Ur-) =4.6×10−4 mol∙L−1
(1)尿酸电离方程式为
(2)Kh为盐的水解常数,37℃时,Kh(Ur−)=
(3)37℃时,向HUr溶液中加入NaOH溶液配制“模拟关节滑液”,溶液中c(Na+)
(4)37℃时,向模拟关节滑液中加入NaCl(s)至c(Na+) = 0.2 mol∙L−1时,通过计算判断是否有NaUr晶体析出,请写出判断过程
(5)对于尿酸偏高的人群,下列建议正确的是
a.加强锻炼,注意关节保暖 b.多饮酒,利用乙醇杀菌消毒
c.多喝水,饮食宜少盐、少脂 d.减少摄入易代谢出尿酸的食物
您最近一年使用:0次
2021-05-27更新
|
709次组卷
|
7卷引用:海南省海口市2020届高三6月等级模拟试卷化学试题
海南省海口市2020届高三6月等级模拟试卷化学试题(已下线)第03章 物质在水溶液中的行为(A卷基础强化卷)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材鲁科版)海南省北京师范大学万宁附属中学2021届高三上学期第一次月考化学试题福建省福州一中2021届高三第五次模拟考试化学试题(已下线)第25讲 盐类水解(精练)-2022年高考化学一轮复习讲练测(已下线)第25讲 盐类水解(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第4讲 盐类的水解
8 . 25℃时,三种酸的电离平衡常数如下表:
(1)CH3COOH溶液中存在电离平衡:CH3COOH⇌CH3CH3COO-+H+,下列方法中,可以使0.10mol•L−1CH3COOH溶液中CH3COOH电离程度增大的是_______ 。
a.加入少量稀盐酸 b.加入少量冰醋酸
c.加入少量醋酸钠固体 d.加入少量碳酸钠固体
(2)常温下0.1mol•L−1的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是___ 。
a.c(H+) b. c.c(H+)•c(OH-) d.
c.c(H+)•c(OH-) d.
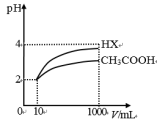
(3)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图所示。则HX的电离平衡常数___ (填“大于”、“等于”或“小于”,下同)醋酸的平衡常数;稀释后,HX溶液中水电离出来的c(H+)__ 醋酸溶液水电离出来的c(H+)。
(4)等物质的量浓度的下列溶液:①Na2CO3;②NaClO;③CH3COONa;④NaHCO3的pH由大到小的顺序是____ (填序号)。
(5)写出往NaClO溶液中通少量CO2的离子方程式:____ 。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | 3.0×10-8 |
a.加入少量稀盐酸 b.加入少量冰醋酸
c.加入少量醋酸钠固体 d.加入少量碳酸钠固体
(2)常温下0.1mol•L−1的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是
a.c(H+) b.
 c.c(H+)•c(OH-) d.
c.c(H+)•c(OH-) d.
(3)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图所示。则HX的电离平衡常数

(4)等物质的量浓度的下列溶液:①Na2CO3;②NaClO;③CH3COONa;④NaHCO3的pH由大到小的顺序是
(5)写出往NaClO溶液中通少量CO2的离子方程式:
您最近一年使用:0次
9 . 一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示。请完成下列问题:

(1)“O”点为什么不导电_______ 。
(2)a、b、c三点pH由大到小的顺序为_______ 。
(3)a、b、c三点中醋酸的电离程度最大的点是_______ 点。
(4)若使c点溶液中c(CH3COO-)提高,可以采取的措施有①_______ ,②_______ ,③_______ ,④_______ ,⑤_______ 。

(1)“O”点为什么不导电
(2)a、b、c三点pH由大到小的顺序为
(3)a、b、c三点中醋酸的电离程度最大的点是
(4)若使c点溶液中c(CH3COO-)提高,可以采取的措施有①
您最近一年使用:0次
解题方法
10 . (1)某温度(t°C)时纯水的pH=6.5,则该温度(填大于、小于或等于)____ 25°C,其理由是___ 。将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合,若所得混合液为中性,则a:b=__ 。
(2)下表1是常温下几种弱酸的电离常数(K),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1
表2
请回答下列问题:
①会使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是___________ 。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
②常温下,相同物质的量浓度的表1中四种酸的钠盐pH由大到小的顺序是___________ (填钠盐的化学式)。若将pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液中各离子浓度由大到小的排列顺序是___________ ,此时溶液中的电荷守恒式为___________ 。
(2)下表1是常温下几种弱酸的电离常数(K),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1
| 酸 | 电离常数(K) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
表2
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1×10-10 |
| BaCO3 | 2.6×10-9 |
| CaSO4 | 7×10-5 |
| CaCO3 | 5×10-9 |
请回答下列问题:
①会使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
②常温下,相同物质的量浓度的表1中四种酸的钠盐pH由大到小的顺序是
您最近一年使用:0次



