1 . 氨气溶于水可得氨水。氨水呈_______ 。
A.酸性 B.中性 C.碱性
A.酸性 B.中性 C.碱性
您最近一年使用:0次
2 . 硼及其化合物在制造、化工等领域都有广泛应用,回答下列问题:
(1)基态硼原子的价电子排布图为__________ ,其占据最高能级电子的电子云轮廓图形状为__________ ,基态硼原子比基态氮原子的第一电离能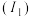 小,其原因为
小,其原因为__________ 。
(2) 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得:
反应制得:
① 由
由 和
和 构成,
构成, 的空间结构为
的空间结构为__________ 。
② 中B原子的杂化轨道类型为
中B原子的杂化轨道类型为__________ 。
③ 的键角为
的键角为__________ 。
(3)写出B与 溶液反应的离子方程式:
溶液反应的离子方程式:__________ 。
(4) 为一元弱酸[常温下,
为一元弱酸[常温下,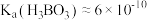 ]:
]:
① 与
与 溶液反应的离子方程式为
溶液反应的离子方程式为__________ 。
②常温下, 的硼酸的pH约为
的硼酸的pH约为__________ (已知: ,
, )。
)。
(1)基态硼原子的价电子排布图为
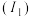 小,其原因为
小,其原因为(2)
 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得:
反应制得:①
 由
由 和
和 构成,
构成, 的空间结构为
的空间结构为②
 中B原子的杂化轨道类型为
中B原子的杂化轨道类型为③
 的键角为
的键角为(3)写出B与
 溶液反应的离子方程式:
溶液反应的离子方程式:(4)
 为一元弱酸[常温下,
为一元弱酸[常温下,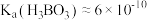 ]:
]:①
 与
与 溶液反应的离子方程式为
溶液反应的离子方程式为②常温下,
 的硼酸的pH约为
的硼酸的pH约为 ,
, )。
)。
您最近一年使用:0次
2024-03-07更新
|
128次组卷
|
2卷引用:河北省邢台市四校联盟2023-2024学年高二上学期11月月考化学试题
名校
3 . 按要求完成下列内容:
(1)书写下列物质的电离方程式:
①磷酸___________ ;②氢氧化铁___________ ;③碳酸氢钠___________ ;
④明矾___________ ;⑤氢氟酸___________ ;⑥硫酸氢铵___________ 。
(2)书写下列离子方程式
①泡沫灭火器工作原理___________ 。
②碳酸氢钠溶液与过量澄清石灰水反应___________ 。
③酸性高锰酸钾溶液中通入二氧化硫气体___________ 。
(3)书写下列电化学方程式或电极反应式:
①电解法制备金属铝的总反应___________ 。
②电解精炼铜的阴极反应式___________ 。
③氯碱工业总反应___________ 。
④碱性(KOH)氢氧燃料电池的负极反应式___________ 。
(1)书写下列物质的电离方程式:
①磷酸
④明矾
(2)书写下列离子方程式
①泡沫灭火器工作原理
②碳酸氢钠溶液与过量澄清石灰水反应
③酸性高锰酸钾溶液中通入二氧化硫气体
(3)书写下列电化学方程式或电极反应式:
①电解法制备金属铝的总反应
②电解精炼铜的阴极反应式
③氯碱工业总反应
④碱性(KOH)氢氧燃料电池的负极反应式
您最近一年使用:0次
名校
4 . 工业排放的某些烟气中含有二氧化硫等大气污染物,对其进行脱硫治理不仅可以防止有害物质排放,还可以生产其他有用的产品。
(1) 分子的空间结构和分子的极性分别为___________。
分子的空间结构和分子的极性分别为___________。
(2)第一电离能: ,结合核外电子排布相关知识,说明其原因
,结合核外电子排布相关知识,说明其原因___________ 。
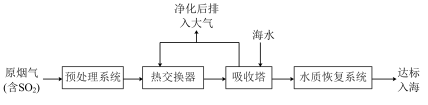
沿海地区的某煤电厂开发出海水脱硫的新工艺,流程如下图所示: ,
, 的电离常数如下表所示:
的电离常数如下表所示:
(3)在吸收塔内,烟气应从吸收塔的___________ 通入,与塔顶喷淋的海水充分接触。
A.上部 B.中部 C.下部
(4)吸收塔内温度不宜过高,原因可能是___________ 。(列举1条)吸收塔内 和海水中
和海水中 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(5)若煤电厂排放烟气量为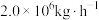 ,其中含
,其中含 为0.15%,该烟气经海水脱硫处理后
为0.15%,该烟气经海水脱硫处理后 为
为 ,则脱硫率
,则脱硫率
___________ 。( )
)
(6)离子液体(ILs)也可以用来处理工业烟气。ILs的负离子吸收 后生成
后生成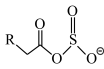 。欲确定
。欲确定 中虚线框内基团的结构,可采用的分析方法有___________。
中虚线框内基团的结构,可采用的分析方法有___________。
工业上还可用 溶液吸收烟气中的二氧化硫,随着反应的进行,其吸收能力会逐渐降低。
溶液吸收烟气中的二氧化硫,随着反应的进行,其吸收能力会逐渐降低。
(7)为使 再生,最适宜向吸收能力降低的溶液中加入或通入一定量的___________。
再生,最适宜向吸收能力降低的溶液中加入或通入一定量的___________。
(8)使用 溶液脱硫时,溶液的pH通常需控制在
溶液脱硫时,溶液的pH通常需控制在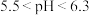 。结合
。结合 的性质和下图,分析pH不宜过小和过大的原因
的性质和下图,分析pH不宜过小和过大的原因___________ 。
(1)
 分子的空间结构和分子的极性分别为___________。
分子的空间结构和分子的极性分别为___________。| A.直线形,非极性 | B.直线形,极性 | C.角形,非极性 | D.角形,极性 |
(2)第一电离能:
 ,结合核外电子排布相关知识,说明其原因
,结合核外电子排布相关知识,说明其原因沿海地区的某煤电厂开发出海水脱硫的新工艺,流程如下图所示:
 ,
, 的电离常数如下表所示:
的电离常数如下表所示:| 弱酸 |  |  |
 | 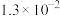 | 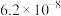 |
 | 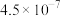 | 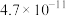 |
(3)在吸收塔内,烟气应从吸收塔的
A.上部 B.中部 C.下部
(4)吸收塔内温度不宜过高,原因可能是
 和海水中
和海水中 发生反应的离子方程式为
发生反应的离子方程式为(5)若煤电厂排放烟气量为
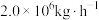 ,其中含
,其中含 为0.15%,该烟气经海水脱硫处理后
为0.15%,该烟气经海水脱硫处理后 为
为 ,则脱硫率
,则脱硫率
 )
)(6)离子液体(ILs)也可以用来处理工业烟气。ILs的负离子吸收
 后生成
后生成 。欲确定
。欲确定 中虚线框内基团的结构,可采用的分析方法有___________。
中虚线框内基团的结构,可采用的分析方法有___________。| A.原子发射光谱 | B.红外光谱 | C.核磁共振氢谱 | D.晶体X射线衍射 |
工业上还可用
 溶液吸收烟气中的二氧化硫,随着反应的进行,其吸收能力会逐渐降低。
溶液吸收烟气中的二氧化硫,随着反应的进行,其吸收能力会逐渐降低。(7)为使
 再生,最适宜向吸收能力降低的溶液中加入或通入一定量的___________。
再生,最适宜向吸收能力降低的溶液中加入或通入一定量的___________。A. | B.CaO | C. | D.NaOH |
(8)使用
 溶液脱硫时,溶液的pH通常需控制在
溶液脱硫时,溶液的pH通常需控制在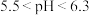 。结合
。结合 的性质和下图,分析pH不宜过小和过大的原因
的性质和下图,分析pH不宜过小和过大的原因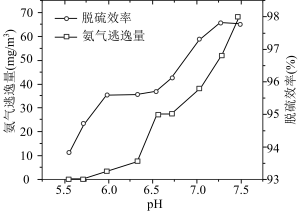
您最近一年使用:0次
2024-01-13更新
|
294次组卷
|
3卷引用:上海市四区联考2023-2024学年高三上学期化学一模试卷
名校
解题方法
5 . 类别万千的酸碱溶液共同构筑了化学世界的丰富多彩。
(1)现有常温下pH=2的盐酸(甲)、pH=2的醋酸溶液(乙)和0.1mol/L NH3∙H2O (丙),请根据下列操作回答:
①常温下,将丙溶液加水稀释,下列数值一定变小的是_____ (填字母)。
A. B.
B. C.
C.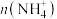 D.
D.
②常温下,取甲、乙各1mL分别稀释至100mL,稀释后,水的电离程度:乙_____ 甲(填“>”“<”或“=”)。
(2)①某温度时,测得0.01mol/LNaOH溶液pH为11,则该温度_____ 25℃。(填“>”“<”或“=”)
②相同条件下,取等体积、等pH的Ba(OH)2、NaOH和NH3∙H2O三种碱溶液,分别滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为 、
、 、
、 ,则三者的大小关系为
,则三者的大小关系为_____ 。
③某温度下,测得0.001mol/L的HCl溶液中水电离出的c(H+)=1×10-9mol∙L-1,将VaLpH=4HCl溶液和VbLpH=9的Ba(OH)2溶液混合均匀,测得溶液的pH=7,则Va:Vb=_____ 。
(3)已知:在25℃,有关弱电解质的电离平衡常数如下表有下表:
①将SO2通入氨水中,当c(OH-)降至1.0×10-7mol∙L-1时,溶液中的 =
=_____ 。
②下列微粒在溶液中不能大量共存的是_____ 。
A. 、
、 B.
B. 、
、 C.
C. 、
、 D.
D. 、
、
(1)现有常温下pH=2的盐酸(甲)、pH=2的醋酸溶液(乙)和0.1mol/L NH3∙H2O (丙),请根据下列操作回答:
①常温下,将丙溶液加水稀释,下列数值一定变小的是
A.
 B.
B. C.
C.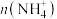 D.
D.
②常温下,取甲、乙各1mL分别稀释至100mL,稀释后,水的电离程度:乙
(2)①某温度时,测得0.01mol/LNaOH溶液pH为11,则该温度
②相同条件下,取等体积、等pH的Ba(OH)2、NaOH和NH3∙H2O三种碱溶液,分别滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为
 、
、 、
、 ,则三者的大小关系为
,则三者的大小关系为③某温度下,测得0.001mol/L的HCl溶液中水电离出的c(H+)=1×10-9mol∙L-1,将VaLpH=4HCl溶液和VbLpH=9的Ba(OH)2溶液混合均匀,测得溶液的pH=7,则Va:Vb=
(3)已知:在25℃,有关弱电解质的电离平衡常数如下表有下表:
| 弱电解质 | H2SO3 | H2CO3 | HClO | NH3∙H2O |
| 电离平衡常数 | 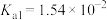  |   | 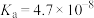 |  |
 =
=②下列微粒在溶液中不能大量共存的是
A.
 、
、 B.
B. 、
、 C.
C. 、
、 D.
D. 、
、
您最近一年使用:0次
2023-11-23更新
|
494次组卷
|
3卷引用:山东省青岛第二中学2023-2024学年高二上学期期中考试化学试卷
名校
解题方法
6 . 电解质水溶液中存在电离平衡,水解平衡、沉淀溶解平衡。请回答下列问题:
(1)常温下,部分弱酸的电离平衡常数如表:
①等浓度CH3COONa、NaClO、 Na2CO3和NaHCO3溶液中,碱性最强的是_______ 。
②等浓度的CH3COONa与NaClO混合溶液中离子浓度由大到小的顺序为_______
(2)室温下,用0.10mol•L−1盐酸溶液滴定20mL 0.1mol•L−1氨水溶液,滴定曲线如图所示。

①该中和滴定选用_______ (填“甲基橙”或“酚酞”)作指示剂。
②室温下,0.10mol•L−1氨水溶液中NH3•H2O的电离平衡常数约为_______ mol·L−1
③b点所示的溶液中c(NH )+c(NH3•H2O)=
)+c(NH3•H2O)=_______ (用溶液的其它离子浓度表示)。
(3)工业上向锅炉里注入所得到的Na2CO3溶液浸泡,将水垢中的CaSO4转化为CaCO3,而后用醋酸除去。当把水垢中CaSO4完全转化时,混合溶液中的c(CO )=1.0×10−3mol·L−1,则c(SO
)=1.0×10−3mol·L−1,则c(SO )=
)=_______ 。Ksp(CaSO4)=9.1×10−6 Ksp(CaCO3)=3.4×10−9(保留小数点后一位)
(1)常温下,部分弱酸的电离平衡常数如表:
| 弱酸 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数 | Ka=1.8×10-5 | Ka=3.1×10-8 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
②等浓度的CH3COONa与NaClO混合溶液中离子浓度由大到小的顺序为
(2)室温下,用0.10mol•L−1盐酸溶液滴定20mL 0.1mol•L−1氨水溶液,滴定曲线如图所示。

①该中和滴定选用
②室温下,0.10mol•L−1氨水溶液中NH3•H2O的电离平衡常数约为
③b点所示的溶液中c(NH
 )+c(NH3•H2O)=
)+c(NH3•H2O)=(3)工业上向锅炉里注入所得到的Na2CO3溶液浸泡,将水垢中的CaSO4转化为CaCO3,而后用醋酸除去。当把水垢中CaSO4完全转化时,混合溶液中的c(CO
 )=1.0×10−3mol·L−1,则c(SO
)=1.0×10−3mol·L−1,则c(SO )=
)=
您最近一年使用:0次
2023-11-10更新
|
137次组卷
|
2卷引用:陕西省西安市高陵区第一中学2022-2023学年高二下学期开学考试化学试题
名校
7 . CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为___________ (写离子符号);若所得溶液c(HCO )∶c(CO
)∶c(CO )=2∶1,溶液pH=
)=2∶1,溶液pH=___________ 。(室温下,H2CO3的K1=4×10−7;K2=5×10−11)
(2)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g) 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
已知上述反应中相关的化学键键能数据如下:
则该反应的ΔH=___________ 。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是___________ (填“A” 或“B”)。
(3)O2辅助的Al~CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
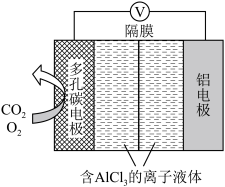
①电池的负极反应式:___________ 。
②电池的正极反应式:6O2+6e‑=6O 、6CO2+6O
、6CO2+6O =3C2O
=3C2O +6O2,反应过程中O2的作用是
+6O2,反应过程中O2的作用是___________ 。
③该电池的总反应式:___________ 。
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为
 )∶c(CO
)∶c(CO )=2∶1,溶液pH=
)=2∶1,溶液pH=(2)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)
 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。已知上述反应中相关的化学键键能数据如下:
| 化学键 | C-H | C=O | H-H | C≡O(CO) |
| 键能/kJ·mol−1 | 413 | 745 | 436 | 1075 |
(3)O2辅助的Al~CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。

①电池的负极反应式:
②电池的正极反应式:6O2+6e‑=6O
 、6CO2+6O
、6CO2+6O =3C2O
=3C2O +6O2,反应过程中O2的作用是
+6O2,反应过程中O2的作用是③该电池的总反应式:
您最近一年使用:0次
8 . 已知:25 ℃时,CH3COOH和NH3·H2O的电离常数相等。
(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。
①将上述(1)溶液加水稀释至1 000 mL溶液中c(CH3COO-)/[c(CH3COOH)·c(OH-)]___________ (填“增大”“减小”“不变”或“不能确定”)。
②25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=___________ 。用pH试纸测定该氨水pH的操作方法为___________ 。
(2)25 ℃时,现向10 mL 0.1 mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中c(NH )/c(NH3.H2O)
)/c(NH3.H2O)___________ (填序号)。
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(3)某温度下,向V1mL 0.1 mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=-lgc(OH-)。

图中M、Q、N三点所示溶液呈中性的点是___________ (填字母)。
(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。
①将上述(1)溶液加水稀释至1 000 mL溶液中c(CH3COO-)/[c(CH3COOH)·c(OH-)]
②25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=
(2)25 ℃时,现向10 mL 0.1 mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中c(NH
 )/c(NH3.H2O)
)/c(NH3.H2O)a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(3)某温度下,向V1mL 0.1 mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=-lgc(OH-)。

图中M、Q、N三点所示溶液呈中性的点是
您最近一年使用:0次
名校
9 . 回答下列问题:
(1)下列事实能说明 是弱酸的是
是弱酸的是_______ (填字母)。
A. 溶液能和
溶液能和 溶液反应
溶液反应
B.常温下 的
的 溶液的
溶液的 为2.1
为2.1
C.向 溶液中滴加石蕊试液,溶液变为红色
溶液中滴加石蕊试液,溶液变为红色
(2)将 溶液加水稀释,
溶液加水稀释,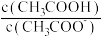 的比值将
的比值将_______ (填“变大”、“不变”或“变小”)。
(3)某些弱酸在 时的电离常数如下:
时的电离常数如下:
下列反应可以发生的是_______(填字母)。
(1)下列事实能说明
 是弱酸的是
是弱酸的是A.
 溶液能和
溶液能和 溶液反应
溶液反应B.常温下
 的
的 溶液的
溶液的 为2.1
为2.1C.向
 溶液中滴加石蕊试液,溶液变为红色
溶液中滴加石蕊试液,溶液变为红色(2)将
 溶液加水稀释,
溶液加水稀释,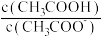 的比值将
的比值将(3)某些弱酸在
 时的电离常数如下:
时的电离常数如下:| 化学式 |  |  |  |  |
| 电离常数 | 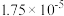 | 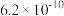 | 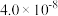 | 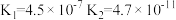 |
A.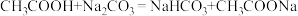 |
B.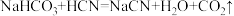 |
C.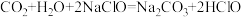 |
D. |
您最近一年使用:0次
10 . 已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如下表:
(1)写出碳酸的第一步电离方程式_______ 。
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2CO3溶液、③CH3COONa 溶液,pH由大到小的顺序为_______ (填序号)。
(3)25℃时,H2SO3⇌HSO +H+的电离常数Ka=1×10-2mol/L,则该温度下pH=3、c(HSO
+H+的电离常数Ka=1×10-2mol/L,则该温度下pH=3、c(HSO )=0.1mol/L的NaHSO3溶液中c(H2SO3)=
)=0.1mol/L的NaHSO3溶液中c(H2SO3)=_______ 。
(4)下列方法中,可以使0.10mol/LCH3COOH溶液中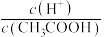 值增大的措施是
值增大的措施是_______ (填序号)。
a.加水稀释 b.加入少量CH3COONa固体 c.加入少量冰醋酸 d.通入少量HCl气体 e.加少量烧碱溶液 f.升高温度
(5)向20 mL硫酸和盐酸的混合溶液中,逐滴加入0.05 mol·L-1Ba(OH)2溶液时,生成沉淀的质量变化及由此而引起的溶液的pH的变化如图所示。计算:
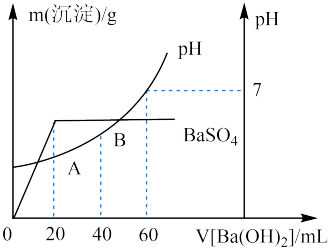
①原混合溶液中c(H+)=_______ ;c(Cl-)=_______ 。
②A点的pH=_______ 。
③将0.15mol·L-1稀硫酸V1mL与0.1mol·L-1NaOH溶液V2mL混合,所得溶液pH为1,则V1∶V2=_______ (溶液体积变化忽略不计)。
| 醋酸 | 碳酸 | 氢氰酸 |
Ka=1.7×10 | Ka1=4.2×10 Ka2=5.6×10  | Ka=6.2×10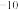 |
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2CO3溶液、③CH3COONa 溶液,pH由大到小的顺序为
(3)25℃时,H2SO3⇌HSO
 +H+的电离常数Ka=1×10-2mol/L,则该温度下pH=3、c(HSO
+H+的电离常数Ka=1×10-2mol/L,则该温度下pH=3、c(HSO )=0.1mol/L的NaHSO3溶液中c(H2SO3)=
)=0.1mol/L的NaHSO3溶液中c(H2SO3)=(4)下列方法中,可以使0.10mol/LCH3COOH溶液中
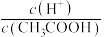 值增大的措施是
值增大的措施是a.加水稀释 b.加入少量CH3COONa固体 c.加入少量冰醋酸 d.通入少量HCl气体 e.加少量烧碱溶液 f.升高温度
(5)向20 mL硫酸和盐酸的混合溶液中,逐滴加入0.05 mol·L-1Ba(OH)2溶液时,生成沉淀的质量变化及由此而引起的溶液的pH的变化如图所示。计算:

①原混合溶液中c(H+)=
②A点的pH=
③将0.15mol·L-1稀硫酸V1mL与0.1mol·L-1NaOH溶液V2mL混合,所得溶液pH为1,则V1∶V2=
您最近一年使用:0次



