解题方法
1 . 全球大气 浓度升高对人类生产、生活产生影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:
浓度升高对人类生产、生活产生影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:
(1)已知25℃时,大气中的 溶于水存在以下过程:
溶于水存在以下过程:
①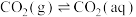

②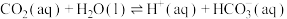

过程①的混合平衡常数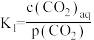 ,其中
,其中 表示溶液中的
表示溶液中的 浓度,
浓度,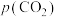 表示大气中
表示大气中 的分压(单位:kPa)。温度升高,
的分压(单位:kPa)。温度升高,
_______ (填“增大”或“减小”);当大气压强为akPa,溶液中的 (忽略
(忽略 和水的电离)时,大气中
和水的电离)时,大气中 的体积分数为
的体积分数为_______ 。
(2)由 转化制甲醇具有重要的经济效益。反应
转化制甲醇具有重要的经济效益。反应 。在有、无催化剂条件下的反应机理和相对能量的变化如图所示(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。
。在有、无催化剂条件下的反应机理和相对能量的变化如图所示(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。_______ ,有催化剂时决速步骤的活化能为_______ eV。
(3) 催化加氢制甲醇反应历程中某一步基元反应的Arthenius经验公式的实验数据如图所示,已知Arthenius经验公式为
催化加氢制甲醇反应历程中某一步基元反应的Arthenius经验公式的实验数据如图所示,已知Arthenius经验公式为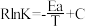 (其中Ea为活化能,K为速率常数,R和C为常数)。
(其中Ea为活化能,K为速率常数,R和C为常数)。
①该反应的活化能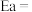
_______ kJ/mol;
②当使用更高效的催化剂时,在图中画出Rlnk与 关系的示意图
关系的示意图_______ 。 催化加氢制甲醇过程中也存在竞争反应
催化加氢制甲醇过程中也存在竞争反应
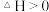 ,在恒温密闭容器中,维持压强和投料比不变,将
,在恒温密闭容器中,维持压强和投料比不变,将 和
和 按一定流速通过反应器,
按一定流速通过反应器, 转化率和甲醇选择性
转化率和甲醇选择性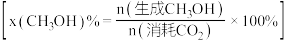 随温度变化关系如下图所示:
随温度变化关系如下图所示:_______ 。
②在压强为P的恒温恒压密闭容器中,加入 和
和 反应并达到平衡状态
反应并达到平衡状态 平衡转化率为20%,甲醇的选择性为50%,计算
平衡转化率为20%,甲醇的选择性为50%,计算 ,在该温度下的平衡常数
,在该温度下的平衡常数
_______ (列出计算式)。
 浓度升高对人类生产、生活产生影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:
浓度升高对人类生产、生活产生影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:(1)已知25℃时,大气中的
 溶于水存在以下过程:
溶于水存在以下过程:①
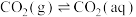

②
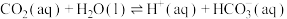

过程①的混合平衡常数
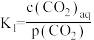 ,其中
,其中 表示溶液中的
表示溶液中的 浓度,
浓度,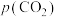 表示大气中
表示大气中 的分压(单位:kPa)。温度升高,
的分压(单位:kPa)。温度升高,
 (忽略
(忽略 和水的电离)时,大气中
和水的电离)时,大气中 的体积分数为
的体积分数为(2)由
 转化制甲醇具有重要的经济效益。反应
转化制甲醇具有重要的经济效益。反应 。在有、无催化剂条件下的反应机理和相对能量的变化如图所示(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。
。在有、无催化剂条件下的反应机理和相对能量的变化如图所示(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。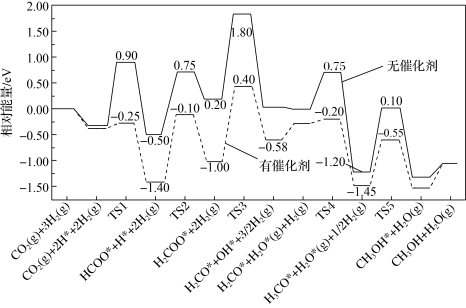
(3)
 催化加氢制甲醇反应历程中某一步基元反应的Arthenius经验公式的实验数据如图所示,已知Arthenius经验公式为
催化加氢制甲醇反应历程中某一步基元反应的Arthenius经验公式的实验数据如图所示,已知Arthenius经验公式为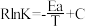 (其中Ea为活化能,K为速率常数,R和C为常数)。
(其中Ea为活化能,K为速率常数,R和C为常数)。①该反应的活化能
②当使用更高效的催化剂时,在图中画出Rlnk与
 关系的示意图
关系的示意图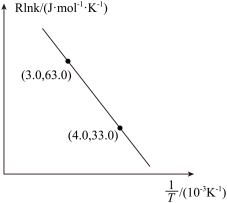
 催化加氢制甲醇过程中也存在竞争反应
催化加氢制甲醇过程中也存在竞争反应
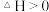 ,在恒温密闭容器中,维持压强和投料比不变,将
,在恒温密闭容器中,维持压强和投料比不变,将 和
和 按一定流速通过反应器,
按一定流速通过反应器, 转化率和甲醇选择性
转化率和甲醇选择性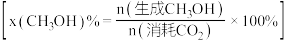 随温度变化关系如下图所示:
随温度变化关系如下图所示: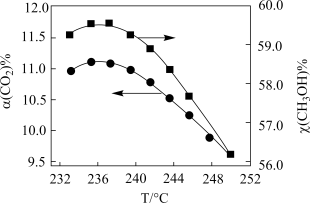
②在压强为P的恒温恒压密闭容器中,加入
 和
和 反应并达到平衡状态
反应并达到平衡状态 平衡转化率为20%,甲醇的选择性为50%,计算
平衡转化率为20%,甲醇的选择性为50%,计算 ,在该温度下的平衡常数
,在该温度下的平衡常数
您最近一年使用:0次
2 . 在菠菜等植物中含有丰富的草酸,草酸对生命活动有重要影响。
 溶液的pH,溶液中的
溶液的pH,溶液中的 、
、 、
、 的物质的量分数
的物质的量分数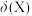 随pH的变化如图所示:
随pH的变化如图所示: )在水中的电离方程式:
)在水中的电离方程式:___________ 。
(2)要使溶液中草酸的电离程度增大,采取的措施为___________ 。(写两点)
(3)草酸溶液中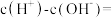
___________ 。(用含碳微粒表示)
(4)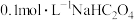 溶液中
溶液中
___________  。(填“<”“>”“=”)
。(填“<”“>”“=”)
(5) 时,
时,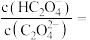
___________ 。

 溶液的pH,溶液中的
溶液的pH,溶液中的 、
、 、
、 的物质的量分数
的物质的量分数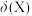 随pH的变化如图所示:
随pH的变化如图所示: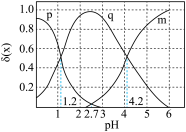
 )在水中的电离方程式:
)在水中的电离方程式:(2)要使溶液中草酸的电离程度增大,采取的措施为
(3)草酸溶液中
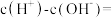
(4)
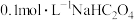 溶液中
溶液中
 。(填“<”“>”“=”)
。(填“<”“>”“=”)(5)
 时,
时,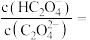
您最近一年使用:0次
3 . 按要求填空
(1)NaHCO3的水溶液呈___________ (填“酸”、“中”、“碱”)性,实验室保存NaHCO3溶液的试剂瓶应用___________ 塞,原因___________ (写出有关的离子方程式,下同);Al2(SO4)3显酸性,溶液蒸干最后得到的固体产物是___________ 。
(2)常温下,下列溶液中,c(H+)由小到大的排列顺序是___________ 。
①0.1mol/LHCl溶液 ②0.1mol/LH2SO4溶液 ③0.1mol/LNaOH溶液 ④0.1mol/LCH3COOH溶液。
(3)25℃时,有 的盐酸和
的盐酸和 的
的 溶液中由水电离出的c(H+)之比为
溶液中由水电离出的c(H+)之比为___________ 。
(4)已知: :
: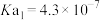 ;
; ,
, :
: 。
。
①相同条件下,试比较 、
、 、
、 的酸性由强到弱的顺序为
的酸性由强到弱的顺序为___________ 。
②则将 气体通入足量的
气体通入足量的 溶液中的离子反应方程式为
溶液中的离子反应方程式为___________ 。
(1)NaHCO3的水溶液呈
(2)常温下,下列溶液中,c(H+)由小到大的排列顺序是
①0.1mol/LHCl溶液 ②0.1mol/LH2SO4溶液 ③0.1mol/LNaOH溶液 ④0.1mol/LCH3COOH溶液。
(3)25℃时,有
 的盐酸和
的盐酸和 的
的 溶液中由水电离出的c(H+)之比为
溶液中由水电离出的c(H+)之比为(4)已知:
 :
: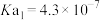 ;
; ,
, :
: 。
。①相同条件下,试比较
 、
、 、
、 的酸性由强到弱的顺序为
的酸性由强到弱的顺序为②则将
 气体通入足量的
气体通入足量的 溶液中的离子反应方程式为
溶液中的离子反应方程式为
您最近一年使用:0次
名校
解题方法
4 . “吃饺子要蘸醋”是很多中国人传统的饮食习惯,我们对醋酸的使用有着悠久的历史。
(1) 的醋酸和盐酸各
的醋酸和盐酸各 分别稀释至
分别稀释至 ,所得醋酸的
,所得醋酸的
_______ (填“>”“<”或“=”)所得盐酸的 。
。
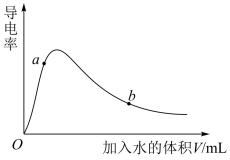
(2)取 冰醋酸作导电性实验,测得其导电率随加入水的量的变化如图所示。
冰醋酸作导电性实验,测得其导电率随加入水的量的变化如图所示。
①由水电离出的氢离子 :a
:a_______ b(填“>”“<”或“=”)。
②使图中b点对应的溶液中 增大、
增大、 减小,可采用的方法是
减小,可采用的方法是_______ (填标号)。
A.加入 B.加入
B.加入 固体 C.加入浓硫酸 D.加入
固体 C.加入浓硫酸 D.加入 固体
固体
(3)向面食中加入适量的醋可以中和其中过量的食用碱而改善口感,已知 时,三种弱酸的电离平衡常数如下表,写出过量醋酸与
时,三种弱酸的电离平衡常数如下表,写出过量醋酸与 溶液反应的离子方程式:
溶液反应的离子方程式:_______ ;判断 结合质子能力由大到小顺序为
结合质子能力由大到小顺序为_______ 。
(4)吃醋虽好但不宜过量,不然容易造成牙齿酸软,甚至引发龋齿,牙齿的主要成分是羟基磷灰石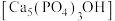 ,市面上含氟牙膏常添加了
,市面上含氟牙膏常添加了 来预防龋齿,请结合化学用语解释含氟牙膏预防龋齿的原因:
来预防龋齿,请结合化学用语解释含氟牙膏预防龋齿的原因:_______ [已知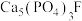 难溶于酸]。
难溶于酸]。
(5)常温下,某同学取 物质的量浓度为
物质的量浓度为 的醋酸,向其中滴入
的醋酸,向其中滴入
 溶液,当滴入的
溶液,当滴入的 溶液的体积为
溶液的体积为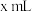 ,溶液呈中性,则醋酸的电离平衡常数
,溶液呈中性,则醋酸的电离平衡常数
_______ (用含x的代数式表示)。

(1)
 的醋酸和盐酸各
的醋酸和盐酸各 分别稀释至
分别稀释至 ,所得醋酸的
,所得醋酸的
 。
。(2)取
 冰醋酸作导电性实验,测得其导电率随加入水的量的变化如图所示。
冰醋酸作导电性实验,测得其导电率随加入水的量的变化如图所示。①由水电离出的氢离子
 :a
:a②使图中b点对应的溶液中
 增大、
增大、 减小,可采用的方法是
减小,可采用的方法是A.加入
 B.加入
B.加入 固体 C.加入浓硫酸 D.加入
固体 C.加入浓硫酸 D.加入 固体
固体(3)向面食中加入适量的醋可以中和其中过量的食用碱而改善口感,已知
 时,三种弱酸的电离平衡常数如下表,写出过量醋酸与
时,三种弱酸的电离平衡常数如下表,写出过量醋酸与 溶液反应的离子方程式:
溶液反应的离子方程式: 结合质子能力由大到小顺序为
结合质子能力由大到小顺序为| 弱酸 |  |  |  |
| 电离平衡常数 | 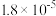 | 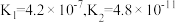 | 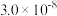 |
(4)吃醋虽好但不宜过量,不然容易造成牙齿酸软,甚至引发龋齿,牙齿的主要成分是羟基磷灰石
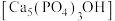 ,市面上含氟牙膏常添加了
,市面上含氟牙膏常添加了 来预防龋齿,请结合化学用语解释含氟牙膏预防龋齿的原因:
来预防龋齿,请结合化学用语解释含氟牙膏预防龋齿的原因: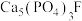 难溶于酸]。
难溶于酸]。(5)常温下,某同学取
 物质的量浓度为
物质的量浓度为 的醋酸,向其中滴入
的醋酸,向其中滴入
 溶液,当滴入的
溶液,当滴入的 溶液的体积为
溶液的体积为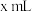 ,溶液呈中性,则醋酸的电离平衡常数
,溶液呈中性,则醋酸的电离平衡常数
您最近一年使用:0次
2024-02-26更新
|
129次组卷
|
2卷引用:湖南省长沙市长郡中学2023-2024学年高二上学期期末考试化学试题
解题方法
5 . 二氧化碳的捕集和资源化利用是缓解温室效应的重要战略方向。回答下列问题:
Ⅰ.二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。总反应可表示为:

该反应一般认为通过如下步骤来实现:
①

②
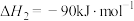
(1)若反应①为慢反应,请在图中接着完善画出反应②的能量变化曲线,标注出相应的物质(含聚集状态)以及总反应的 (含具体数值)
(含具体数值) _______ 。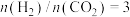 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为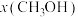 ,在
,在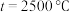 下的
下的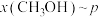 、在
、在 下的
下的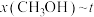 如图所示。
如图所示。_______ (填“a”或“b”),判断的理由_______ 。
(b)当 时,
时, 的平衡转化率
的平衡转化率
_______ 。
Ⅱ.催化CO2加氢合成乙酸在减少碳排放的同时还可以生产重要的化工原料。弱电解质的电离度是指弱电解质在溶液中达到电离平衡时,已电离的电解质分子数占原来总分子数(包括已电离的和未电离的>的百分数,用a表示。而在实验测定中,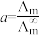 ,
,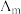 为一定浓度下电解质的摩尔电导率,
为一定浓度下电解质的摩尔电导率,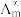 为无限稀释时溶液的摩尔电导率,
为无限稀释时溶液的摩尔电导率,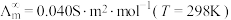 。某小组实验测得
。某小组实验测得 时,
时, 乙酸的
乙酸的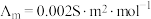 。
。
(3)在298K时,乙酸的电离平衡常数
_______ (列出计算式,不需化简)。
(4)在298K时,几种离子的摩尔电导率如下表所示。已知:摩尔电导率越大,溶液的导电性越好。空间站通过电解水实现O2的再生,从导电性角度选择,最适宜的电解质为_______ (填化学式)。
Ⅰ.二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。总反应可表示为:


该反应一般认为通过如下步骤来实现:
①


②

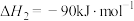
(1)若反应①为慢反应,请在图中接着完善画出反应②的能量变化曲线,标注出相应的物质(含聚集状态)以及总反应的
 (含具体数值)
(含具体数值) 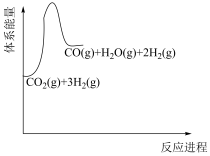
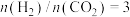 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为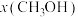 ,在
,在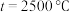 下的
下的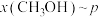 、在
、在 下的
下的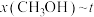 如图所示。
如图所示。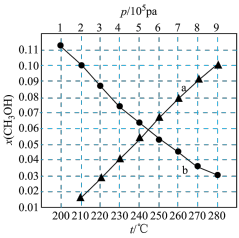
(b)当
 时,
时, 的平衡转化率
的平衡转化率
Ⅱ.催化CO2加氢合成乙酸在减少碳排放的同时还可以生产重要的化工原料。弱电解质的电离度是指弱电解质在溶液中达到电离平衡时,已电离的电解质分子数占原来总分子数(包括已电离的和未电离的>的百分数,用a表示。而在实验测定中,
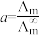 ,
,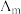 为一定浓度下电解质的摩尔电导率,
为一定浓度下电解质的摩尔电导率,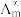 为无限稀释时溶液的摩尔电导率,
为无限稀释时溶液的摩尔电导率,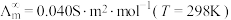 。某小组实验测得
。某小组实验测得 时,
时, 乙酸的
乙酸的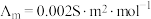 。
。(3)在298K时,乙酸的电离平衡常数

(4)在298K时,几种离子的摩尔电导率如下表所示。已知:摩尔电导率越大,溶液的导电性越好。空间站通过电解水实现O2的再生,从导电性角度选择,最适宜的电解质为
| 离子种类 |  |  |  |  |  |  |
摩尔电导率/( ) ) | 349.82 | 79.80 | 76.34 | 50.18 | 73.52 | 50.11 |
您最近一年使用:0次
名校
解题方法
6 . 回答下列问题:
(1)已知PH3与NH3结构相似,PH3的电子式___________ ,键角PH3___________ NH3(填“大于”“小于”“等于”,下同),热稳定性:PH3___________ NH3。
(2)Fe、Ni元素性质非常相似,属于铁系元素,得到广泛应用。
①Fe元素位于元素周期表的___________ 区(填分区)。
②基态Ni3+核外电子排布式为___________ 。
(3)鉴定Ni2+的特征反应是将丁二酮肟加入Ni2+盐溶液中,生成鲜红色的螯合物M,M结构如下图所示:

①组成M的五种元素中,除H元素外,另外四种元素第一电离能由大到小的顺序为___________ (填元素符号),
②图中各微粒间不存在的作用力有___________ (填标号)。
a. 配位键 b.极性键 c.非极性键 d.π键 e.离子键 f.氢键
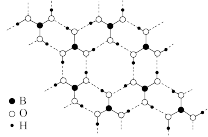
(4)如图为H3BO3晶体的片层结构,其中B的杂化方式为___________ 。
(5)硼酸(H3BO3)为一元弱酸,电离方程式H3BO3+H2O⇌H++B(OH) 。已知:H3BO3的电离常数Ka=5.8×10﹣10,H2CO3的电离常数Ka1=4.4×10﹣7、Ka2=4.7×10﹣11,向饱和硼酸溶液中滴加少量Na2CO3溶液,写出发生反应的离子方程式
。已知:H3BO3的电离常数Ka=5.8×10﹣10,H2CO3的电离常数Ka1=4.4×10﹣7、Ka2=4.7×10﹣11,向饱和硼酸溶液中滴加少量Na2CO3溶液,写出发生反应的离子方程式___________ 。
(1)已知PH3与NH3结构相似,PH3的电子式
(2)Fe、Ni元素性质非常相似,属于铁系元素,得到广泛应用。
①Fe元素位于元素周期表的
②基态Ni3+核外电子排布式为
(3)鉴定Ni2+的特征反应是将丁二酮肟加入Ni2+盐溶液中,生成鲜红色的螯合物M,M结构如下图所示:

①组成M的五种元素中,除H元素外,另外四种元素第一电离能由大到小的顺序为
②图中各微粒间不存在的作用力有
a. 配位键 b.极性键 c.非极性键 d.π键 e.离子键 f.氢键
(4)如图为H3BO3晶体的片层结构,其中B的杂化方式为

(5)硼酸(H3BO3)为一元弱酸,电离方程式H3BO3+H2O⇌H++B(OH)
 。已知:H3BO3的电离常数Ka=5.8×10﹣10,H2CO3的电离常数Ka1=4.4×10﹣7、Ka2=4.7×10﹣11,向饱和硼酸溶液中滴加少量Na2CO3溶液,写出发生反应的离子方程式
。已知:H3BO3的电离常数Ka=5.8×10﹣10,H2CO3的电离常数Ka1=4.4×10﹣7、Ka2=4.7×10﹣11,向饱和硼酸溶液中滴加少量Na2CO3溶液,写出发生反应的离子方程式
您最近一年使用:0次
7 . 已知25℃时部分弱电解质的电离平衡常数如表所示,回答下列有关问题:
(1) 第一步的电离方程式是
第一步的电离方程式是___________ ,浓度均为0.5mol/L的 、
、 、HCN溶液中,pH最大的是
、HCN溶液中,pH最大的是___________ (填溶质的化学式)。
(2)常温下,体积均为10mL、pH=2的醋酸溶液与硫酸溶液分别加蒸馏水稀释a倍和b倍到pH=4,a___________ b(填“大于”“小于”或“等于”)。
(3)25℃时,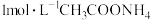 溶液显
溶液显___________ 性(填“酸”“中”或“碱”)性。
(4)将氯化铝溶液加热蒸干并灼烧得到的固体为___________ , 是一种液态化合物,遇水剧烈反应,有白雾和能使品红溶液褪色的刺激性气味的
是一种液态化合物,遇水剧烈反应,有白雾和能使品红溶液褪色的刺激性气味的 ,实际工业上将
,实际工业上将 与
与 混合共热,可得到无水
混合共热,可得到无水 ,其原因是
,其原因是___________ 。
(5)相同条件下,0.1mol/L下列溶液中, 由小到大的排列顺序是
由小到大的排列顺序是___________ (填序号)。
A. B.
B. C.
C. D.
D. E.
E.
(6)甲酸钠(HCOONa)溶液呈碱性的原因是___________ (用离子方程式表示)。0.02mol/L的HCOONa溶液中
___________ mol/L。
| 化学式 |  |  | HCN |  |
| 电离平衡常数 |  |  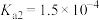 | 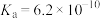 |  |
 第一步的电离方程式是
第一步的电离方程式是 、
、 、HCN溶液中,pH最大的是
、HCN溶液中,pH最大的是(2)常温下,体积均为10mL、pH=2的醋酸溶液与硫酸溶液分别加蒸馏水稀释a倍和b倍到pH=4,a
(3)25℃时,
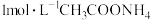 溶液显
溶液显(4)将氯化铝溶液加热蒸干并灼烧得到的固体为
 是一种液态化合物,遇水剧烈反应,有白雾和能使品红溶液褪色的刺激性气味的
是一种液态化合物,遇水剧烈反应,有白雾和能使品红溶液褪色的刺激性气味的 ,实际工业上将
,实际工业上将 与
与 混合共热,可得到无水
混合共热,可得到无水 ,其原因是
,其原因是(5)相同条件下,0.1mol/L下列溶液中,
 由小到大的排列顺序是
由小到大的排列顺序是A.
 B.
B. C.
C. D.
D. E.
E.
(6)甲酸钠(HCOONa)溶液呈碱性的原因是

您最近一年使用:0次
2024-01-09更新
|
60次组卷
|
2卷引用:宁夏银川二中2023-2024学年高二上学期月考二化学试题
名校
8 .  是一种二元弱酸,
是一种二元弱酸, 时其电离平衡常数
时其电离平衡常数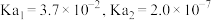 。
。
(1)① 溶液与足量
溶液与足量 溶液反应的离子方程式为
溶液反应的离子方程式为___________ 。
② 时,向
时,向 的
的 溶液中滴加等浓度等体积的
溶液中滴加等浓度等体积的 溶液(溶液体积变化忽略不计),则溶液中的
溶液(溶液体积变化忽略不计),则溶液中的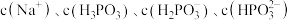 微粒浓度从大到小的排列顺序为
微粒浓度从大到小的排列顺序为___________ 。
(2)某温度下,四种酸在冰醋酸中的电离常数如下表:
下列说法正确的是___________。
(3)液氨与水一样可以发生微弱电离,如: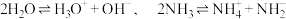
① 与
与 反应的化学方程式为
反应的化学方程式为___________ 。
②醋酸和氢氟酸在水溶液中为弱酸,但在液氨中都显强酸性的原因可能是___________ 。
 是一种二元弱酸,
是一种二元弱酸, 时其电离平衡常数
时其电离平衡常数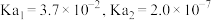 。
。(1)①
 溶液与足量
溶液与足量 溶液反应的离子方程式为
溶液反应的离子方程式为②
 时,向
时,向 的
的 溶液中滴加等浓度等体积的
溶液中滴加等浓度等体积的 溶液(溶液体积变化忽略不计),则溶液中的
溶液(溶液体积变化忽略不计),则溶液中的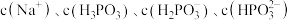 微粒浓度从大到小的排列顺序为
微粒浓度从大到小的排列顺序为(2)某温度下,四种酸在冰醋酸中的电离常数如下表:
| 酸 |  |  |  |  |
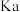 |  | 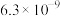 |  |  |
| A.用浓硫酸和氯化钠固体加热制氯化氢是因为在水中硫酸的酸性比盐酸的酸性强 |
B.冰醋酸中可以发生反应: |
C.冰醋酸中 的电离方程式为: 的电离方程式为: |
D.向硫酸的冰醋酸溶液中加入 ,硫酸的电离程度增大 ,硫酸的电离程度增大 |
①
 与
与 反应的化学方程式为
反应的化学方程式为②醋酸和氢氟酸在水溶液中为弱酸,但在液氨中都显强酸性的原因可能是
您最近一年使用:0次
2023-12-23更新
|
90次组卷
|
2卷引用:浙江省北斗星盟2023-2024学年高二上学期12月月考化学试题
名校
9 . 研究海洋中珊瑚礁(主要成分CaCO3)的形成机制及其影响具有重要意义,相关主要反应有:
反应Ⅰ:CO2(aq)+H2O(l)
 (aq)+H+(aq) K1=4.5×10-7
(aq)+H+(aq) K1=4.5×10-7
反应Ⅱ: (aq)
(aq)
 (aq)+H+(aq) K2= 4.7×10-11
(aq)+H+(aq) K2= 4.7×10-11
反应Ⅲ:CaCO3(s) Ca2+(aq)+
Ca2+(aq)+ (aq) K3=3.4×10-9
(aq) K3=3.4×10-9
请回答:
(1)珊瑚礁形成的总反应可表示为Ca2+(aq)+2 (aq)=CaCO3(s)+CO2(aq)+H2O(l)。有利于珊瑚礁形成的环境是
(aq)=CaCO3(s)+CO2(aq)+H2O(l)。有利于珊瑚礁形成的环境是_______ (填“温暖海域”或“冰冷海域”),该反应的平衡常数K=_______ (用K1、K2、K3表示)。
(2)海水的pH为8.0~8.3,下列有关珊瑚礁形成过程的叙述中正确的是_______。
(3)温室气体CO2的浓度上升,会导致海水酸化,促使珊瑚礁的溶解。科学家模拟海洋环境探究不同温度下海水中CO2浓度与 浓度间的关系。已知T1℃下测得c(CO2)与c(
浓度间的关系。已知T1℃下测得c(CO2)与c( )的关系如图,请画出T2℃(T2>T1)时c(
)的关系如图,请画出T2℃(T2>T1)时c( )随c(CO2)的变化趋势
)随c(CO2)的变化趋势_______ 。_______ 0(填“>”“<”或“=”);随温度的升高,容器中CO2的浓度在T3温度下出现最低值的原因是_______ 。
反应Ⅰ:CO2(aq)+H2O(l)

 (aq)+H+(aq) K1=4.5×10-7
(aq)+H+(aq) K1=4.5×10-7反应Ⅱ:
 (aq)
(aq)
 (aq)+H+(aq) K2= 4.7×10-11
(aq)+H+(aq) K2= 4.7×10-11反应Ⅲ:CaCO3(s)
 Ca2+(aq)+
Ca2+(aq)+ (aq) K3=3.4×10-9
(aq) K3=3.4×10-9请回答:
(1)珊瑚礁形成的总反应可表示为Ca2+(aq)+2
 (aq)=CaCO3(s)+CO2(aq)+H2O(l)。有利于珊瑚礁形成的环境是
(aq)=CaCO3(s)+CO2(aq)+H2O(l)。有利于珊瑚礁形成的环境是(2)海水的pH为8.0~8.3,下列有关珊瑚礁形成过程的叙述中正确的是_______。
A.海水中最主要的含碳微粒为 |
B.海水中的c(Ca2+)>c( )+c( )+c( ) ) |
C. 、 、 的水解反应是海水呈弱碱性的主要原因 的水解反应是海水呈弱碱性的主要原因 |
D.珊瑚礁形成的反应阻碍了 的电离 的电离 |
(3)温室气体CO2的浓度上升,会导致海水酸化,促使珊瑚礁的溶解。科学家模拟海洋环境探究不同温度下海水中CO2浓度与
 浓度间的关系。已知T1℃下测得c(CO2)与c(
浓度间的关系。已知T1℃下测得c(CO2)与c( )的关系如图,请画出T2℃(T2>T1)时c(
)的关系如图,请画出T2℃(T2>T1)时c( )随c(CO2)的变化趋势
)随c(CO2)的变化趋势

您最近一年使用:0次
名校
解题方法
10 . 金属钒在新能源动力电池中有重要作用。含钒尖晶石是钒渣中最主要的含钒物相,其主要成分有V2O3、FeO、Fe2O3、Al2O3、SiO2,采用以下工艺流程制备V2O5。 的形式存在。
的形式存在。
(1)“焙烧”过程中被氧化的元素是___________ 。
(2)“焙烧"时,V2O3与Na2CO3反应的化学方程式是___________ 。
(3)“沉淀1”的成分是___________ 。
(4)“沉淀2”加热分解后固体产物的用途___________ (任写一种)。
(5)“沉钒”析出NH4VO3晶体时,需要加入过量(NH4)2CO3,其原因_____ (结合平衡移动原理解释)。
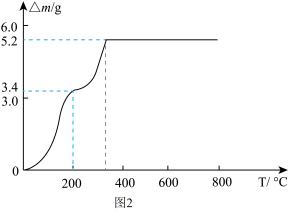
(6)沉钒过程中,沉钒率随溶液pH的变化如图1所示。沉钒率随溶液pH的增加先升高后降低的原因可能是___________ 。___________ 。
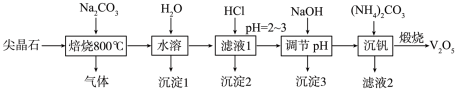
 的形式存在。
的形式存在。(1)“焙烧”过程中被氧化的元素是
(2)“焙烧"时,V2O3与Na2CO3反应的化学方程式是
(3)“沉淀1”的成分是
(4)“沉淀2”加热分解后固体产物的用途
(5)“沉钒”析出NH4VO3晶体时,需要加入过量(NH4)2CO3,其原因
(6)沉钒过程中,沉钒率随溶液pH的变化如图1所示。沉钒率随溶液pH的增加先升高后降低的原因可能是

您最近一年使用:0次
2023-11-27更新
|
192次组卷
|
2卷引用:宁夏银川市第二中学2023-2024学年高三上学期统练四 化学试题



