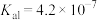名校
解题方法
1 . 资源化利用CO2,不仅可以减少温室气体的排放,还可以获得燃料或重要的化工产品。
(1)CO2的捕集:
①CO2属于___________ 分子(填“极性”或“非极性”),其晶体(干冰)属于__________ 晶体。
②用饱和 溶液做吸收剂可“捕集”CO2。若所得溶液
溶液做吸收剂可“捕集”CO2。若所得溶液 ,溶液中c(HCO
,溶液中c(HCO ):c(CO
):c(CO )=
)=_______ ;(室温下, 的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式
的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式_____ 。
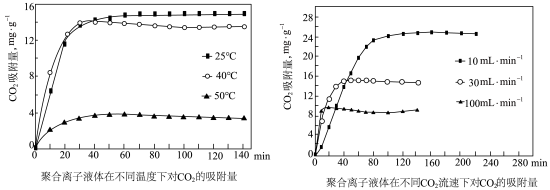
③聚合离子液体是目前广泛研究的CO2吸附剂。结合下图 分析聚合离子液体吸附CO2的有利条件是____________ 。
(2)生产尿素:工业上以CO2、 为原料生产尿素[CO(NH2)2],该反应分为二步进行:
为原料生产尿素[CO(NH2)2],该反应分为二步进行:
第一步: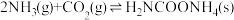
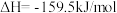
第二步:
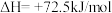
写出上述合成尿素的热化学方程式_______ 。
(3)合成乙酸:中国科学家首次以 、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
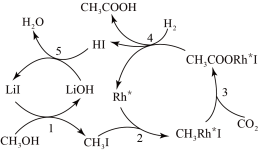
①原料中的 可通过电解法由
可通过电解法由 制取,用稀硫酸作电解质溶液,写出生成
制取,用稀硫酸作电解质溶液,写出生成 的电极反应式:
的电极反应式:____________ 。
②根据图示 ,写出总反应的化学方程式:_______ 。
(1)CO2的捕集:
①CO2属于
②用饱和
 溶液做吸收剂可“捕集”CO2。若所得溶液
溶液做吸收剂可“捕集”CO2。若所得溶液 ,溶液中c(HCO
,溶液中c(HCO ):c(CO
):c(CO )=
)= 的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式
的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式③聚合离子液体是目前广泛研究的CO2吸附剂。

(2)生产尿素:工业上以CO2、
 为原料生产尿素[CO(NH2)2],该反应分为二步进行:
为原料生产尿素[CO(NH2)2],该反应分为二步进行:第一步:
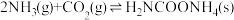
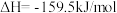
第二步:

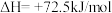
写出上述合成尿素的热化学方程式
(3)合成乙酸:中国科学家首次以
 、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
①原料中的
 可通过电解法由
可通过电解法由 制取,用稀硫酸作电解质溶液,写出生成
制取,用稀硫酸作电解质溶液,写出生成 的电极反应式:
的电极反应式:②
您最近一年使用:0次
2024-04-04更新
|
359次组卷
|
3卷引用:湖南省株洲市第一中学2021-2022学年高三上学期期末测试化学试题
2 . 回答下列问题
(1)99℃时, ,该温度下测得
,该温度下测得
 溶液的
溶液的 。
。 在水溶液中的电离方程式为
在水溶液中的电离方程式为___________ 。
(2)常温下, 为二元弱酸,
为二元弱酸,
 溶液的
溶液的 ,则该溶液中下列微粒的浓度
,则该溶液中下列微粒的浓度
① ②
② ③
③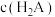 ④
④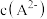 ⑤
⑤ 由大到小的顺序为
由大到小的顺序为___________ (填序号)。
(3)①25℃时,向1L0.1mol/LCH3COOH溶液中加入0.1molCH3COONa固体,则醋酸的电离平衡向___________ (填“正”或“逆”)反应方向移动:水的电离程度将___________ (填“增大”、“减小”或“不变”)。
②25℃时,CH3COOH的电离平衡常数Ka=1.75×10-5,则CH3COONa水解常数Kh=___________ (保留三位有效数字)。改变下列条件,能使CH3COONa稀溶液中 增大的是
增大的是___________ 。
a.降温 b.加入 固体 c.稀释 d.加入
固体 c.稀释 d.加入 固体
固体
(4)在剧烈运动中,因缺氧肌肉会产生乳酸(HL),而血液中,乳酸与碳酸氢盐发生复分解反应。已知乳酸(HL)是一元酸,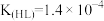 。碳酸的电离平衡常数为:
。碳酸的电离平衡常数为: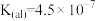 ,
,
① 乳酸的
乳酸的 为
为___________ (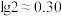 ,
,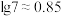 )
)
②乳酸和碳酸氢盐反应的平衡常数的数值___________ 。
(1)99℃时,
 ,该温度下测得
,该温度下测得
 溶液的
溶液的 。
。 在水溶液中的电离方程式为
在水溶液中的电离方程式为(2)常温下,
 为二元弱酸,
为二元弱酸,
 溶液的
溶液的 ,则该溶液中下列微粒的浓度
,则该溶液中下列微粒的浓度①
 ②
② ③
③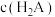 ④
④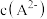 ⑤
⑤ 由大到小的顺序为
由大到小的顺序为(3)①25℃时,向1L0.1mol/LCH3COOH溶液中加入0.1molCH3COONa固体,则醋酸的电离平衡向
②25℃时,CH3COOH的电离平衡常数Ka=1.75×10-5,则CH3COONa水解常数Kh=
 增大的是
增大的是a.降温 b.加入
 固体 c.稀释 d.加入
固体 c.稀释 d.加入 固体
固体(4)在剧烈运动中,因缺氧肌肉会产生乳酸(HL),而血液中,乳酸与碳酸氢盐发生复分解反应。已知乳酸(HL)是一元酸,
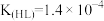 。碳酸的电离平衡常数为:
。碳酸的电离平衡常数为: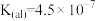 ,
,
①
 乳酸的
乳酸的 为
为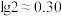 ,
,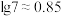 )
)②乳酸和碳酸氢盐反应的平衡常数的数值
您最近一年使用:0次
名校
解题方法
3 . 按要求回答下列问题:
(1)配制FeCl3溶液时,需将固体溶于较浓的盐酸后按需要进行稀释,用离子方程式解释其原因_______ 。
(2)常温下,浓度均为0.1mol/L的下列五种溶液的pH值如下表所示:
①根据表中数据,将pH=2的下列四种酸的溶液分别稀释100倍,pH变化最小的是_______ 。
A. HCN B. HClO C. H2CO3 D. CH3COOH
②根据以上数据,判断下列反应可以成立的是_______ 。(填字母)
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+H2O+CO2
(3)已知在Cu2+、Mg2+、Fe2+浓度相同的溶液中,其开始沉淀时的pH如下:
①若向该溶液中滴加NaOH溶液,则离子沉淀先后顺序是_______ (填离子符号)。
②已知Ksp[Cu(OH)2]=2.5×10-20,若向该溶液中加入生石灰调节其pH,当pH=_______ 时,溶液中Cu2+沉淀完全。[已知1g2=0.3]
③下列说法不正确的是_______ (填字母)。
A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl少
B.一般地,物质的溶解度随温度的升高而增加,故物质的溶解大多是吸热的
C.除去溶液中的Mg2+,用OH-沉淀比用CO 好,说明Mg(OH)2的溶解度比MgCO3的大
好,说明Mg(OH)2的溶解度比MgCO3的大
D.沉淀反应中常加过量的沉淀剂,其目的是使沉淀更完全
(1)配制FeCl3溶液时,需将固体溶于较浓的盐酸后按需要进行稀释,用离子方程式解释其原因
(2)常温下,浓度均为0.1mol/L的下列五种溶液的pH值如下表所示:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A. HCN B. HClO C. H2CO3 D. CH3COOH
②根据以上数据,判断下列反应可以成立的是
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+H2O+CO2
(3)已知在Cu2+、Mg2+、Fe2+浓度相同的溶液中,其开始沉淀时的pH如下:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
②已知Ksp[Cu(OH)2]=2.5×10-20,若向该溶液中加入生石灰调节其pH,当pH=
③下列说法不正确的是
A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl少
B.一般地,物质的溶解度随温度的升高而增加,故物质的溶解大多是吸热的
C.除去溶液中的Mg2+,用OH-沉淀比用CO
 好,说明Mg(OH)2的溶解度比MgCO3的大
好,说明Mg(OH)2的溶解度比MgCO3的大D.沉淀反应中常加过量的沉淀剂,其目的是使沉淀更完全
您最近一年使用:0次
2023-06-07更新
|
57次组卷
|
2卷引用:广东省梅州市大埔县虎山中学2022-2023学年高二上学期12月月考化学试题
4 . 天津地处环渤海湾,海水资源丰富。科研人员把铁的配合物 (L为配体)溶于弱碱性的海水中,制成吸收液,将气体
(L为配体)溶于弱碱性的海水中,制成吸收液,将气体 转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:①
转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:① 的吸收氧化;②
的吸收氧化;② 的再生。反应原理如下:
的再生。反应原理如下:
①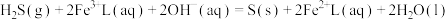
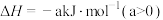
②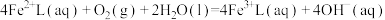
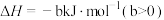
回答下列问题:
(1)该工艺的总反应方程式为___________ 。1mol 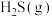 发生该反应的热量变化为
发生该反应的热量变化为___________ , 在总反应中的作用是
在总反应中的作用是___________ 。
(2)研究不同配体与 所形成的配合物(A、B、C)对
所形成的配合物(A、B、C)对 吸收转化率的影响。将配合物A、B、C分别溶于海水中,配成相同物质的量浓度的吸收液,在相同反应条件下,分别向三份吸收液持续通入
吸收转化率的影响。将配合物A、B、C分别溶于海水中,配成相同物质的量浓度的吸收液,在相同反应条件下,分别向三份吸收液持续通入 ,测得单位体积吸收液中
,测得单位体积吸收液中 吸收转化率
吸收转化率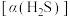 随时间变化的曲线如图1所示。以
随时间变化的曲线如图1所示。以 由100%降至80%所持续的时间来评价铁配合物的脱硫效率,结果最好的是
由100%降至80%所持续的时间来评价铁配合物的脱硫效率,结果最好的是___________ (填“A”、“B”或“C”)。 的电离方程式为
的电离方程式为___________ 。25℃时, 溶液中
溶液中 、
、 、
、 在含硫粒子总浓度中所占分数
在含硫粒子总浓度中所占分数 随溶液pH的变化关系如图2,由图2计算,
随溶液pH的变化关系如图2,由图2计算, 的
的
___________ ,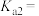
___________ 。再生反应在常温下进行,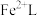 解离出的
解离出的 易与溶液中的
易与溶液中的 形成沉淀。若溶液中的
形成沉淀。若溶液中的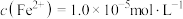 ,
,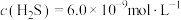 ,为避免有FeS沉淀生成,应控制溶液pH不大于
,为避免有FeS沉淀生成,应控制溶液pH不大于___________ (已知25℃时,FeS的 为
为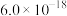 )。
)。
 (L为配体)溶于弱碱性的海水中,制成吸收液,将气体
(L为配体)溶于弱碱性的海水中,制成吸收液,将气体 转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:①
转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:① 的吸收氧化;②
的吸收氧化;② 的再生。反应原理如下:
的再生。反应原理如下:①
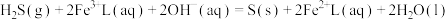
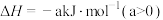
②
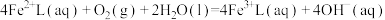
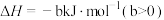
回答下列问题:
(1)该工艺的总反应方程式为
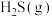 发生该反应的热量变化为
发生该反应的热量变化为 在总反应中的作用是
在总反应中的作用是(2)研究不同配体与
 所形成的配合物(A、B、C)对
所形成的配合物(A、B、C)对 吸收转化率的影响。将配合物A、B、C分别溶于海水中,配成相同物质的量浓度的吸收液,在相同反应条件下,分别向三份吸收液持续通入
吸收转化率的影响。将配合物A、B、C分别溶于海水中,配成相同物质的量浓度的吸收液,在相同反应条件下,分别向三份吸收液持续通入 ,测得单位体积吸收液中
,测得单位体积吸收液中 吸收转化率
吸收转化率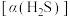 随时间变化的曲线如图1所示。以
随时间变化的曲线如图1所示。以 由100%降至80%所持续的时间来评价铁配合物的脱硫效率,结果最好的是
由100%降至80%所持续的时间来评价铁配合物的脱硫效率,结果最好的是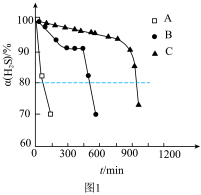
 的电离方程式为
的电离方程式为 溶液中
溶液中 、
、 、
、 在含硫粒子总浓度中所占分数
在含硫粒子总浓度中所占分数 随溶液pH的变化关系如图2,由图2计算,
随溶液pH的变化关系如图2,由图2计算, 的
的
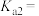
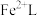 解离出的
解离出的 易与溶液中的
易与溶液中的 形成沉淀。若溶液中的
形成沉淀。若溶液中的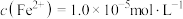 ,
,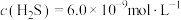 ,为避免有FeS沉淀生成,应控制溶液pH不大于
,为避免有FeS沉淀生成,应控制溶液pH不大于 为
为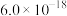 )。
)。
您最近一年使用:0次
2023-03-16更新
|
5679次组卷
|
11卷引用:2022年天津市普通高中学业水平等级性考试化学试题
2022年天津市普通高中学业水平等级性考试化学试题2022年天津高考化学真题(已下线)2022年天津市普通高中学业水平等级性考试化学试题变式题(原理综合题)(已下线)专题17 原理综合题(已下线)专题17 原理综合题(已下线)第20练 化学反应原理综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)【知识图鉴】单元讲练测选择性必修1第3单元03巩固练(已下线)2023年广东卷高考真题变式题(原理综合题)天津市耀华中学2023-2024学年高三上学期第一次月考化学试题(已下线)T19-原理综合题(已下线)提升练09 化学反应原理综合-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
名校
解题方法
5 . 常温时,几种弱酸的电离平衡常数如表所示。
(1)次氯酸(HClO)的电离方程式为________ 。
(2) 的电离平衡常数表达式K=
的电离平衡常数表达式K=_______ ,通过改变外界条件可以使K值发生变化,则使K值增大需改变的条件是_________ 。
(3)测得某HClO溶液中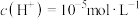 ,则该溶液中HClO的电离度约为
,则该溶液中HClO的电离度约为__________ [已知: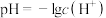 ,电离度是指已电离的电解质分子数占原来总分子数的百分比]。
,电离度是指已电离的电解质分子数占原来总分子数的百分比]。
(4) 的酸性由强到弱的顺序为
的酸性由强到弱的顺序为______ ;向 溶液中滴加HClO溶液发生反应的离子方程式为
溶液中滴加HClO溶液发生反应的离子方程式为__________ ;向 溶液中滴加HClO溶液发生反应的离子方程式为
溶液中滴加HClO溶液发生反应的离子方程式为___________ 。
酸 | 亚硫酸 | 碳酸 | 次氯酸 |
电离平衡常数 |
|
|
|
|
|
(2)
 的电离平衡常数表达式K=
的电离平衡常数表达式K=(3)测得某HClO溶液中
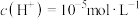 ,则该溶液中HClO的电离度约为
,则该溶液中HClO的电离度约为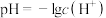 ,电离度是指已电离的电解质分子数占原来总分子数的百分比]。
,电离度是指已电离的电解质分子数占原来总分子数的百分比]。(4)
 的酸性由强到弱的顺序为
的酸性由强到弱的顺序为 溶液中滴加HClO溶液发生反应的离子方程式为
溶液中滴加HClO溶液发生反应的离子方程式为 溶液中滴加HClO溶液发生反应的离子方程式为
溶液中滴加HClO溶液发生反应的离子方程式为
您最近一年使用:0次
名校
解题方法
6 . 全球大气 浓度升高对人类生产、生活产生影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:
浓度升高对人类生产、生活产生影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:
(1)已知25℃时,大气中的 溶于水存在以下过程:
溶于水存在以下过程:
①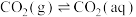
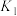
②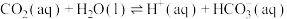

过程①的混合平衡常数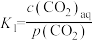 ,其中
,其中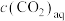 表示溶液中的
表示溶液中的 浓度,
浓度,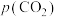 表示大气中
表示大气中 的分压(单位:kPa)。温度升高,
的分压(单位:kPa)。温度升高,
______ (填“增大”或“减小”);当大气压强为akPa,溶液中的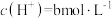 (忽略
(忽略 和水的电离)时,大气中
和水的电离)时,大气中 的体积分数为
的体积分数为______ 。
(2)由 转化制甲醇具有重要的经济效益。反应
转化制甲醇具有重要的经济效益。反应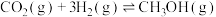
 ,在有、无催化剂条件下的反应机理和相对能量的变化如图所示(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。
,在有、无催化剂条件下的反应机理和相对能量的变化如图所示(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。
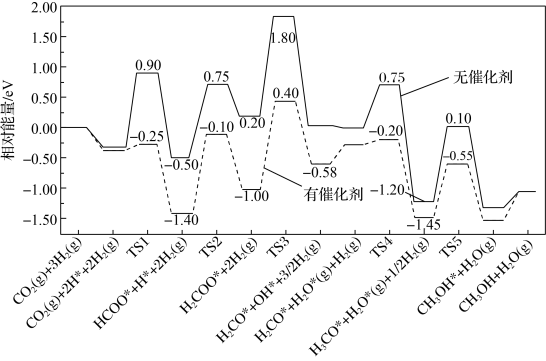
该反应历程中决速步骤的化学方程式为______ ,有催化剂时决速步骤的活化能为______ eV。
(3)一种脱除和利用工厂废气中 方法的示意图如下:
方法的示意图如下:
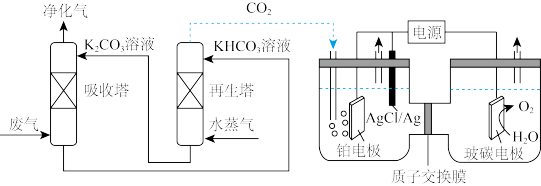
①某温度下,吸收塔中 溶液吸收一定量的
溶液吸收一定量的 后,溶液的
后,溶液的 ,则
,则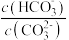 =
=______ (该温度下 的
的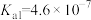 ,
,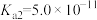 );
);
②再生塔中产生 的离子方程式为
的离子方程式为______ 。
③利用电化学原理将 同时转化为多种燃料(
同时转化为多种燃料( 、
、 、
、 及CO),将
及CO),将 电催化还原为
电催化还原为 ,阴极反应式为
,阴极反应式为______ 。若铂电极上只生成6.4g ,则正极区产生气体标准状况下的体积为
,则正极区产生气体标准状况下的体积为______ L。
 浓度升高对人类生产、生活产生影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:
浓度升高对人类生产、生活产生影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:(1)已知25℃时,大气中的
 溶于水存在以下过程:
溶于水存在以下过程:①
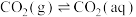
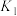
②
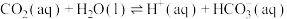

过程①的混合平衡常数
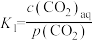 ,其中
,其中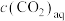 表示溶液中的
表示溶液中的 浓度,
浓度,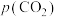 表示大气中
表示大气中 的分压(单位:kPa)。温度升高,
的分压(单位:kPa)。温度升高,
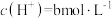 (忽略
(忽略 和水的电离)时,大气中
和水的电离)时,大气中 的体积分数为
的体积分数为(2)由
 转化制甲醇具有重要的经济效益。反应
转化制甲醇具有重要的经济效益。反应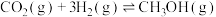
 ,在有、无催化剂条件下的反应机理和相对能量的变化如图所示(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。
,在有、无催化剂条件下的反应机理和相对能量的变化如图所示(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。
该反应历程中决速步骤的化学方程式为
(3)一种脱除和利用工厂废气中
 方法的示意图如下:
方法的示意图如下:
①某温度下,吸收塔中
 溶液吸收一定量的
溶液吸收一定量的 后,溶液的
后,溶液的 ,则
,则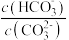 =
= 的
的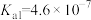 ,
,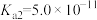 );
);②再生塔中产生
 的离子方程式为
的离子方程式为③利用电化学原理将
 同时转化为多种燃料(
同时转化为多种燃料( 、
、 、
、 及CO),将
及CO),将 电催化还原为
电催化还原为 ,阴极反应式为
,阴极反应式为 ,则正极区产生气体标准状况下的体积为
,则正极区产生气体标准状况下的体积为
您最近一年使用:0次
2022-12-08更新
|
540次组卷
|
2卷引用:山东省烟台市2023届高三上学期期中学业水平诊断化学试卷
7 . 党的二十大报告提出推动绿色发展,促进人与自然和谐共生。回答下列问题:
I.研究脱除烟气中的 是环境保护、促进社会可持续发展的重要课题。选择性催化还原技术是利用还原剂氨或尿素
是环境保护、促进社会可持续发展的重要课题。选择性催化还原技术是利用还原剂氨或尿素 ,把烟气中的
,把烟气中的 还原成
还原成 和
和 。相关反应的热化学方程式如下:
。相关反应的热化学方程式如下:
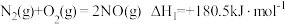
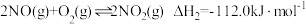
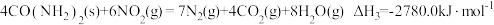
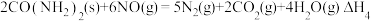
(1)①
_______ 。
②有氧条件下,在 基催化剂表面,
基催化剂表面, 还原
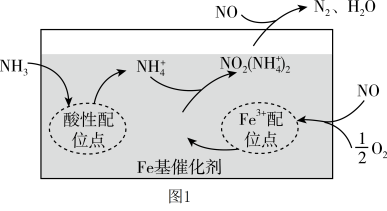
还原 的反应机理如图1所示,该过程可描述为
的反应机理如图1所示,该过程可描述为_______ 。
(2)近年来,低温等离子技术是在高压放电下, 产生
产生 自由基,
自由基, 自由基将
自由基将 氧化为
氧化为 后,再用
后,再用 溶液吸收,达到消除
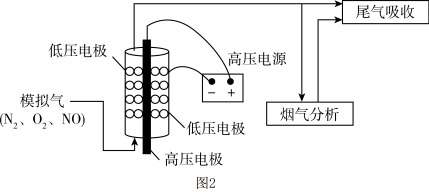
溶液吸收,达到消除 的目的。实验室将模拟气(
的目的。实验室将模拟气( 、
、 、
、 )以一定流速通入低温等离子体装置,实验装置如图2所示。
)以一定流速通入低温等离子体装置,实验装置如图2所示。
①等离子体技术在低温条件下可提高 的转化率,原因是
的转化率,原因是_______ 。
②其他条件相同,等离子体的电功率与 的转化率关系如图3所示,当电功率大于
的转化率关系如图3所示,当电功率大于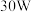 时,
时, 转化率下降的原因可能是
转化率下降的原因可能是_______ 。

II.以 为代表的温室气体排放已经成为一个十分严重的环境问题,因此,在化工生产中,脱除水煤气、天然气和合成气中的
为代表的温室气体排放已经成为一个十分严重的环境问题,因此,在化工生产中,脱除水煤气、天然气和合成气中的 具有十分重要的意义。一种脱除和利用水煤气中的
具有十分重要的意义。一种脱除和利用水煤气中的 的方法如下图所示:
的方法如下图所示:

(3)某温度下,吸收塔中 溶液吸收一定量的
溶液吸收一定量的 后,
后,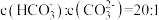 ,则该溶液的
,则该溶液的
_______ (该温度下 的
的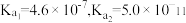 )。
)。
(4)利用电化学原理,将 电催化还原为
电催化还原为 ,阴极上除发生
,阴极上除发生 转化为
转化为 的反应外,另一个电极反应式为
的反应外,另一个电极反应式为_______ 。
III.
(5)在汽车排气管上安装催化转化器可以有效降低汽车尾气中的 和
和 ,反应的化学方程式为
,反应的化学方程式为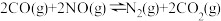 。若在恒温恒容的密闭容器中进行该反应,起始加入的
。若在恒温恒容的密闭容器中进行该反应,起始加入的 和
和 的物质的量之比为3∶2,起始压强为p,达到平衡时总压强为起始压强的85%,则该反应的化学平衡常数
的物质的量之比为3∶2,起始压强为p,达到平衡时总压强为起始压强的85%,则该反应的化学平衡常数
_______ ( 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
I.研究脱除烟气中的
 是环境保护、促进社会可持续发展的重要课题。选择性催化还原技术是利用还原剂氨或尿素
是环境保护、促进社会可持续发展的重要课题。选择性催化还原技术是利用还原剂氨或尿素 ,把烟气中的
,把烟气中的 还原成
还原成 和
和 。相关反应的热化学方程式如下:
。相关反应的热化学方程式如下: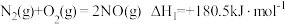
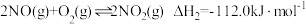
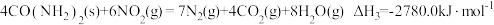
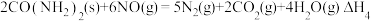
(1)①

②有氧条件下,在
 基催化剂表面,
基催化剂表面, 还原
还原 的反应机理如图1所示,该过程可描述为
的反应机理如图1所示,该过程可描述为
(2)近年来,低温等离子技术是在高压放电下,
 产生
产生 自由基,
自由基, 自由基将
自由基将 氧化为
氧化为 后,再用
后,再用 溶液吸收,达到消除
溶液吸收,达到消除 的目的。实验室将模拟气(
的目的。实验室将模拟气( 、
、 、
、 )以一定流速通入低温等离子体装置,实验装置如图2所示。
)以一定流速通入低温等离子体装置,实验装置如图2所示。
①等离子体技术在低温条件下可提高
 的转化率,原因是
的转化率,原因是②其他条件相同,等离子体的电功率与
 的转化率关系如图3所示,当电功率大于
的转化率关系如图3所示,当电功率大于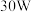 时,
时, 转化率下降的原因可能是
转化率下降的原因可能是
II.以
 为代表的温室气体排放已经成为一个十分严重的环境问题,因此,在化工生产中,脱除水煤气、天然气和合成气中的
为代表的温室气体排放已经成为一个十分严重的环境问题,因此,在化工生产中,脱除水煤气、天然气和合成气中的 具有十分重要的意义。一种脱除和利用水煤气中的
具有十分重要的意义。一种脱除和利用水煤气中的 的方法如下图所示:
的方法如下图所示:
(3)某温度下,吸收塔中
 溶液吸收一定量的
溶液吸收一定量的 后,
后,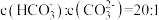 ,则该溶液的
,则该溶液的
 的
的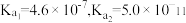 )。
)。(4)利用电化学原理,将
 电催化还原为
电催化还原为 ,阴极上除发生
,阴极上除发生 转化为
转化为 的反应外,另一个电极反应式为
的反应外,另一个电极反应式为III.
(5)在汽车排气管上安装催化转化器可以有效降低汽车尾气中的
 和
和 ,反应的化学方程式为
,反应的化学方程式为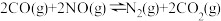 。若在恒温恒容的密闭容器中进行该反应,起始加入的
。若在恒温恒容的密闭容器中进行该反应,起始加入的 和
和 的物质的量之比为3∶2,起始压强为p,达到平衡时总压强为起始压强的85%,则该反应的化学平衡常数
的物质的量之比为3∶2,起始压强为p,达到平衡时总压强为起始压强的85%,则该反应的化学平衡常数
 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
您最近一年使用:0次
2022-11-14更新
|
1032次组卷
|
5卷引用:福建省2023届高三上学期11月联合测评化学试题
福建省2023届高三上学期11月联合测评化学试题(已下线)热点情景汇编-专题十二 原理应用中的新概念(已下线)化学(全国乙卷理综卷)-学易金卷:2023年高考第一次模拟考试卷陕西省西安市长安区第一中学2022-2023学年高二下学期第二次质量检测化学试题(已下线)原理综合题
8 . SO2属于严重大气污染物,不能直接排放在空气中,其两种处理方法如下:

已知:①25℃时,NH3·H2O的电离平衡常数Kb=1.8×10-5。
②相关物质的Ksp数据如下表所示。
请回答下列问题:
(1)方法1工艺中利用了SO2的_______ (填化学性质)。用过氧化氢也能氧化NH4HSO3溶液为铵盐溶液,过氧化氢电子式为_______ ,该反应的离子方程式为_______ 。将所得铵盐溶液进行_______ 、_______ 、过滤、洗涤、干燥操作后可得到无水铵盐。
(2)方法2生产工艺的优点有_______ 。
(3)方法2中为检验分离器的分离效果,取分离后的H2SO4溶液于试管中,向其中逐滴加入AgNO3溶液至充分反应,若观察到_______ ,证明分离效果较好。
(4)某含有大量氯化银沉淀的悬浊液中c(Cl-)=0.18mol·L-1,加入等体积的溴化钠溶液,若要产生溴化银沉淀,加入的溴化钠溶液的最小浓度是_______ mol·L-1。
(5)氨水是一种重要的弱电解质,常温下,向0.1mol·L–1氨水中加入少许NH4NO3,使溶液中c(NH3·H2O):c(NH )=1:18,此时溶液的pH=
)=1:18,此时溶液的pH=_______ 。

已知:①25℃时,NH3·H2O的电离平衡常数Kb=1.8×10-5。
②相关物质的Ksp数据如下表所示。
| 化学式 | Ag2SO4 | AgBr | AgCl |
| Ksp | 1.4×10-5 | 5.0×10-13 | 1.8×10-10 |
(1)方法1工艺中利用了SO2的
(2)方法2生产工艺的优点有
(3)方法2中为检验分离器的分离效果,取分离后的H2SO4溶液于试管中,向其中逐滴加入AgNO3溶液至充分反应,若观察到
(4)某含有大量氯化银沉淀的悬浊液中c(Cl-)=0.18mol·L-1,加入等体积的溴化钠溶液,若要产生溴化银沉淀,加入的溴化钠溶液的最小浓度是
(5)氨水是一种重要的弱电解质,常温下,向0.1mol·L–1氨水中加入少许NH4NO3,使溶液中c(NH3·H2O):c(NH
 )=1:18,此时溶液的pH=
)=1:18,此时溶液的pH=
您最近一年使用:0次
解题方法
9 . 回答下列问题:
(1)一定温度下,向1 L 0.1 mol·L-1 CH3COOH溶液中加入0.1 mol CH3COONa固体,则溶液中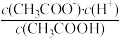
_______ (填“增大”“不变”或“减小”);写出该混合溶液中所有离子浓度之间存在的一个等式_______
(2)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可高达10.5,试用离子方程式解释土壤呈碱性的原因:_______ 。已知在25 ℃时, 水解反应的平衡常数即水解常数Kh=2.0×10-4,当溶液中c(
水解反应的平衡常数即水解常数Kh=2.0×10-4,当溶液中c(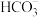 )∶c(
)∶c( )=2∶1时,溶液的pH=
)=2∶1时,溶液的pH=_______ 。
(3)Al2(SO4)3溶液加热蒸干并灼烧最终得到物质是_______ (填化学式),将NaHCO3与Al2(SO4)3两者溶液混合后可做泡沫灭火剂,其原理是_______ (用离子方程式表示)
(4)实验室溶液中常用NaOH来进行洗气和提纯。当100mL 1mol·L-1的NaOH溶液吸收标准状况下2.24LSO2时,所得溶液中各离子浓度由大到小的顺序为_______ 。
(5)25℃时,几种离子开始沉淀时的pH如下表:
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加NaOH溶液时,_______ 先沉淀(填离子符号),要使0.3mol·L-1硫酸铜溶液中Cu2+沉淀较为完全(当Cu2+浓度降至10-5 mol·L-1时),则应向溶液里加入氢氧化钠溶液使溶液pH为_______ (KspCu(OH)2=1×10-20)。
(1)一定温度下,向1 L 0.1 mol·L-1 CH3COOH溶液中加入0.1 mol CH3COONa固体,则溶液中
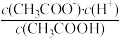
(2)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可高达10.5,试用离子方程式解释土壤呈碱性的原因:
 水解反应的平衡常数即水解常数Kh=2.0×10-4,当溶液中c(
水解反应的平衡常数即水解常数Kh=2.0×10-4,当溶液中c(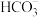 )∶c(
)∶c( )=2∶1时,溶液的pH=
)=2∶1时,溶液的pH=(3)Al2(SO4)3溶液加热蒸干并灼烧最终得到物质是
(4)实验室溶液中常用NaOH来进行洗气和提纯。当100mL 1mol·L-1的NaOH溶液吸收标准状况下2.24LSO2时,所得溶液中各离子浓度由大到小的顺序为
(5)25℃时,几种离子开始沉淀时的pH如下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
您最近一年使用:0次
10 . 某化工厂产生的废渣中含有PbSO4和Ag,为了回收这两种物质,某同学设计了如下流程:

已知:“浸出”过程发生可逆反应,AgCl+2 ⇌Ag(SO3)
⇌Ag(SO3) +Cl-,回答问题:
+Cl-,回答问题:
(1)将废渣“氧化”的化学方程式为_______ ,“氧化”阶段需在80℃条件下进行,最适合的加热方式为_______ 。操作I所需的玻璃仪器有_______ 。
(2)研究发现:其他条件不变时,该反应在敞口容器中进行,浸出时间过长会使银的浸出率(浸出液中银的质量占起始分银渣中银的质量的百分比)降低,可能原因是_______ (用离子方程式表示)。
(3)研究发现:浸出液中含银化合物总浓度与含硫化合物总浓度及浸出液pH的关系如下图。

①pH=10时,含银化合物总浓度随含硫化合物总浓度的变化趋势是_______ ;解释①中变化趋势的原因:_______ 。
②pH=5时,含银化合物总浓度随含硫化合物总浓度的变化与pH=10时不同,原因是_______ 。
(4)“还原”过程中氧化剂与还原剂物质的量之比为_______ 。

已知:“浸出”过程发生可逆反应,AgCl+2
 ⇌Ag(SO3)
⇌Ag(SO3) +Cl-,回答问题:
+Cl-,回答问题:(1)将废渣“氧化”的化学方程式为
(2)研究发现:其他条件不变时,该反应在敞口容器中进行,浸出时间过长会使银的浸出率(浸出液中银的质量占起始分银渣中银的质量的百分比)降低,可能原因是
(3)研究发现:浸出液中含银化合物总浓度与含硫化合物总浓度及浸出液pH的关系如下图。

①pH=10时,含银化合物总浓度随含硫化合物总浓度的变化趋势是
②pH=5时,含银化合物总浓度随含硫化合物总浓度的变化与pH=10时不同,原因是
(4)“还原”过程中氧化剂与还原剂物质的量之比为
您最近一年使用:0次
2022-08-21更新
|
380次组卷
|
2卷引用:广东省普宁市华侨中学2021-2022学年高三下学期第二次模拟考化学试题