回答下列问题:
(1)一定温度下,向1 L 0.1 mol·L-1 CH3COOH溶液中加入0.1 mol CH3COONa固体,则溶液中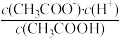
_______ (填“增大”“不变”或“减小”);写出该混合溶液中所有离子浓度之间存在的一个等式_______
(2)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可高达10.5,试用离子方程式解释土壤呈碱性的原因:_______ 。已知在25 ℃时, 水解反应的平衡常数即水解常数Kh=2.0×10-4,当溶液中c(
水解反应的平衡常数即水解常数Kh=2.0×10-4,当溶液中c(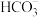 )∶c(
)∶c( )=2∶1时,溶液的pH=
)=2∶1时,溶液的pH=_______ 。
(3)Al2(SO4)3溶液加热蒸干并灼烧最终得到物质是_______ (填化学式),将NaHCO3与Al2(SO4)3两者溶液混合后可做泡沫灭火剂,其原理是_______ (用离子方程式表示)
(4)实验室溶液中常用NaOH来进行洗气和提纯。当100mL 1mol·L-1的NaOH溶液吸收标准状况下2.24LSO2时,所得溶液中各离子浓度由大到小的顺序为_______ 。
(5)25℃时,几种离子开始沉淀时的pH如下表:
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加NaOH溶液时,_______ 先沉淀(填离子符号),要使0.3mol·L-1硫酸铜溶液中Cu2+沉淀较为完全(当Cu2+浓度降至10-5 mol·L-1时),则应向溶液里加入氢氧化钠溶液使溶液pH为_______ (KspCu(OH)2=1×10-20)。
(1)一定温度下,向1 L 0.1 mol·L-1 CH3COOH溶液中加入0.1 mol CH3COONa固体,则溶液中
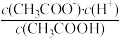
(2)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可高达10.5,试用离子方程式解释土壤呈碱性的原因:
 水解反应的平衡常数即水解常数Kh=2.0×10-4,当溶液中c(
水解反应的平衡常数即水解常数Kh=2.0×10-4,当溶液中c(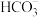 )∶c(
)∶c( )=2∶1时,溶液的pH=
)=2∶1时,溶液的pH=(3)Al2(SO4)3溶液加热蒸干并灼烧最终得到物质是
(4)实验室溶液中常用NaOH来进行洗气和提纯。当100mL 1mol·L-1的NaOH溶液吸收标准状况下2.24LSO2时,所得溶液中各离子浓度由大到小的顺序为
(5)25℃时,几种离子开始沉淀时的pH如下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
更新时间:2022-10-03 13:36:27
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】含硫烟气(主要成分为SO2)的处理备受关注,主要有以下两种方法。请回答:
I .碱液吸收法
步骤1:用足量氨水吸收SO2
步骤2:再加入熟石灰,发生反应2 +Ca2++2OH-+
+Ca2++2OH-+ =CaSO3↓+2NH3·H2O
=CaSO3↓+2NH3·H2O
(1)步骤1中反应的离子方程式为_______________________ 。
(2)已知:25°C时,Ksp(CaSO3)=b,步骤2中反应的平衡常数K=a。该温度下,Kb( NH3·H2O)=__________________ (用含a、b的代数式表示)。
Ⅱ.水煤气还原法
已知:①2CO(g)+SO2(g) S(l)+2CO2(g) △H1=-37.0 kJ·mol-1
S(l)+2CO2(g) △H1=-37.0 kJ·mol-1
②2H2(g)+ SO2(g) S(l)+2H2O(g) △H2=+45.4 kJ·mol-1
S(l)+2H2O(g) △H2=+45.4 kJ·mol-1
③CO的燃烧热△H3=-283 kJ·mol-1
(3)1molS(l)在O2(g)中完全燃烧生成SO2(g)的热化学方程式为____________ 。
(4)反应②的正反应的活化能为E1kJ·mol-1,其逆反应的活化能E2=_____ kJ·mol-1。
(5)在一定压强下,发生反应②。平衡时,α(SO2)与原料气投料比[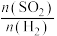 ]和温度(T) 的关系如图所示。
]和温度(T) 的关系如图所示。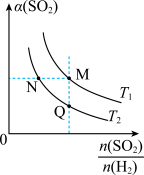
①α(H2):N_____ M (填“>”、“<”或 “ = ”)。
②逆反应速率:M_____ Q(填“>”、“<”或 “ = ”)。
(6)t℃时,向10L恒容密闭容器中充入2 molCO(g)、2 mol SO2(g)和2 mol H2(g)。发生反应①和反应②。5min达到平衡时,SO2(g)和CO2(g) 的物质的量分别为0.4mol、1.6mol。该温度下,反应②的平衡常数K=__________ 。
I .碱液吸收法
步骤1:用足量氨水吸收SO2
步骤2:再加入熟石灰,发生反应2
 +Ca2++2OH-+
+Ca2++2OH-+ =CaSO3↓+2NH3·H2O
=CaSO3↓+2NH3·H2O(1)步骤1中反应的离子方程式为
(2)已知:25°C时,Ksp(CaSO3)=b,步骤2中反应的平衡常数K=a。该温度下,Kb( NH3·H2O)=
Ⅱ.水煤气还原法
已知:①2CO(g)+SO2(g)
 S(l)+2CO2(g) △H1=-37.0 kJ·mol-1
S(l)+2CO2(g) △H1=-37.0 kJ·mol-1②2H2(g)+ SO2(g)
 S(l)+2H2O(g) △H2=+45.4 kJ·mol-1
S(l)+2H2O(g) △H2=+45.4 kJ·mol-1③CO的燃烧热△H3=-283 kJ·mol-1
(3)1molS(l)在O2(g)中完全燃烧生成SO2(g)的热化学方程式为
(4)反应②的正反应的活化能为E1kJ·mol-1,其逆反应的活化能E2=
(5)在一定压强下,发生反应②。平衡时,α(SO2)与原料气投料比[
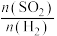 ]和温度(T) 的关系如图所示。
]和温度(T) 的关系如图所示。
①α(H2):N
②逆反应速率:M
(6)t℃时,向10L恒容密闭容器中充入2 molCO(g)、2 mol SO2(g)和2 mol H2(g)。发生反应①和反应②。5min达到平衡时,SO2(g)和CO2(g) 的物质的量分别为0.4mol、1.6mol。该温度下,反应②的平衡常数K=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】结合下表回答下列问题(均为常温下的数据):请回答下列问题:
(1)同浓度的 、
、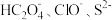 中结合
中结合 的能力最强的
的能力最强的___________ 。
(2)常温下0.1mol/L的 溶液在加水稀释过程中,下列表达式的数据一定变小的是___________(填字母)。
溶液在加水稀释过程中,下列表达式的数据一定变小的是___________(填字母)。
(3)取等体积物质的量浓度相等的 、HClO两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:
、HClO两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为: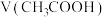
___________  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(4)在新制氯水中加入少量的NaCl固体,水的电离平衡___________ 移动(填“向右”、“向左”、或“不”)。
(5)某温度下,纯水中的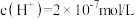 。若温度不变,滴入稀硫酸使
。若温度不变,滴入稀硫酸使 ,则由水电离出的
,则由水电离出的 为
为___________ mol/L。
| 酸 | 电离常数(Ka) |
 | 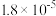 |
| HClO |  |
 |  |
 | 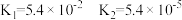 |
 | 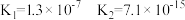 |
(1)同浓度的
 、
、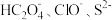 中结合
中结合 的能力最强的
的能力最强的(2)常温下0.1mol/L的
 溶液在加水稀释过程中,下列表达式的数据一定变小的是___________(填字母)。
溶液在加水稀释过程中,下列表达式的数据一定变小的是___________(填字母)。A. | B. |
C. | D. |
 、HClO两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:
、HClO两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为: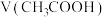
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)(4)在新制氯水中加入少量的NaCl固体,水的电离平衡
(5)某温度下,纯水中的
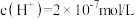 。若温度不变,滴入稀硫酸使
。若温度不变,滴入稀硫酸使 ,则由水电离出的
,则由水电离出的 为
为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关质的电离平衡常数如下表所示:
(1)可以作为HF是弱酸的判断依据的有:___________________
A.NaF溶液显碱性
B.物质的量浓度相同的和HF溶液导电性相同
C.氢氟酸与NaHCO3溶液混合,有气泡生成
(2)将浓度为0.1 mol· L-1溶液加水稀释一倍(假设温度不变)下列各量增大的是____________
A.c(H+) B.c(H+)· c(OH-) C. D.
D.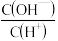
(3)物质的量浓度均为0.1 mol· L—1的下列四种溶液:①Na2CO3溶液 ②NaHCO3溶液③NaF溶液④NaClO溶液,溶液的pH最小的物质是____________
(4)在0.1mol的NaHCO3溶液中,下列关系正确的是______________
A.c(Na+)=2c(CO32-)+c(HCO3-)
B.c(H2CO3)> c(CO32-)
C. c(CO32-)+c(HCO3-)+c(H2CO3) =0. 1 mol· L-1
| 化学式 | HF | H2CO3 | HCIO |
| 电离平衡常数(Ka) | 7.2×10-4 | K1=4.4×10-7,K=4.7×10-11 | 3.0x10-8 |
(1)可以作为HF是弱酸的判断依据的有:
A.NaF溶液显碱性
B.物质的量浓度相同的和HF溶液导电性相同
C.氢氟酸与NaHCO3溶液混合,有气泡生成
(2)将浓度为0.1 mol· L-1溶液加水稀释一倍(假设温度不变)下列各量增大的是
A.c(H+) B.c(H+)· c(OH-) C.
 D.
D.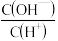
(3)物质的量浓度均为0.1 mol· L—1的下列四种溶液:①Na2CO3溶液 ②NaHCO3溶液③NaF溶液④NaClO溶液,溶液的pH最小的物质是
(4)在0.1mol的NaHCO3溶液中,下列关系正确的是
A.c(Na+)=2c(CO32-)+c(HCO3-)
B.c(H2CO3)> c(CO32-)
C. c(CO32-)+c(HCO3-)+c(H2CO3) =0. 1 mol· L-1
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】资源化利用二氧化硫,一方面能保护环境,另一方面能提高经济效益,具有深远意义。钠碱法的启动吸收剂为 溶液,捕捉
溶液,捕捉 后生成
后生成 和
和 的混合液。
的混合液。
(1)常温下进行“钠碱法”的模拟实验。用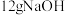 固体配成一定浓度的溶液,这些
固体配成一定浓度的溶液,这些 理论上最多可吸收
理论上最多可吸收 的体积约为
的体积约为___________ L(折算成标准状况)。若实验时只吸收了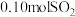 ,则反应后的吸收液中,所含负离子的浓度由大到小的顺序为
,则反应后的吸收液中,所含负离子的浓度由大到小的顺序为___________ 。
(2)当钠碱法的吸收液 达到4~6时,混合液中含较多量
达到4~6时,混合液中含较多量 。加热该溶液可回收得到较高纯度的
。加热该溶液可回收得到较高纯度的 ,剩余溶液可循环使用,进一步吸收
,剩余溶液可循环使用,进一步吸收 ,剩余溶液的主要溶质是
,剩余溶液的主要溶质是___________ (填写化学式)。
(3)将 通入
通入 溶液时,得到一组
溶液时,得到一组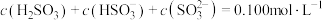 的混合溶液,溶液中部分微粒的物质的量浓度随
的混合溶液,溶液中部分微粒的物质的量浓度随 的关系曲线如下图所示。
的关系曲线如下图所示。
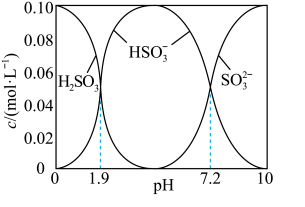
若溶液的 ,溶液中
,溶液中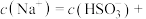
___________ 此时溶液中
___________  。(选填“>”、“<”或“=”)
。(选填“>”、“<”或“=”)
(4)亚硫酸为二元弱酸, 时,其电离常数
时,其电离常数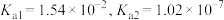 。请说明
。请说明 溶液呈酸性的理由。
溶液呈酸性的理由。___________ 。
(5)工业中可用含 的冶炼烟气为原料生产硫酸,在如图装置中完成“
的冶炼烟气为原料生产硫酸,在如图装置中完成“ 转化”工序。使用该装置实现了
转化”工序。使用该装置实现了___________ (选填编号)。
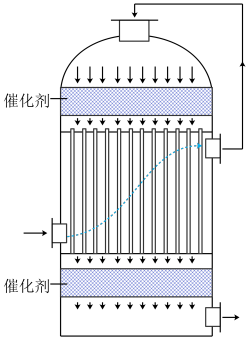
a.充分利用热能 b.防止形成酸雾 c.加速转化 d.获取纯净
d.获取纯净
 溶液,捕捉
溶液,捕捉 后生成
后生成 和
和 的混合液。
的混合液。(1)常温下进行“钠碱法”的模拟实验。用
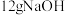 固体配成一定浓度的溶液,这些
固体配成一定浓度的溶液,这些 理论上最多可吸收
理论上最多可吸收 的体积约为
的体积约为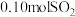 ,则反应后的吸收液中,所含负离子的浓度由大到小的顺序为
,则反应后的吸收液中,所含负离子的浓度由大到小的顺序为(2)当钠碱法的吸收液
 达到4~6时,混合液中含较多量
达到4~6时,混合液中含较多量 。加热该溶液可回收得到较高纯度的
。加热该溶液可回收得到较高纯度的 ,剩余溶液可循环使用,进一步吸收
,剩余溶液可循环使用,进一步吸收 ,剩余溶液的主要溶质是
,剩余溶液的主要溶质是(3)将
 通入
通入 溶液时,得到一组
溶液时,得到一组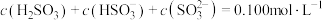 的混合溶液,溶液中部分微粒的物质的量浓度随
的混合溶液,溶液中部分微粒的物质的量浓度随 的关系曲线如下图所示。
的关系曲线如下图所示。
若溶液的
 ,溶液中
,溶液中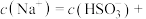

 。(选填“>”、“<”或“=”)
。(选填“>”、“<”或“=”)(4)亚硫酸为二元弱酸,
 时,其电离常数
时,其电离常数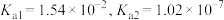 。请说明
。请说明 溶液呈酸性的理由。
溶液呈酸性的理由。(5)工业中可用含
 的冶炼烟气为原料生产硫酸,在如图装置中完成“
的冶炼烟气为原料生产硫酸,在如图装置中完成“ 转化”工序。使用该装置实现了
转化”工序。使用该装置实现了
a.充分利用热能 b.防止形成酸雾 c.加速转化
 d.获取纯净
d.获取纯净
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】I、根据表中数据(常温下),完成下列填空。
(1)常温下,NaCN溶液呈___________ (填“酸”、“碱”或“中”)性,其原因是___________ (用离子方程式表示)。
(2)常温下,浓度均为 的下列4种溶液:①
的下列4种溶液:① 溶液,②NaCN溶液,③
溶液,②NaCN溶液,③ 溶液,④NaClO溶液;这4种溶液pH由大到小的顺序是
溶液,④NaClO溶液;这4种溶液pH由大到小的顺序是___________ (填序号)。
(3)常温下, 溶液中
溶液中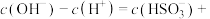
___________ 。
II、我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过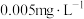 。处理含镉废水可采用化学沉淀法。已知:
。处理含镉废水可采用化学沉淀法。已知: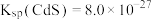 ;回答下列问题:
;回答下列问题:
(4)向某含镉废水中加入 ,当
,当 浓度达到
浓度达到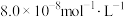 时,废水中
时,废水中 的浓度为
的浓度为___________  ,此时是否符合生活饮用水卫生标准
,此时是否符合生活饮用水卫生标准___________ (填“是”或“否”)。
| 物质 |  |  |  |  |  |  |
电离常数( ) ) |  |  |  |  | 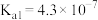  | 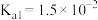  |
(1)常温下,NaCN溶液呈
(2)常温下,浓度均为
 的下列4种溶液:①
的下列4种溶液:① 溶液,②NaCN溶液,③
溶液,②NaCN溶液,③ 溶液,④NaClO溶液;这4种溶液pH由大到小的顺序是
溶液,④NaClO溶液;这4种溶液pH由大到小的顺序是(3)常温下,
 溶液中
溶液中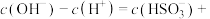
II、我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过
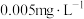 。处理含镉废水可采用化学沉淀法。已知:
。处理含镉废水可采用化学沉淀法。已知: ;回答下列问题:
;回答下列问题:(4)向某含镉废水中加入
 ,当
,当 浓度达到
浓度达到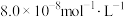 时,废水中
时,废水中 的浓度为
的浓度为 ,此时是否符合生活饮用水卫生标准
,此时是否符合生活饮用水卫生标准
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:______________ 。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是________________________
(3)吸收液吸收SO2的过程中,pH随n(SO3²﹣):n(HSO3﹣)变化关系如下表:
①上表判断NaHSO3溶液显______ 性,用化学平衡原理解释:____________
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):____________
a.c(Na+)=2c(SO32-)+c(HSO3-),
b.c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
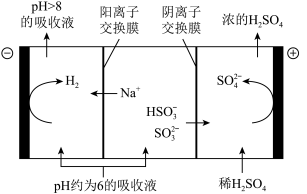
①HSO3-在阳极放电的电极反应式是_______________ 。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:__________
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是
(3)吸收液吸收SO2的过程中,pH随n(SO3²﹣):n(HSO3﹣)变化关系如下表:
| n(SO₃²﹣):n(HSO₃﹣) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
a.c(Na+)=2c(SO32-)+c(HSO3-),
b.c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:

①HSO3-在阳极放电的电极反应式是
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】科研、生产中常涉及钠、硫及其化合物。
(1)实验室可用无水乙醇处理少量残留的金属钠,化学反应方程式为_______ 。要清洗附着在试管壁上的硫,可用的试剂是_______ 。
(2)右图为钠硫高能电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+xS=Na2Sx,正极的电极反应式为______ 。M(由Na2O和Al2O3制得)的两个作用是___ 。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的__ 倍。

(3)Na2S溶液中离子浓度由大到小的顺序为________ ,向该溶液中加入少量固体CuSO4,溶液pH_____ (填“增大”“减小”或“不变”),Na2S溶液长期放置有硫析出,原因为__________ (用离子方程式表示)。
(1)实验室可用无水乙醇处理少量残留的金属钠,化学反应方程式为
(2)右图为钠硫高能电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+xS=Na2Sx,正极的电极反应式为

(3)Na2S溶液中离子浓度由大到小的顺序为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】减少二氧化碳的排放,氮氧化物、二氧化硫的处理与利用是一项重要的热点课题。
Ⅰ.CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) △H
C2H4(g)+4H2O(g) △H
在0.1 MPa时,按n(CO2):n(H2)=1:3投料,不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系如图:
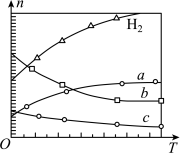
(1)该反应的△H_______ 0(填“>”、“=”或“<”)。
(2)曲线b表示的物质为_______ 。
(3)为提高CO2的平衡转化率,除改变温度外,还可采取的措施是_______ 。
Ⅱ.在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图:
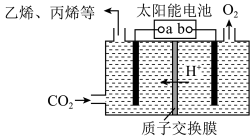
(4)图中b为电源的_______ 极,电解时,生成乙烯的电极反应式是_______ 。
Ⅲ.用活性炭还原法可以处理氮氧化物。如反应:C(s)+2NO(g)⇌N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
(5)Tl℃时,该反应的平衡常数K=_______ 。
(6)30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是_______ (答一种即可)。
Ⅳ.工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均呈酸性。
(7)相同条件下,同浓度的两种酸式盐的水溶液中c( )较小的是
)较小的是_______ ,用文字和化学用语解释原因_______ 。
Ⅰ.CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g) △H
C2H4(g)+4H2O(g) △H在0.1 MPa时,按n(CO2):n(H2)=1:3投料,不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系如图:

(1)该反应的△H
(2)曲线b表示的物质为
(3)为提高CO2的平衡转化率,除改变温度外,还可采取的措施是
Ⅱ.在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图:

(4)图中b为电源的
Ⅲ.用活性炭还原法可以处理氮氧化物。如反应:C(s)+2NO(g)⇌N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间(min) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
(6)30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是
Ⅳ.工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均呈酸性。
(7)相同条件下,同浓度的两种酸式盐的水溶液中c(
 )较小的是
)较小的是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。当向其中加入少量酸或碱时,溶液的酸碱性变化不大。回答下列问题:
(1)将该溶液两等分,向其中加入少量盐酸时,发生反应的离子方程式为______ ;另一份加入少量KOH溶液时,发生反应的离子方程式为______ 。
(2)现将0.04mol•L-1HA溶液和0.02mol•L-1NaOH溶液等体积混合,得到缓冲溶液。
①若HA为HCN,该缓冲溶液显碱性,则溶液中c(Na+)______ c(CN-)。(填“<”“=”或“>”);
②若HA为CH3COOH,该缓冲溶液显酸性。则溶液中所有的离子按浓度由大到小排列的顺序是______ 。
(3)缓冲溶液一般是由浓度较大的弱酸及其共轭碱所组成,其pH值的近似计算公式为:pH=pK酸+lg[c共轭碱/c酸]。人体血液中的H2CO3-HCO3-平衡起到缓冲作用。实测某人血液的pH=7.2,c( )=2.3×10-2mol/L,且已知血液中的H2CO3的pKa1=6.2。则此人血液中的c(H2CO3)=
)=2.3×10-2mol/L,且已知血液中的H2CO3的pKa1=6.2。则此人血液中的c(H2CO3)=______ mol/L。
(1)将该溶液两等分,向其中加入少量盐酸时,发生反应的离子方程式为
(2)现将0.04mol•L-1HA溶液和0.02mol•L-1NaOH溶液等体积混合,得到缓冲溶液。
①若HA为HCN,该缓冲溶液显碱性,则溶液中c(Na+)
②若HA为CH3COOH,该缓冲溶液显酸性。则溶液中所有的离子按浓度由大到小排列的顺序是
(3)缓冲溶液一般是由浓度较大的弱酸及其共轭碱所组成,其pH值的近似计算公式为:pH=pK酸+lg[c共轭碱/c酸]。人体血液中的H2CO3-HCO3-平衡起到缓冲作用。实测某人血液的pH=7.2,c(
 )=2.3×10-2mol/L,且已知血液中的H2CO3的pKa1=6.2。则此人血液中的c(H2CO3)=
)=2.3×10-2mol/L,且已知血液中的H2CO3的pKa1=6.2。则此人血液中的c(H2CO3)=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。
消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
2CO(g)+2NO(g) 2CO2(g)+N2(g) ΔH1=-748kJ·mol-1
2CO2(g)+N2(g) ΔH1=-748kJ·mol-1
2CO(g)+O2(g)===2CO2(g) ΔH2=-565kJ·mol-1
(1)在一定条件下N2和O2会转化为NO,写出该反应的热化学方程式:_________ 。
(2)为研究不同条件对反应的影响,在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.4mol CO,在催化剂存在的条件下发生反应,10min时反应达到平衡,测得10min内v(NO)=7.5×10-3mol·L-1·min-1,则平衡后n(CO)=________ mol,关于该平衡的下列说法正确的是________ 。
a.增大压强,平衡一定向右移动
b.其他条件不变,升高温度,化学反应速率一定增大
c.其他条件不变,若改为在恒压容器中进行,CO的平衡转化率比恒容条件下大
d.达到平衡后v正(NO)=2v逆(N2)
(3)其他条件相同,t min时不同温度下测得NO的转化率如图所示。
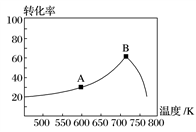
A点的反应速度v正________ (填“>”、“<”或“=”)v逆,A、B两点反应的平衡常数较大的是________ (填“A”或“B”)。
(4)已知HNO2的电离常数Ka=7.1×10-4mol·L-1;
NH3·H2O的电离常数Kb=1.7×10-5mol·L-1
则0.1mol·L-1NH4NO2溶液中离子浓度由大到小的顺序是____________________________ ,
常温下NO2-水解反应的平衡常数Kh=________ (保留两位有效数字)。
消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
2CO(g)+2NO(g)
 2CO2(g)+N2(g) ΔH1=-748kJ·mol-1
2CO2(g)+N2(g) ΔH1=-748kJ·mol-12CO(g)+O2(g)===2CO2(g) ΔH2=-565kJ·mol-1
(1)在一定条件下N2和O2会转化为NO,写出该反应的热化学方程式:
(2)为研究不同条件对反应的影响,在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.4mol CO,在催化剂存在的条件下发生反应,10min时反应达到平衡,测得10min内v(NO)=7.5×10-3mol·L-1·min-1,则平衡后n(CO)=
a.增大压强,平衡一定向右移动
b.其他条件不变,升高温度,化学反应速率一定增大
c.其他条件不变,若改为在恒压容器中进行,CO的平衡转化率比恒容条件下大
d.达到平衡后v正(NO)=2v逆(N2)
(3)其他条件相同,t min时不同温度下测得NO的转化率如图所示。

A点的反应速度v正
(4)已知HNO2的电离常数Ka=7.1×10-4mol·L-1;
NH3·H2O的电离常数Kb=1.7×10-5mol·L-1
则0.1mol·L-1NH4NO2溶液中离子浓度由大到小的顺序是
常温下NO2-水解反应的平衡常数Kh=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】我国科学家开发新型高效催化剂,在太阳能作用下制备双氧水。
I.双氧水不稳定。
(1)实验研究发现,碘离子催化双氧水分解反应分两步进行,其反应历程如图所示。
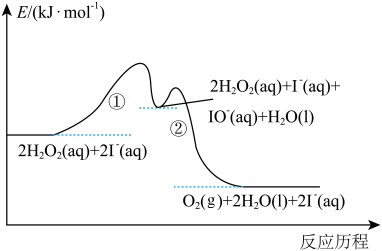
①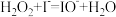 ;
;
②_______ (补充离子方程式)。其中,反应_______ 控制总反应速率(填“①”或“②”)。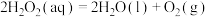

_______ 0(填“>”“<”或“=”)。
(2)双氧水在碘离子催化下发生分解反应: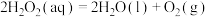 ,其速率方程为
,其速率方程为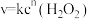 (k为速率常数,只与温度、催化剂有关;n为反应级数,可以为零、分数或整数)。双氧水在常温下的分解速率与浓度的关系如表所示。
(k为速率常数,只与温度、催化剂有关;n为反应级数,可以为零、分数或整数)。双氧水在常温下的分解速率与浓度的关系如表所示。
常温下,该反应的速率常数
_______ (不写单位)。
II.查阅资料知: 是一种弱酸,298K时
是一种弱酸,298K时 的
的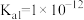 ,
,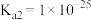 。
。
(3)298K时,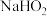 溶液中
溶液中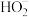 的水解常数为
的水解常数为_______ 。
III.测定双氧水溶液的浓度。
(4)已知:酸性条件下,双氧水和高锰酸钾反应, 生成,写出反应的离子方程式:
生成,写出反应的离子方程式:_______ 。
(5)取 mL某双氧水溶液于锥形瓶中,稀释至250 mL。取稀释后的溶液25.00 mL于锥形瓶中,加入适量的稀硫酸,用c mol·L
mL某双氧水溶液于锥形瓶中,稀释至250 mL。取稀释后的溶液25.00 mL于锥形瓶中,加入适量的稀硫酸,用c mol·L
 标准溶液滴定至终点时,消耗滴定液V mL。该双氧水溶液中
标准溶液滴定至终点时,消耗滴定液V mL。该双氧水溶液中
_______ mol·L (用含c、V、
(用含c、V、 的代数式表示)。若滴定管用蒸馏水洗涤后没有用
的代数式表示)。若滴定管用蒸馏水洗涤后没有用 标准溶液润洗,则测得的结果
标准溶液润洗,则测得的结果_______ (填“偏高”“偏低”或“无影响”)。
I.双氧水不稳定。
(1)实验研究发现,碘离子催化双氧水分解反应分两步进行,其反应历程如图所示。

①
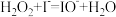 ;
;②
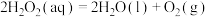

(2)双氧水在碘离子催化下发生分解反应:
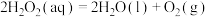 ,其速率方程为
,其速率方程为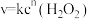 (k为速率常数,只与温度、催化剂有关;n为反应级数,可以为零、分数或整数)。双氧水在常温下的分解速率与浓度的关系如表所示。
(k为速率常数,只与温度、催化剂有关;n为反应级数,可以为零、分数或整数)。双氧水在常温下的分解速率与浓度的关系如表所示。| 序号 | 反应时间/min |  /(mol·L /(mol·L ) ) | v/(mol·L ·min ·min ) ) |
| ① | 0 | 0.80 | 0 |
| ② | 20 | 0.40 | 0.020 |
| ③ | 40 | 0.20 | 0.010 |
| ④ | 60 | 0.10 | 0.005 |
| ⑤ | 80 | 0.05 | 0.0025 |

II.查阅资料知:
 是一种弱酸,298K时
是一种弱酸,298K时 的
的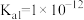 ,
,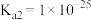 。
。(3)298K时,
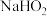 溶液中
溶液中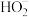 的水解常数为
的水解常数为III.测定双氧水溶液的浓度。
(4)已知:酸性条件下,双氧水和高锰酸钾反应,
 生成,写出反应的离子方程式:
生成,写出反应的离子方程式:(5)取
 mL某双氧水溶液于锥形瓶中,稀释至250 mL。取稀释后的溶液25.00 mL于锥形瓶中,加入适量的稀硫酸,用c mol·L
mL某双氧水溶液于锥形瓶中,稀释至250 mL。取稀释后的溶液25.00 mL于锥形瓶中,加入适量的稀硫酸,用c mol·L
 标准溶液滴定至终点时,消耗滴定液V mL。该双氧水溶液中
标准溶液滴定至终点时,消耗滴定液V mL。该双氧水溶液中
 (用含c、V、
(用含c、V、 的代数式表示)。若滴定管用蒸馏水洗涤后没有用
的代数式表示)。若滴定管用蒸馏水洗涤后没有用 标准溶液润洗,则测得的结果
标准溶液润洗,则测得的结果
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】请回答下列问题:
(1)已知:N2、O2分子中化学键的键能分别是946kJ/moL、497kJ/mol。N2 (g)+ O2 (g)=2NO(g) ∆H=+180.0kJ/moL。则相同条件下破坏1molNO中化学键需要吸收的能量为_____ kJ.
(2)25℃时,pH=5的CH3COOH溶液中,由水电离出的氢离子浓度c(H+)=_____ mol/L。
若加入少量NaOH固体,则溶液中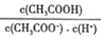
_____ (填"增大”、“减小”或“不变”)。
(3)25℃下,向某Na2CO3溶液中加入稀盐酸,其含碳元素的微粒物质的量分数(ψ)随溶液pH变化的部分情况如图所示。
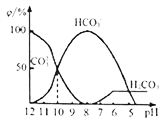
①在同一溶液中,H2CO3、HCO3-、CO32-____ (填“能”或“不能”) 大量共存。
②pH=12时,Na2CO3溶液中物料守恒关系为______ 。当pH=7时,溶液中含碳元素的微粒主要为_________ 。
③反应的CO32-+H2O HCO3-+OH-的平衡常数Kh=
HCO3-+OH-的平衡常数Kh=_____ 。
(1)已知:N2、O2分子中化学键的键能分别是946kJ/moL、497kJ/mol。N2 (g)+ O2 (g)=2NO(g) ∆H=+180.0kJ/moL。则相同条件下破坏1molNO中化学键需要吸收的能量为
(2)25℃时,pH=5的CH3COOH溶液中,由水电离出的氢离子浓度c(H+)=
若加入少量NaOH固体,则溶液中
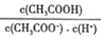
(3)25℃下,向某Na2CO3溶液中加入稀盐酸,其含碳元素的微粒物质的量分数(ψ)随溶液pH变化的部分情况如图所示。

①在同一溶液中,H2CO3、HCO3-、CO32-
②pH=12时,Na2CO3溶液中物料守恒关系为
③反应的CO32-+H2O
 HCO3-+OH-的平衡常数Kh=
HCO3-+OH-的平衡常数Kh=
您最近一年使用:0次



