11-12高二上·辽宁沈阳·期中
1 . 高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
由以上表格中数据判断以下说法不正确的是
| 酸 | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6× 10-5mol·L-1 | 6.3× 10-9mol·L-1 | 1.6× 10-9mol·L-1 | 4.2× 10-10mol·L-1 |
| A.在冰醋酸中这四种酸都没有完全电离 |
| B.在冰醋酸中高氯酸是这四种酸中酸性最强的酸 |
C.在冰醋酸中硫酸的电离方程式为H2SO4=2H++SO |
| D.水对这四种酸的强弱没有区分能力,但冰醋酸可以区分这四种酸的强弱 |
您最近一年使用:0次
2023-08-27更新
|
801次组卷
|
52卷引用:河北省新乐市第一中学2022-2023学年高二上学期11月期中考试化学试题
河北省新乐市第一中学2022-2023学年高二上学期11月期中考试化学试题2015-2016学年河北省冀州中学高二上第二次月考化学试卷河北省承德第一中学2020届高三10月月考化学试题河北省邯郸市大名县第一中学2020-2021学年高二上学期10月月考化学试题(普通版)河北正定中学2020-2021学年高二上学期第一次半月考化学试题河北省唐山市第十一中学2021-2022学年高二上学期期中考试化学试题陕西省西安中学2021-2022学年高二上学期期末考试化学试题河南省濮阳市第一高级中学2021-2022学年高二下学期期中考试化学试题海南省琼海市嘉积第二中学2021-2022学年高二下学期教学质量监测(段考)化学科试题 四川省广安市第二中学校2022-2023学年高二上学期11月期中考试化学试题江苏省宿迁市北大附属宿迁实验学校2022-2023学年高二上学期11月期中化学试题(已下线)选择题16-20(已下线)2011-2012学年辽宁省沈阳四校协作体高二上学期期中考试化学试卷(已下线)2012-2013学年江西省赣州市十一县(市)高二上学期期中联考化学试卷(已下线)2015安徽望江中学同步课时练(人教选修4)3.1弱电解质的电离试卷(已下线)2014秋湖北省武汉市部分重点中学高二上学期期中联考化学试卷2014-2015湖南省益阳市箴言中学高二1月月考化学试卷2015-2016学年吉林实验中学高二上学期期中考试化学试卷12015-2016学年吉林实验中学高二上学期期中考试化学试卷22015-2016学年内蒙古赤峰二中高二上第二次月考化学试卷2015-2016学年福建晨曦、冷曦、正曦、岐滨四校高二上联考化学卷2015-2016学年江西省丰城中学高二上学期期中考试化学试卷江西省南康中学2017-2018学年高二上学期第一次月考化学试题湖南省祁阳四中2018届高三第四次月考化学试题(已下线)2018年10月28日 《每日一题》人教选修4--每周一测江西省上高县第二中学2019-2020学年高二上学期第一次月考化学试题江苏省南京师大苏州实验学校2019-2020学年高二9月月考化学试题(已下线)上海市徐汇区2010届高三上学期期末学习能力诊断化学试题人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第一节 电离平衡 教材帮湖南省临澧县第一中学2020-2021学年高二上学期期中考试化学试题(选考)重庆市凤鸣山中学2020-2021学年高二上学期期中考试化学试题(已下线)第03章 水溶液中的离子反应与平衡(A卷基础强化篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)湖南省临澧县第一中学2020-2021学年高二下学期阶段性考试(二)化学试题福建省莆田第十五中学2019-2020学年高二下学期期末考试化学试题吉林省长春外国语学校2021-2022学年高二上学期第一次月考化学试题湖北省黄冈市浠水县实验高级中学2021-2022学年高二上学期九月月考化学试题(已下线)专题3.1 电离平衡(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)(已下线)3.1.2 电离平衡常数-2021-2022学年高二化学课后培优练(人教版选修4)山东省济南市第一中学2021-2022学年高二上学期期中考试化学试题(已下线)必考点05 电离平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)广东省高州市校际2021-2022学年高二11月联考化学试题陕西省西安市第一中学2021-2022学年高二上学期期中考试化学试题安徽省马鞍山市第二中学2021-2022学年高二上学期期中考试化学试题新疆生产建设兵团第二师八一中学2021-2022学年高二上学期期中考试化学试题广东番禺中学2022-2023学年高二下学期科开学考试化学试题作业(十八) 弱电解质的电离平衡浙江省浙南名校联盟2023-2024学年高二上学期10月联考化学试题【精品卷】3.1.3电离平衡常数课堂例题-人教版2023-2024学年选择性必修1(已下线)BBWYhjhx1106.pdf广东省清远市阳山县南阳中学2023-2024学年高二上学期第二次月考(期中)化学试题湖南省郴州市明星高级中学2023-2024学年高二上学期期中考试化学试题甘肃省白银市会宁县第三中学2023-2024学年高二上学期期中考试化学试题
2 . 回答下列问题
(1)99℃时, ,该温度下测得
,该温度下测得
 溶液的
溶液的 。
。 在水溶液中的电离方程式为
在水溶液中的电离方程式为___________ 。
(2)常温下, 为二元弱酸,
为二元弱酸,
 溶液的
溶液的 ,则该溶液中下列微粒的浓度
,则该溶液中下列微粒的浓度
① ②
② ③
③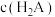 ④
④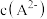 ⑤
⑤ 由大到小的顺序为
由大到小的顺序为___________ (填序号)。
(3)①25℃时,向1L0.1mol/LCH3COOH溶液中加入0.1molCH3COONa固体,则醋酸的电离平衡向___________ (填“正”或“逆”)反应方向移动:水的电离程度将___________ (填“增大”、“减小”或“不变”)。
②25℃时,CH3COOH的电离平衡常数Ka=1.75×10-5,则CH3COONa水解常数Kh=___________ (保留三位有效数字)。改变下列条件,能使CH3COONa稀溶液中 增大的是
增大的是___________ 。
a.降温 b.加入 固体 c.稀释 d.加入
固体 c.稀释 d.加入 固体
固体
(4)在剧烈运动中,因缺氧肌肉会产生乳酸(HL),而血液中,乳酸与碳酸氢盐发生复分解反应。已知乳酸(HL)是一元酸,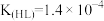 。碳酸的电离平衡常数为:
。碳酸的电离平衡常数为: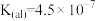 ,
,
① 乳酸的
乳酸的 为
为___________ (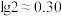 ,
,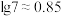 )
)
②乳酸和碳酸氢盐反应的平衡常数的数值___________ 。
(1)99℃时,
 ,该温度下测得
,该温度下测得
 溶液的
溶液的 。
。 在水溶液中的电离方程式为
在水溶液中的电离方程式为(2)常温下,
 为二元弱酸,
为二元弱酸,
 溶液的
溶液的 ,则该溶液中下列微粒的浓度
,则该溶液中下列微粒的浓度①
 ②
② ③
③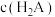 ④
④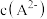 ⑤
⑤ 由大到小的顺序为
由大到小的顺序为(3)①25℃时,向1L0.1mol/LCH3COOH溶液中加入0.1molCH3COONa固体,则醋酸的电离平衡向
②25℃时,CH3COOH的电离平衡常数Ka=1.75×10-5,则CH3COONa水解常数Kh=
 增大的是
增大的是a.降温 b.加入
 固体 c.稀释 d.加入
固体 c.稀释 d.加入 固体
固体(4)在剧烈运动中,因缺氧肌肉会产生乳酸(HL),而血液中,乳酸与碳酸氢盐发生复分解反应。已知乳酸(HL)是一元酸,
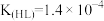 。碳酸的电离平衡常数为:
。碳酸的电离平衡常数为: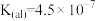 ,
,
①
 乳酸的
乳酸的 为
为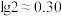 ,
,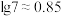 )
)②乳酸和碳酸氢盐反应的平衡常数的数值
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
3 . 常温下,将V0mL1.0mol·L-1HX和V0mL1.0mol·L-1HY两种酸溶液分别加水稀释至体积为VmL,稀释液pH与其体积变化的关系如图所示。下列说法正确的是


| A.HX和HY均为一元弱酸 |
| B.常温下,浓度均为0.10mol·L-1的NaX和NaY溶液,溶液pH:NaX<NaY |
| C.M、N两点对应溶液中一定存在:c(Y-)=c(X-)+c(HX) |
| D.分别往M、N两点对应溶液中滴加1.0mol·L-1NaOH溶液至恰好完全反应,消耗NaOH溶液的体积相等 |
您最近一年使用:0次
解题方法
4 . 向 浓度均为
浓度均为 的
的 和
和 的混合溶液中加入等浓度的氨水,溶液中金属元素有不同的存在形式,它们的物质的量浓度与氨水
的混合溶液中加入等浓度的氨水,溶液中金属元素有不同的存在形式,它们的物质的量浓度与氨水 体积关系如图所示,测得M、N点溶液
体积关系如图所示,测得M、N点溶液 分别为8.04、8.95。
分别为8.04、8.95。

已知:ⅰ.

ⅱ. 。
。
下列说法正确的是
 浓度均为
浓度均为 的
的 和
和 的混合溶液中加入等浓度的氨水,溶液中金属元素有不同的存在形式,它们的物质的量浓度与氨水
的混合溶液中加入等浓度的氨水,溶液中金属元素有不同的存在形式,它们的物质的量浓度与氨水 体积关系如图所示,测得M、N点溶液
体积关系如图所示,测得M、N点溶液 分别为8.04、8.95。
分别为8.04、8.95。
已知:ⅰ.


ⅱ.
 。
。下列说法正确的是
A.曲线Y表示 |
B. |
C.N点锌元素的主要存在形式是 |
D.  |
您最近一年使用:0次
5 . 常温下,向 二元弱酸
二元弱酸 溶液中滴加
溶液中滴加 溶液,溶液中
溶液,溶液中 、
、 、
、 的分布分数[如
的分布分数[如 的分布分数:
的分布分数: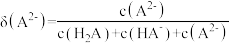 ]随溶液
]随溶液 的变化如图所示。下列叙述正确的是
的变化如图所示。下列叙述正确的是

 二元弱酸
二元弱酸 溶液中滴加
溶液中滴加 溶液,溶液中
溶液,溶液中 、
、 、
、 的分布分数[如
的分布分数[如 的分布分数:
的分布分数: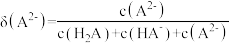 ]随溶液
]随溶液 的变化如图所示。下列叙述正确的是
的变化如图所示。下列叙述正确的是
A.曲线②代表 的分布分数随溶液 的分布分数随溶液 的变化 的变化 |
B.常温下, 的平衡常数为 的平衡常数为 |
C.当 时, 时, |
D.当 时,溶液中存在: 时,溶液中存在: |
您最近一年使用:0次
2022-12-15更新
|
161次组卷
|
6卷引用:河北省名校联考2022-2023学年高二上学期12月联考化学试题
名校
6 . 下列物质中:①CH3COOH②NH3③NH4Cl④盐酸⑤NaOH⑥NaHCO3溶液。
(1)属于弱电解质的是____ (填序号,下同),属于强电解质且其水溶液呈碱性的是____ 。
(2)在氨水中存在电离平衡:NH3•H2O NH
NH +OH-。将上述六种物质分别配成0.1mol/L的溶液,向稀氨水中分别滴加少量六种溶液,能使氨水的电离平衡逆向移动且c(NH
+OH-。将上述六种物质分别配成0.1mol/L的溶液,向稀氨水中分别滴加少量六种溶液,能使氨水的电离平衡逆向移动且c(NH )增大的是
)增大的是____ (填序号),此时c(OH-)____ (填“增大”“减小”或“不变”,下同), =
=____ 。
(3)等体积c(H+)相同的盐酸和醋酸分别与0.1mol•L-1的NaOH溶液恰好完全反应,消耗NaOH体积较大的是____ (填化学式),反应过程中醋酸的电离程度____ (填“增大”“减小”或“不变”,下同),n(CH3COO-)____ ,水的电离程度逐渐____ ,水电离的c(H+)=____ 。
(4)已知次氯酸(HClO)的电离平衡常数为Ka=4.0×10-8,向20mL0.1mol•L-1的HClO溶液中滴加少量硫酸,再加水稀释至40mL,此时测得c(H+)=0.05mol•L-1,则溶液中c(ClO-)=____ mol•L-1。
(5)已知亚硫酸(H2SO3)的电离平衡常数为Ka1=1.6×10-2,Ka2=1.0×10-7;碳酸(H2CO3)的电离平衡常数为Ka1=4.0×10-7,Ka2=4.0×10-11。足量的H2SO3溶液和NaHCO3溶液发生反应的主要离子方程式为____ 。
(1)属于弱电解质的是
(2)在氨水中存在电离平衡:NH3•H2O
 NH
NH +OH-。将上述六种物质分别配成0.1mol/L的溶液,向稀氨水中分别滴加少量六种溶液,能使氨水的电离平衡逆向移动且c(NH
+OH-。将上述六种物质分别配成0.1mol/L的溶液,向稀氨水中分别滴加少量六种溶液,能使氨水的电离平衡逆向移动且c(NH )增大的是
)增大的是 =
=(3)等体积c(H+)相同的盐酸和醋酸分别与0.1mol•L-1的NaOH溶液恰好完全反应,消耗NaOH体积较大的是
(4)已知次氯酸(HClO)的电离平衡常数为Ka=4.0×10-8,向20mL0.1mol•L-1的HClO溶液中滴加少量硫酸,再加水稀释至40mL,此时测得c(H+)=0.05mol•L-1,则溶液中c(ClO-)=
(5)已知亚硫酸(H2SO3)的电离平衡常数为Ka1=1.6×10-2,Ka2=1.0×10-7;碳酸(H2CO3)的电离平衡常数为Ka1=4.0×10-7,Ka2=4.0×10-11。足量的H2SO3溶液和NaHCO3溶液发生反应的主要离子方程式为
您最近一年使用:0次
2022-11-02更新
|
563次组卷
|
3卷引用:河北省邯郸市九校联盟2022-2023学年高二上学期10月期中考试化学试题
名校
7 . 赖氨酸[ ,用HR表示]是人体必需氨基酸。常温下,赖氨酸与足量盐酸反应可得盐酸盐(H3RCl2),H3RCl2呈酸性,在水溶液中存在电离平衡:
,用HR表示]是人体必需氨基酸。常温下,赖氨酸与足量盐酸反应可得盐酸盐(H3RCl2),H3RCl2呈酸性,在水溶液中存在电离平衡: 。下列叙述正确的是
。下列叙述正确的是
 ,用HR表示]是人体必需氨基酸。常温下,赖氨酸与足量盐酸反应可得盐酸盐(H3RCl2),H3RCl2呈酸性,在水溶液中存在电离平衡:
,用HR表示]是人体必需氨基酸。常温下,赖氨酸与足量盐酸反应可得盐酸盐(H3RCl2),H3RCl2呈酸性,在水溶液中存在电离平衡: 。下列叙述正确的是
。下列叙述正确的是A.0.01 H3RCl2的水溶液稀释10倍后,pH=3 H3RCl2的水溶液稀释10倍后,pH=3 |
B. H3RCl2的水溶液中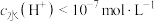 |
C. H3RCl2水溶液中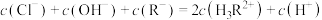 |
D.NaR水溶液中R-的水解平衡常数 与 与 的关系为 的关系为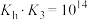 |
您最近一年使用:0次
2022-10-24更新
|
342次组卷
|
11卷引用:河北省秦皇岛市部分学校2022-2023学年高三上学期开学考试化学试题
河北省秦皇岛市部分学校2022-2023学年高三上学期开学考试化学试题河南省百所名校2023届高三上学期开学摸底联考化学试题广东省2023届高三8月开学摸底大联考化学试题重庆八中2022-2023学年高三上学期入学考试化学试题内蒙古自治区阿拉善盟第一中学2023届高三上学期8月月考化学试题辽宁省2022-2023学年高三上学期开学摸底联考化学试题陕西省咸阳高新一中2023届高三上学期第一次质量检测化学试题浙江省绍兴区上虞区2022-2023学年高三下学期第二次适应性考试(二模)化学试题浙江省绍兴区上虞区2022-2023学年高三下学期第二次适应性考试(二模)化学试题江苏省建湖高级中学2023-2024学年高三上学期暑期学情检测(一)化学试题云南省大理市下关第一中学2023-2024学年高二上学期12月月考化学试题
名校
8 . 次磷酸(H3PO2)是一元中强酸,次磷酸钠(NaH2PO2)广泛应用于化学镀镍,次磷酸钠的生产与镀镍过程如图所示。下列有关说法正确的是


A.Ni2+价电子的轨道表示式为 |
| B.“碱溶”时氧化剂与还原剂的物质的量之比为3:1 |
C.PH3、PO 中P的杂化方式相同,键角PO 中P的杂化方式相同,键角PO >PH3 >PH3 |
D.次磷酸铵与足量氢氧化钠共热,发生反应NH +H2PO +H2PO +3OH- +3OH- NH3↑+3H2O+PO NH3↑+3H2O+PO |
您最近一年使用:0次
2022-10-08更新
|
1439次组卷
|
8卷引用:河北省任丘市第一中学2022-2023学年高三上学期期中考试化学试题
名校
解题方法
9 . 常温下,用0.1mol·L-1氨水滴定10mL浓度均为0.1mol·L-1的HCl和CH3COOH的混合液,已知醋酸的电离常数为Ka=1.8×10-5,下列说法错误的是
| A.在氨水滴定前,混合溶液c(Cl-)>c(CH3COOH) |
| B.在氨水滴定前,混合溶液c(CH3COO-)≈Ka |
C.当滴入氨水10mL时,c( )+c(NH3·H2O)=c(CH3COOH)+c(CH3COO-) )+c(NH3·H2O)=c(CH3COOH)+c(CH3COO-) |
D.当溶液呈中性时,氨水滴入量等于20mL,且c( )<c(Cl-) )<c(Cl-) |
您最近一年使用:0次
2022-08-24更新
|
717次组卷
|
12卷引用:河北省邢台市临城县等4地邢台市第二中学等2校2022-2023学年高三上学期12月月考化学试题
河北省邢台市临城县等4地邢台市第二中学等2校2022-2023学年高三上学期12月月考化学试题广东省梅州市丰顺县和五华县2022届高三1月质检(一模)化学试题湖南省岳阳市湘阴县第一中学2021-2022学年高三下学期期中考试化学试题福建省漳平第一中学、永安一中 2022届高考前高三毕业班联考化学试题(已下线)2022年浙江省6月高考真题变式题21-25广东省韶关市2021-2022学年高二下学期期末考试化学试题湖北省襄阳市第五中学2022届高三适应性考试(一)化学试题(已下线)易错点24 水的电离平衡-备战2023年高考化学考试易错题(已下线)选择题16-20广东省广州市华南师范大学附属中学2021届高三下学期三模化学试题(已下线)第25讲 盐类水解(精练)-2022年高考化学一轮复习讲练测广东省广州市华南师范大学附属中学2022届高三上学期综合测试(一)化学试题
名校
10 . “84”消毒液,它是一种以次氯酸钠(NaClO)为有效成分的高效消毒剂。已知:Ka(HClO)=4.7×10-8Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11。回答下列问题:
(1)“84”消毒液溶液呈_______ 性,其原因是_______ 。
(2)浓度均为0.1mo/LNaClO、Na2CO3、NaHCO3的pH由大到小的是_______ 。
(3)测定“84"消毒液中NaCIO的物质的量浓度。
量取10.00mL“84"消毒液于锥形瓶中,加入过量的KI溶液,用足量的乙酸酸化,加入几滴指示剂,用0.5000mol/LNa2S2O3溶液滴定,滴定终点时耗Na2S2O3溶液25.00mL(三次平均值)。
①滴定时所用指示剂是_______ ,终点时的现象_______ 。
②该“84”清毒液中NaClO的物质的量浓度_______ mol/L。
(1)“84”消毒液溶液呈
(2)浓度均为0.1mo/LNaClO、Na2CO3、NaHCO3的pH由大到小的是
(3)测定“84"消毒液中NaCIO的物质的量浓度。
量取10.00mL“84"消毒液于锥形瓶中,加入过量的KI溶液,用足量的乙酸酸化,加入几滴指示剂,用0.5000mol/LNa2S2O3溶液滴定,滴定终点时耗Na2S2O3溶液25.00mL(三次平均值)。
①滴定时所用指示剂是
②该“84”清毒液中NaClO的物质的量浓度
您最近一年使用:0次



