名校
1 . 在HNO2溶液中存在如下平衡:HNO2  H++NO
H++NO ,向该溶液中加入少量的下列物质后,能使电离平衡向右移动的是
,向该溶液中加入少量的下列物质后,能使电离平衡向右移动的是
 H++NO
H++NO ,向该溶液中加入少量的下列物质后,能使电离平衡向右移动的是
,向该溶液中加入少量的下列物质后,能使电离平衡向右移动的是| A.水 | B.硫酸 | C.NaNO2固体 | D.NaHSO4固体 |
您最近一年使用:0次
2020-12-05更新
|
217次组卷
|
2卷引用:河南省郑州市第一〇六高级中学2020-2021学年高二上学期11月考试化学试题
2 . 一定温度下,在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
 CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )| A.加入少量NaOH固体,平衡向正方向移动,电离平衡常数增大 |
| B.滴加少量0.1mol/LHCl溶液,平衡逆方向移动,溶液中c(H+)增大 |
| C.加水,电离平衡右移,电离程度增大,所有离子浓度增大 |
| D.加入少量NaCl溶液,平衡不移动 |
您最近一年使用:0次
3 . (1)氨水中存在:NH3·H2O
 +OH-,在5份0.01 mol∙L−1的氨水中分别加入下列各物质:A、浓氨水,B、纯水,C、少量NaOH固体, D、NH4Cl固体。
+OH-,在5份0.01 mol∙L−1的氨水中分别加入下列各物质:A、浓氨水,B、纯水,C、少量NaOH固体, D、NH4Cl固体。
按照要求填空(答案选填物质对应的字母):
①电离平衡会向正向移动是_________ ,电离平衡会向逆向移动是__________ 。
②c( )、c(OH-)都增大的是
)、c(OH-)都增大的是___________ ,c( )、c(OH-)都变小的是
)、c(OH-)都变小的是___________ 。
③c( )增大,c(OH-)减小的是
)增大,c(OH-)减小的是___________ 。
④c( )减小,c(OH-)增大的是
)减小,c(OH-)增大的是___________ 。
(2)将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为_________ ,若此温度下醋酸的电离常数K=1×10−5,pH为______ ,若升高温度, K将___________ (填“变大”、“变小”或“不变”)。
(3)Ⅰ、现有浓度均为0.1 mol∙L−1的盐酸、硫酸、醋酸三种溶液,回答下列问题:
①若三种溶液中c(H+)分别为a mol∙L−1、b mol∙L−1、c mol∙L−1,则它们的大小关系为__________ 。
②等体积的以上三种酸分别与过量的NaOH溶液反应,若生成的盐的物质的量依次为A mol、B mol、C mol,则它们的大小关系为__________ 。
Ⅱ、现有pH=3的盐酸、硫酸、醋酸三种溶液,回答下列问题:
①分别用以上三种酸中和一定量的NaOH溶液生成正盐,若需要酸的体积分别为V1、V2、V3,其大小关系为________________ 。
②分别与Zn反应,开始时生成H2的速率为v1、v2、v3,其大小关系为____________ 。

 +OH-,在5份0.01 mol∙L−1的氨水中分别加入下列各物质:A、浓氨水,B、纯水,C、少量NaOH固体, D、NH4Cl固体。
+OH-,在5份0.01 mol∙L−1的氨水中分别加入下列各物质:A、浓氨水,B、纯水,C、少量NaOH固体, D、NH4Cl固体。按照要求填空(答案选填物质对应的字母):
①电离平衡会向正向移动是
②c(
 )、c(OH-)都增大的是
)、c(OH-)都增大的是 )、c(OH-)都变小的是
)、c(OH-)都变小的是③c(
 )增大,c(OH-)减小的是
)增大,c(OH-)减小的是④c(
 )减小,c(OH-)增大的是
)减小,c(OH-)增大的是(2)将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为
(3)Ⅰ、现有浓度均为0.1 mol∙L−1的盐酸、硫酸、醋酸三种溶液,回答下列问题:
①若三种溶液中c(H+)分别为a mol∙L−1、b mol∙L−1、c mol∙L−1,则它们的大小关系为
②等体积的以上三种酸分别与过量的NaOH溶液反应,若生成的盐的物质的量依次为A mol、B mol、C mol,则它们的大小关系为
Ⅱ、现有pH=3的盐酸、硫酸、醋酸三种溶液,回答下列问题:
①分别用以上三种酸中和一定量的NaOH溶液生成正盐,若需要酸的体积分别为V1、V2、V3,其大小关系为
②分别与Zn反应,开始时生成H2的速率为v1、v2、v3,其大小关系为
您最近一年使用:0次
名校
4 . 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如右图所示。请回答:
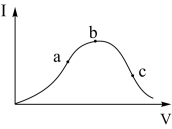
(1)a、b、c三点溶液中c(H+)由大到小的顺序为_____________ ;
(2)a、b、c三点中醋酸电离度最大的是_____________ ;
(3)若使C点溶液的c(CH3COO-)提高,在如下措施中可采取_____ (填标号)
A.通HCl气体
B.加Zn粒
C.加入固体KOH
D.加水
E.加固体CH3COONa

(1)a、b、c三点溶液中c(H+)由大到小的顺序为
(2)a、b、c三点中醋酸电离度最大的是
(3)若使C点溶液的c(CH3COO-)提高,在如下措施中可采取
A.通HCl气体
B.加Zn粒
C.加入固体KOH
D.加水
E.加固体CH3COONa
您最近一年使用:0次
14-15高二上·黑龙江哈尔滨·阶段练习
名校
5 . 在醋酸的电离平衡CH3COOH CH3COO-+H+中,要使电离平衡右移且c(H+)增大,应采取的措施是
CH3COO-+H+中,要使电离平衡右移且c(H+)增大,应采取的措施是
 CH3COO-+H+中,要使电离平衡右移且c(H+)增大,应采取的措施是
CH3COO-+H+中,要使电离平衡右移且c(H+)增大,应采取的措施是| A.加入NaOH(s) |
| B.通入HCl气体 |
| C.加蒸馏水 |
| D.升高温度 |
您最近一年使用:0次
2020-12-01更新
|
313次组卷
|
11卷引用:2014-2015学年黑龙江省哈尔滨市第六中学高二10月月考化学试卷
(已下线)2014-2015学年黑龙江省哈尔滨市第六中学高二10月月考化学试卷2014-2015内蒙古满洲里市七中高二上学期第二次月考化学试卷甘肃省兰州新舟中学2017-2018学年高二上学期第二次月考化学试题上海2018年高一下-同步练习卷-7.1 《电解质的电离》陕西省吴起高级中学2019-2020学年高二上学期期中考试化学(基础卷)试题新疆乌鲁木齐市第四中学2019-2020学年高二上学期期中考试化学试题黑龙省哈尔滨市宾县第二中学2020-2021学年高二上学期第二次月考化学试题河北省唐山市开滦二中2020-2021学年高二上学期期中考试化学试题河北省石家庄市康福外国语学校2020-2021学年高二10月月考化学试题安徽省安庆市潜山第二中学2020-2021学年高二上学期第二次月考化学试题(已下线)3.1.2 弱电解质的电离平衡(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)
6 . 在0.1mol/L的醋酸溶液中存在如下电离平衡:CH3COOH⇌CH3COO-+H+,对于该平衡,下列说法正确的是( )
| A.加入冰醋酸可以促进原平衡向正反应方向移动,使得溶液中氢离子浓度增大 |
| B.加入浓盐酸可以使原平衡向逆反应方向移动,溶液中氢离子浓度减小 |
| C.加入少量的醋酸钠固体,平衡向正反应方向移动 |
| D.加入水稀释可以促使原平衡向正反应方向移动,使得溶液中氢离子浓度增大 |
您最近一年使用:0次
7 . 25℃时,下列有关电解质溶液的说法正确的是( )
A.加水稀释0.1mol/L氨水,溶液中c(H+)·c(OH-)和 均不变 均不变 |
| B.配制Fe(NO3)2溶液时,为了防止Fe2+水解可向溶液中加入适量的稀硝酸 |
C.向盐酸中滴加氨水至溶液呈中性,所得溶液中c(NH )=c(Cl-) )=c(Cl-) |
| D.向CH3COOH溶液中加入少量CH3COONa固体,溶液的pH降低 |
您最近一年使用:0次
2020-11-09更新
|
723次组卷
|
2卷引用:北京市丰台区 2020-2021 学年高三上学期期中考试化学试题
8 . 在含有酚酞的 氨水中加入少量
氨水中加入少量 晶体,则溶液颜色
晶体,则溶液颜色
 氨水中加入少量
氨水中加入少量 晶体,则溶液颜色
晶体,则溶液颜色| A.变为无色 | B.变深 | C.变浅 | D.不变 |
您最近一年使用:0次
名校
9 . 一水合氨(NH3·H2O)是一种常见的弱碱,回答下列问题:
在0.1mol·L﹣1氨水中加入下列物质,一水合氨的电离平衡及平衡时物质的浓度的变化:
(1)写出NH3·H2O的电离方程式____ 。
(2)向氨水中加入NH4Cl固体,电离平衡向___ 移动(填“正向”、“逆向”或“不移动”,下同);pH ___ (填“增大”、“减小”或“不变”,下同)
(3)向氨水中加入FeCl3固体,电离平衡向_____ 移动;c(NH3·H2O)______
(4)已知常温下,NH3·H2O的电离常数为Kb=1.8×10-5,若氨水的浓度为2.0mol∙L-1,则溶液中OH-的浓度是___ mol∙L-1。
在0.1mol·L﹣1氨水中加入下列物质,一水合氨的电离平衡及平衡时物质的浓度的变化:
(1)写出NH3·H2O的电离方程式
(2)向氨水中加入NH4Cl固体,电离平衡向
(3)向氨水中加入FeCl3固体,电离平衡向
(4)已知常温下,NH3·H2O的电离常数为Kb=1.8×10-5,若氨水的浓度为2.0mol∙L-1,则溶液中OH-的浓度是
您最近一年使用:0次
10 . 常压下,取不同浓度、不同温度的氨水进行各项内容的测定,得到下表实验数据。
(1)温度升高, 的电离平衡向
的电离平衡向________ (填“左”或“右”)移动,能支持该结论的表中数据是________ (填序号)。
a.电离常数 b.电离度 c. d.
d.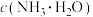
(2)表中 基本不变的原因是
基本不变的原因是________________ 。
(3)常温下,在氨水中加入一定量的氯化铵晶体,下列说法错误的是________ (填序号)。
A.溶液的 增大 B.氨水的电离度减小 C.
增大 B.氨水的电离度减小 C. 减小 D.
减小 D. 减小
减小
温度 | 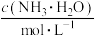 | 电离常数 | 电离度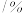 |  |
| 0 | 16.56 | 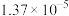 | 9.098 | 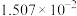 |
| 10 | 15.16 | 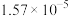 | 10.18 | 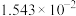 |
| 20 | 13.63 | 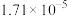 | 11.2 | 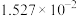 |
(1)温度升高,
 的电离平衡向
的电离平衡向a.电离常数 b.电离度 c.
 d.
d.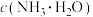
(2)表中
 基本不变的原因是
基本不变的原因是(3)常温下,在氨水中加入一定量的氯化铵晶体,下列说法错误的是
A.溶液的
 增大 B.氨水的电离度减小 C.
增大 B.氨水的电离度减小 C. 减小 D.
减小 D. 减小
减小
您最近一年使用:0次
2020-09-14更新
|
395次组卷
|
4卷引用:鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第2节 弱电解质的电离 盐类的水解 课时1 弱电解质的电离平衡
鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第2节 弱电解质的电离 盐类的水解 课时1 弱电解质的电离平衡人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第一节 电离平衡 作业帮(已下线)3.1 电离平衡-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)福建师范大学附属中学2021-2022学年高二上学期期中考试化学试题



