1 . 实验是探究物质性质的重要方法,下列操作中,实验现象与得出的结论相一致的是
| 选项 | 实验目的 | 操作及现象 | 结论 |
| A | 比较HClO和CH3COOH的酸性强弱 | 用pH计测定NaClO和CH3COONa的pH值,测得pH(NaClO)>pH(CH3COONa) | 酸性:HClO>CH3COOH |
| B | 验证反应2Fe3++2I- 2Fe2++I2是可逆反应 2Fe2++I2是可逆反应 | 向2mL 0.1mol/L FeCl3溶液加入几滴0.1mol/L KI溶液,充分反应。取反应后试样,滴加淀粉溶液,溶液变为蓝色;另取反应后试样,加入KSCN溶液,溶液变成血红色 | 反应2Fe3++2I- 2Fe2++I2是可逆反应 2Fe2++I2是可逆反应 |
| C | 判断 (AgCl)与 (AgCl)与 (AgI)的大小 (AgI)的大小 | 向等浓度的NaCl、NaI的混合溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl)>Ksp(AgI) |
| D | 判断某 溶液样品中是否含有 溶液样品中是否含有 | 向某 溶液样品中加入硫酸酸化的 溶液样品中加入硫酸酸化的 溶液,紫色褪去 溶液,紫色褪去 | 该样品中一定含有 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 草酸钠( )常用作还原剂。已知常温下,草酸的电离常数
)常用作还原剂。已知常温下,草酸的电离常数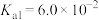 ,
,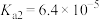 ,碳酸的电离常数
,碳酸的电离常数 ,
, 。回答下列问题:
。回答下列问题:
(1) 发生第一步水解的离子方程式为
发生第一步水解的离子方程式为___________ 。
(2)相同条件下,同浓度的① ,②
,② ,③
,③ ,④
,④ 四种溶液的pH由大到小的顺序为
四种溶液的pH由大到小的顺序为___________ (用编号表示)。
(3)将等浓度、等体积的 溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是
溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是___________ 。
a.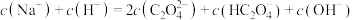
b.
c.
d.
(4) 溶液常用作氧化还原滴定的标准液。实验室欲配制250 mL 0.10 mol·L-1的
溶液常用作氧化还原滴定的标准液。实验室欲配制250 mL 0.10 mol·L-1的 溶液。
溶液。
①需托盘天平称取 固体
固体___________ g。
②配制溶液时,需要的玻璃仪器除烧杯、玻璃棒、量筒外还应有___________ 。
(5)用 标准液测定某高锰酸钾样品的纯度:
标准液测定某高锰酸钾样品的纯度:
步骤I:称取2.0g高锰酸钾样品,配成100mL溶液,取20mL溶液于锥形瓶中,并加入少量硫酸酸化。
步骤II:用(4)中配制的 标准液进行滴定,平行滴定三次,记录消耗
标准液进行滴定,平行滴定三次,记录消耗 溶液的体积如下表:
溶液的体积如下表:
①滴定终点判断的依据是___________ 。
②样品中 的质量分数为
的质量分数为___________ 。
③若(4)中称取的 固体已部分吸水潮解,会使测得的样品中
固体已部分吸水潮解,会使测得的样品中 的质量分数
的质量分数___________ (填“偏高”、“偏低”或“不变”)。
 )常用作还原剂。已知常温下,草酸的电离常数
)常用作还原剂。已知常温下,草酸的电离常数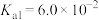 ,
,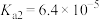 ,碳酸的电离常数
,碳酸的电离常数 ,
, 。回答下列问题:
。回答下列问题:(1)
 发生第一步水解的离子方程式为
发生第一步水解的离子方程式为(2)相同条件下,同浓度的①
 ,②
,② ,③
,③ ,④
,④ 四种溶液的pH由大到小的顺序为
四种溶液的pH由大到小的顺序为(3)将等浓度、等体积的
 溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是
溶液与盐酸混合,溶液显酸性。混合后所得溶液中下列关系成立的是a.
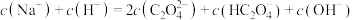
b.

c.

d.

(4)
 溶液常用作氧化还原滴定的标准液。实验室欲配制250 mL 0.10 mol·L-1的
溶液常用作氧化还原滴定的标准液。实验室欲配制250 mL 0.10 mol·L-1的 溶液。
溶液。①需托盘天平称取
 固体
固体②配制溶液时,需要的玻璃仪器除烧杯、玻璃棒、量筒外还应有
(5)用
 标准液测定某高锰酸钾样品的纯度:
标准液测定某高锰酸钾样品的纯度:步骤I:称取2.0g高锰酸钾样品,配成100mL溶液,取20mL溶液于锥形瓶中,并加入少量硫酸酸化。
步骤II:用(4)中配制的
 标准液进行滴定,平行滴定三次,记录消耗
标准液进行滴定,平行滴定三次,记录消耗 溶液的体积如下表:
溶液的体积如下表:| 第1次 | 第2次 | 第3次 | |
消耗 溶液的体积/mL 溶液的体积/mL | 49.80 | 46.75 | 50.20 |
②样品中
 的质量分数为
的质量分数为③若(4)中称取的
 固体已部分吸水潮解,会使测得的样品中
固体已部分吸水潮解,会使测得的样品中 的质量分数
的质量分数
您最近一年使用:0次
名校
解题方法
3 . 25℃时,用0.1mol/LNaOH溶液滴定10mL0.1mol。L-1HR溶液,测得溶液中分布系数、 随V(NaOH)的变化关系如图所示。[比如R-的分布系数:
随V(NaOH)的变化关系如图所示。[比如R-的分布系数: ]。下列说法正确的是
]。下列说法正确的是

 随V(NaOH)的变化关系如图所示。[比如R-的分布系数:
随V(NaOH)的变化关系如图所示。[比如R-的分布系数: ]。下列说法正确的是
]。下列说法正确的是
| A.曲线L2表示δ(R-) |
| B.某c(R-):c(HR)=9:1的缓冲溶液pH≈6 |
| C.Kh(R-)的数量级为11-10 |
D.a点溶液中: |
您最近一年使用:0次
名校
4 . 海水中含有80多种元素,是重要的物质资源宝库,同时海水具有强大的自然调节能力,为解决环境污染问题提供了广阔的空间。
(1)25℃,不同pH条件下,水溶液中碳元素的存在形态如图所示。
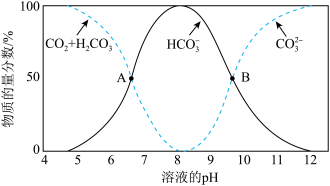
①下列说法正确的是_________ (填字母)。
a.A点,溶液中H2CO3和HCO 浓度相同
浓度相同
b.pH=8时,溶液中含碳元素的微粒主要是HCO
c.当c(HCO )=c(CO
)=c(CO )时,c(H+)>c(OH﹣)
)时,c(H+)>c(OH﹣)
②上述中性水溶液中,阴离子浓度由大到小的关系是___________ ;pH=6时,由水电离出的c(H+)=___________ 。
(2)海水pH稳定在7.9~8.4之间,可用于烟道气中CO2和SO2的吸收剂。
①海水呈弱碱性是因为主要含有___________ 、___________ 、OH﹣(填微粒符号)。
②已知:25℃时,H2CO3电离平衡常数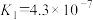 、
、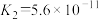 ;H2SO3电离平衡常数
;H2SO3电离平衡常数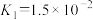 、
、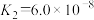 。海水中含有的HCO
。海水中含有的HCO 可用于吸收SO2,该过程的离子方程式是
可用于吸收SO2,该过程的离子方程式是___________ ,吸收后溶液呈弱酸性的原因是___________ 。
(3)洗涤烟气后的海水呈酸性,需处理后再排放。通入O2可将酸性海水中的硫(Ⅳ)(主要以HSO 形式存在)氧化,该反应的离子方程式是
形式存在)氧化,该反应的离子方程式是___________ 。
(1)25℃,不同pH条件下,水溶液中碳元素的存在形态如图所示。

①下列说法正确的是
a.A点,溶液中H2CO3和HCO
 浓度相同
浓度相同b.pH=8时,溶液中含碳元素的微粒主要是HCO

c.当c(HCO
 )=c(CO
)=c(CO )时,c(H+)>c(OH﹣)
)时,c(H+)>c(OH﹣)②上述中性水溶液中,阴离子浓度由大到小的关系是
(2)海水pH稳定在7.9~8.4之间,可用于烟道气中CO2和SO2的吸收剂。
①海水呈弱碱性是因为主要含有
②已知:25℃时,H2CO3电离平衡常数
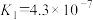 、
、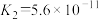 ;H2SO3电离平衡常数
;H2SO3电离平衡常数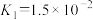 、
、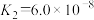 。海水中含有的HCO
。海水中含有的HCO 可用于吸收SO2,该过程的离子方程式是
可用于吸收SO2,该过程的离子方程式是(3)洗涤烟气后的海水呈酸性,需处理后再排放。通入O2可将酸性海水中的硫(Ⅳ)(主要以HSO
 形式存在)氧化,该反应的离子方程式是
形式存在)氧化,该反应的离子方程式是
您最近一年使用:0次
名校
解题方法
5 . 常温下将NaOH溶液滴加到磷酸(H3PO4)溶液中,混合溶液中的pH与部分离子浓度变化的关系如图所示。下列说法正确的是


A.若直线丙表示pH与 的变化关系,应该在甲、乙之间 的变化关系,应该在甲、乙之间 |
B.Ka2(H3PO4)=10-7.21,且NaH2PO4溶液中c(HPO )>c(H3PO4) )>c(H3PO4) |
C.c(HPO )=c(H3PO4)时,pH=4.48 )=c(H3PO4)时,pH=4.48 |
D.Na2HPO4溶液中: |
您最近一年使用:0次
名校
解题方法
6 . 从宏观现象探究微观本质是重要的化学学科素养。为研究FeCl3溶液的性质,某小组同学进行了如下探究实验。
Ⅰ.配制FeCl3溶液
(1)先将FeCl3固体溶于浓盐酸,再稀释至指定浓度。浓盐酸的作用是______ 。
Ⅱ.FeCl3溶液与Na2CO3溶液反应
(2)向2mL1mol/L的Na2CO3溶液中加入2mL1mol/LFeCl3溶液,产生了红褐色沉淀和无色气体。反应的离子方程式为______ 。
Ⅲ.FeCl3溶液与Na2S溶液反应
(3)甲同学认为Fe3+和S2-的水解平衡相互促进并完全水解,实验中会观察到红褐色沉淀并闻到臭鸡蛋气味;乙同学认为会发生氧化还原反应,并预测还原产物为______ (填化学式)。两位同学实验如下:
(4)两位同学猜测实验a中的黑色沉淀可能是Fe2S3。继续实验:
根据实验b说明黑色沉淀是Fe2S3,写出实验b中Fe2S3与盐酸反应的化学方程式:______ 。
(5)①实验a中生成黑色沉淀Fe2S3的离子方程式为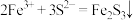 。该反应类型从四种基本反应类型看属于
。该反应类型从四种基本反应类型看属于______ 。
②实验a中Fe2S3溶解时生成的黄色固体为______ ,乙同学推测是因为随着FeCl3溶液滴加至一定量, 浓度增大,其氧化性增强,将Fe2S3氧化所致。
浓度增大,其氧化性增强,将Fe2S3氧化所致。
(6)已知: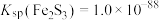 ,
,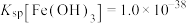 。针对实验a过程中未观察到红褐色沉淀,甲同学认为可能是产生的量比较少,被黑色所遮盖。乙同学根据
。针对实验a过程中未观察到红褐色沉淀,甲同学认为可能是产生的量比较少,被黑色所遮盖。乙同学根据 数据计算认为就算产生红褐色沉淀,也会转化为黑色沉淀,写出该转化过程的离子方程式:
数据计算认为就算产生红褐色沉淀,也会转化为黑色沉淀,写出该转化过程的离子方程式:______ 。
Ⅰ.配制FeCl3溶液
(1)先将FeCl3固体溶于浓盐酸,再稀释至指定浓度。浓盐酸的作用是
Ⅱ.FeCl3溶液与Na2CO3溶液反应
(2)向2mL1mol/L的Na2CO3溶液中加入2mL1mol/LFeCl3溶液,产生了红褐色沉淀和无色气体。反应的离子方程式为
Ⅲ.FeCl3溶液与Na2S溶液反应
(3)甲同学认为Fe3+和S2-的水解平衡相互促进并完全水解,实验中会观察到红褐色沉淀并闻到臭鸡蛋气味;乙同学认为会发生氧化还原反应,并预测还原产物为
| 实验a | 向稀Na2S溶液中逐滴加入FeCl3稀溶液,直至过量 |
| 实验现象 | 立即产生黑色沉淀并逐渐增加,无臭鸡蛋气味;FeCl3溶液过量后,黑色沉淀部分溶解,出现黄色沉淀 |
| 实验b | 将实验a中黑色沉淀过滤,并用CS2处理后洗净。向沉淀中加入6mol/L的盐酸,振荡试管 |
| 实验现象 | 加入盐酸后黑色沉淀溶解,转为乳黄色沉淀,并伴有臭鸡蛋气味 |
(5)①实验a中生成黑色沉淀Fe2S3的离子方程式为
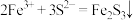 。该反应类型从四种基本反应类型看属于
。该反应类型从四种基本反应类型看属于②实验a中Fe2S3溶解时生成的黄色固体为
 浓度增大,其氧化性增强,将Fe2S3氧化所致。
浓度增大,其氧化性增强,将Fe2S3氧化所致。(6)已知:
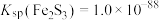 ,
,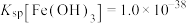 。针对实验a过程中未观察到红褐色沉淀,甲同学认为可能是产生的量比较少,被黑色所遮盖。乙同学根据
。针对实验a过程中未观察到红褐色沉淀,甲同学认为可能是产生的量比较少,被黑色所遮盖。乙同学根据 数据计算认为就算产生红褐色沉淀,也会转化为黑色沉淀,写出该转化过程的离子方程式:
数据计算认为就算产生红褐色沉淀,也会转化为黑色沉淀,写出该转化过程的离子方程式:
您最近一年使用:0次
名校
7 . 含硫化合物在生产、科研中应用广泛。请回答下列问题:
(1)多种多样的盐:
① 在染料工业中用于生产硫化染料,其水溶液显碱性的原因:
在染料工业中用于生产硫化染料,其水溶液显碱性的原因:_____________ (用离子反应方程式表示),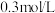 的
的 溶液与
溶液与 的
的 溶液中
溶液中
_____________  (填“>”、“<”或“=”);
(填“>”、“<”或“=”);
② 可应用做医药、照相还原剂、染料中间体等,写出
可应用做医药、照相还原剂、染料中间体等,写出 溶液的质子守恒表达式:
溶液的质子守恒表达式:_____________ [用含离子浓度的关系式表示,用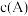 表示粒子A的浓度];③
表示粒子A的浓度];③ 可用作矿物分解助熔剂。已知:
可用作矿物分解助熔剂。已知: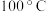 时,
时, 的
的 溶液中水电离的
溶液中水电离的 ,该温度下将
,该温度下将 的
的 溶液
溶液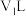 与
与 的
的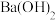 溶液
溶液 混合,所得溶液
混合,所得溶液 ,则
,则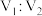 为
为_____________ (忽略溶液混合时的体积变化)。
(2) 可用于金属精制、农药、医药、催化剂再生。常温下,向
可用于金属精制、农药、医药、催化剂再生。常温下,向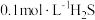 溶液中通入
溶液中通入 气体或加入
气体或加入 固体,测得
固体,测得 与溶液
与溶液 的关系如图所示(忽略体积的变化及)
的关系如图所示(忽略体积的变化及) 挥发)。
挥发)。

①当 时,溶液中
时,溶液中
_____________  ;
;
②当溶液 时,溶液中的
时,溶液中的
_____________  ;
;
③某溶液含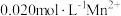 、
、 ,当溶液
,当溶液
_____________ 时, 开始沉淀[已知:
开始沉淀[已知: ]。
]。
(1)多种多样的盐:
①
 在染料工业中用于生产硫化染料,其水溶液显碱性的原因:
在染料工业中用于生产硫化染料,其水溶液显碱性的原因: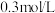 的
的 溶液与
溶液与 的
的 溶液中
溶液中
 (填“>”、“<”或“=”);
(填“>”、“<”或“=”);②
 可应用做医药、照相还原剂、染料中间体等,写出
可应用做医药、照相还原剂、染料中间体等,写出 溶液的质子守恒表达式:
溶液的质子守恒表达式: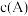 表示粒子A的浓度];③
表示粒子A的浓度];③ 可用作矿物分解助熔剂。已知:
可用作矿物分解助熔剂。已知: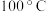 时,
时, 的
的 溶液中水电离的
溶液中水电离的 ,该温度下将
,该温度下将 的
的 溶液
溶液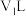 与
与 的
的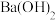 溶液
溶液 混合,所得溶液
混合,所得溶液 ,则
,则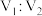 为
为(2)
 可用于金属精制、农药、医药、催化剂再生。常温下,向
可用于金属精制、农药、医药、催化剂再生。常温下,向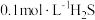 溶液中通入
溶液中通入 气体或加入
气体或加入 固体,测得
固体,测得 与溶液
与溶液 的关系如图所示(忽略体积的变化及)
的关系如图所示(忽略体积的变化及) 挥发)。
挥发)。
①当
 时,溶液中
时,溶液中
 ;
;②当溶液
 时,溶液中的
时,溶液中的
 ;
;③某溶液含
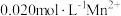 、
、 ,当溶液
,当溶液
 开始沉淀[已知:
开始沉淀[已知: ]。
]。
您最近一年使用:0次
名校
8 . 以酚酞为指示剂,用 的
的 溶液滴定
溶液滴定 未知浓度的二元酸
未知浓度的二元酸 溶液。溶液中,
溶液。溶液中, 、分布系数
、分布系数 随滴加
随滴加 溶液体积
溶液体积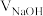 的变化关系如图所示。[比如
的变化关系如图所示。[比如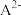 的分布系数:
的分布系数: ]下列叙述正确的是
]下列叙述正确的是

 的
的 溶液滴定
溶液滴定 未知浓度的二元酸
未知浓度的二元酸 溶液。溶液中,
溶液。溶液中, 、分布系数
、分布系数 随滴加
随滴加 溶液体积
溶液体积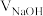 的变化关系如图所示。[比如
的变化关系如图所示。[比如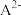 的分布系数:
的分布系数: ]下列叙述正确的是
]下列叙述正确的是
A.当 时, 时, |
B.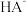 的电离常数约为 的电离常数约为 |
C. 溶液的浓度为 溶液的浓度为 |
D.滴定终点时,溶液中 |
您最近一年使用:0次
名校
9 . 下列实验目的对应的方案设计、现象和结论都正确的是
| 选项 | 实验目的 | 方案设计 | 现象和结论 |
| A | 比较 和 和 的 的 相对大小 相对大小 | 向等体积饱和 溶液和饱和 溶液和饱和 溶液中分别滴加等量的浓 溶液中分别滴加等量的浓 溶液 溶液 | 得到沉淀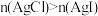 ,则 ,则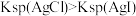 |
| B | 探究压强对平衡移动的影响 | 密闭容器中盛装 ,一段时间后反应达平衡,压缩体积至原来的一半 ,一段时间后反应达平衡,压缩体积至原来的一半 | 气体颜色加深,说明平衡向生成 的方向移动 的方向移动 |
| C | 比较 与 与 的酸性 的酸性 | 用 计测定 计测定 :① :① 溶液② 溶液② 溶液 溶液 |  :①>②,证明 :①>②,证明 的酸性弱于 的酸性弱于 |
| D | 比较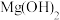 和 和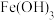 的 的 相对大小 相对大小 | 向 的 的 溶液中滴加2滴 溶液中滴加2滴 的 的 溶液,再滴加2滴 溶液,再滴加2滴 的 的 溶液 溶液 | 先生成白色沉淀,后生成红褐色沉淀,证明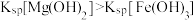 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
10 . 电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
已知部分弱酸的电离常数如下表:
(1)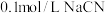 溶液和
溶液和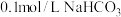 溶液中,
溶液中,
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2)常温下,pH相同的三种溶液a. ,b.
,b. ,c.
,c. ,其物质的量浓度由大到小的顺序是
,其物质的量浓度由大到小的顺序是___________ (填编号)。
(3)向 溶液中通入少量
溶液中通入少量 时反应的离子方程式:
时反应的离子方程式:___________ 。
(4)室温下,—定浓度的 溶液
溶液 ,溶液中
,溶液中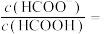
___________ 。
(5)若向 溶液中加入少量的
溶液中加入少量的 ,则溶液中
,则溶液中 将
将___________ (填“增大”、“减小”或“不变”)。
(6)工业废水中的亚硫酸盐过量排放和不恰当的处理方法会引发严重的环境问题,如水体富营养化、水生生物死亡等。工厂废水排放前,可以先用氧化性工业废水(以含酸性 溶液为例)进行处理。常温处理后,再调节pH使
溶液为例)进行处理。常温处理后,再调节pH使 浓度不高于
浓度不高于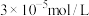 即可排放,调节pH应不低于
即可排放,调节pH应不低于___________ 。[已知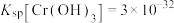 ]
]
(7)常温下, 醋酸溶液加水稀释过程中,下列表达式的数据减小的是___________(填字母序号)。
醋酸溶液加水稀释过程中,下列表达式的数据减小的是___________(填字母序号)。
(8)25℃时,在 与
与 的混合溶液中,若测得
的混合溶液中,若测得 ,则溶液中
,则溶液中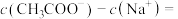
___________  (填精确值)。
(填精确值)。
已知部分弱酸的电离常数如下表:
| 弱酸 |  |  |  |  |  |
| 电离常数(25℃) | 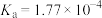 | 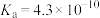 | 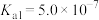  |  | 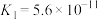 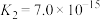 |
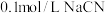 溶液和
溶液和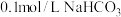 溶液中,
溶液中,
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(2)常温下,pH相同的三种溶液a.
 ,b.
,b. ,c.
,c. ,其物质的量浓度由大到小的顺序是
,其物质的量浓度由大到小的顺序是(3)向
 溶液中通入少量
溶液中通入少量 时反应的离子方程式:
时反应的离子方程式:(4)室温下,—定浓度的
 溶液
溶液 ,溶液中
,溶液中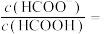
(5)若向
 溶液中加入少量的
溶液中加入少量的 ,则溶液中
,则溶液中 将
将(6)工业废水中的亚硫酸盐过量排放和不恰当的处理方法会引发严重的环境问题,如水体富营养化、水生生物死亡等。工厂废水排放前,可以先用氧化性工业废水(以含酸性
 溶液为例)进行处理。常温处理后,再调节pH使
溶液为例)进行处理。常温处理后,再调节pH使 浓度不高于
浓度不高于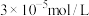 即可排放,调节pH应不低于
即可排放,调节pH应不低于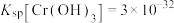 ]
](7)常温下,
 醋酸溶液加水稀释过程中,下列表达式的数据减小的是___________(填字母序号)。
醋酸溶液加水稀释过程中,下列表达式的数据减小的是___________(填字母序号)。A. | B. |
C. | D.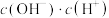 |
 与
与 的混合溶液中,若测得
的混合溶液中,若测得 ,则溶液中
,则溶液中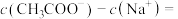
 (填精确值)。
(填精确值)。
您最近一年使用:0次



