1 . Ⅰ.
(1) 的水溶液呈
的水溶液呈_____ (填“酸”、“中”、“碱”)性,常温时的
_____ 7(填“>”“=”、“<”),实验室在配制 的溶液时,常将
的溶液时,常将 固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以
固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以_____ (填“促进”、“抑制”)其水解。
Ⅱ.常温下有浓度均为 的四种溶液:①
的四种溶液:① 、②
、② 、③HCl、④
、③HCl、④ 。
。
(2)有人称溶液①是油污的“清道夫”,原因是_____ (用离子方程式解释)。
(3)溶液②中,
_____  。
。
(4)将10mL溶液③加水稀释至100mL,则此时溶液中由水电离出的
_____ 。
(5)取④的溶液 ,向其中加入含
,向其中加入含 的溶液后呈中性,则
的溶液后呈中性,则 电离平衡常数
电离平衡常数
_____ 。
(1)
 的水溶液呈
的水溶液呈
 的溶液时,常将
的溶液时,常将 固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以
固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以Ⅱ.常温下有浓度均为
 的四种溶液:①
的四种溶液:① 、②
、② 、③HCl、④
、③HCl、④ 。
。(2)有人称溶液①是油污的“清道夫”,原因是
(3)溶液②中,

 。
。(4)将10mL溶液③加水稀释至100mL,则此时溶液中由水电离出的

(5)取④的溶液
 ,向其中加入含
,向其中加入含 的溶液后呈中性,则
的溶液后呈中性,则 电离平衡常数
电离平衡常数
您最近一年使用:0次
名校
解题方法
2 . 镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:
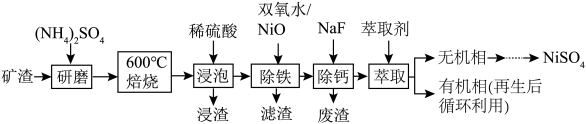
已知:①(NH4)2SO4在350℃以上会分解生成NH3和H2SO4,NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。②铁元素以针铁矿(FeOOH)形式沉淀,铁渣易过滤。
请回答下列问题:
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是______ ,写出焙烧过程中铁酸镍发生的化学反应方程式______ 。
(2)“浸渣”的主要成分为______ (填化学式)。
(3)溶液pH对铁去除率的影响实验结果如图所示:
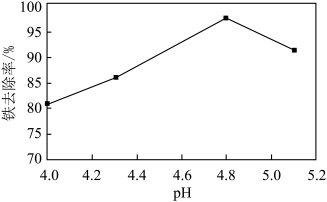
①从图中数据来看,沉铁的最佳pH为______ 。
②结合图中数据,解释pH偏小或偏大都不利于沉铁的原因是______ 、______ 。
③检验“除铁”后溶液中是否还有Fe3+的操作是______ 。
(4)若溶液中c(Ca2+)=1.0×10-3mol•L-1,当除钙率达到99%时,溶液中c(F—)=_____ mol•L-1。[已知Ksp(CaF2)= 4.0×10-11]

已知:①(NH4)2SO4在350℃以上会分解生成NH3和H2SO4,NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。②铁元素以针铁矿(FeOOH)形式沉淀,铁渣易过滤。
请回答下列问题:
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是
(2)“浸渣”的主要成分为
(3)溶液pH对铁去除率的影响实验结果如图所示:

①从图中数据来看,沉铁的最佳pH为
②结合图中数据,解释pH偏小或偏大都不利于沉铁的原因是
③检验“除铁”后溶液中是否还有Fe3+的操作是
(4)若溶液中c(Ca2+)=1.0×10-3mol•L-1,当除钙率达到99%时,溶液中c(F—)=
您最近一年使用:0次
3 . 下列试题中,溶液温度均为常温,请回答:
(1)0.1mol/L的醋酸钠溶液pH=10的原因是
(2)0.1mol/L的NaCN溶液中各离子浓度由大到小的顺序是
(3)浓度均为0.1mol·L-1的V1LHCl溶液和V2LNaOH溶液混合后,混合溶液的pH=12,则V1:V2=
(4)CH3COONa和CH3COOH的混合溶液中c(Na+)=c(CH3COO-),则该溶液呈
(5)在日常生活中经常用硫酸铝和碳酸氢钠混合溶液作灭火剂,请用离子方程式表示其灭火原理:
(6)物质的量浓度均为0.1mol·L-1的4种溶液:①NH3·H2O、②NH4HSO4、③CH3COONH4、④NH4Cl,按要求从大到小按序号排序,c(
 ):
):
您最近一年使用:0次
4 . 某研究小组设计了如下流程以废铁屑(含有少量碳和 杂质)为原料制备无水
杂质)为原料制备无水 。已知:氯化亚砜(
。已知:氯化亚砜( )熔点
)熔点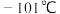 ,沸点
,沸点 ,易水解。
,易水解。
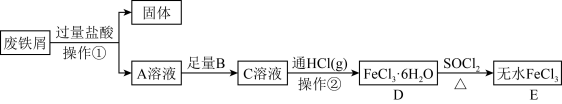
(1)为避免引入新的杂质,试剂 可以选用_________________(填编号)。
可以选用_________________(填编号)。
(2)操作②是蒸发结晶,加热的同时通入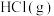 的目的是
的目的是_________________ 。
(3)取少量 晶体,溶于水并滴加
晶体,溶于水并滴加 溶液,现象是
溶液,现象是_________________ 。
(4)反应 的化学方程式为
的化学方程式为_________________ 。
(5)由 转化成
转化成 的过程中可能产生少量亚铁盐,写出一种可能的还原剂
的过程中可能产生少量亚铁盐,写出一种可能的还原剂_________________ ,并设计实验验证是该还原剂将 还原
还原_________________ 。
 杂质)为原料制备无水
杂质)为原料制备无水 。已知:氯化亚砜(
。已知:氯化亚砜( )熔点
)熔点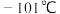 ,沸点
,沸点 ,易水解。
,易水解。
(1)为避免引入新的杂质,试剂
 可以选用_________________(填编号)。
可以选用_________________(填编号)。A. 溶液 溶液 | B.氯水 | C.溴水 | D. 溶液 溶液 |
(2)操作②是蒸发结晶,加热的同时通入
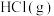 的目的是
的目的是(3)取少量
 晶体,溶于水并滴加
晶体,溶于水并滴加 溶液,现象是
溶液,现象是(4)反应
 的化学方程式为
的化学方程式为(5)由
 转化成
转化成 的过程中可能产生少量亚铁盐,写出一种可能的还原剂
的过程中可能产生少量亚铁盐,写出一种可能的还原剂 还原
还原
您最近一年使用:0次
5 . 常温下,0.1mol/L醋酸钠溶液的 。下列相关说法
。下列相关说法不正确 的是
 。下列相关说法
。下列相关说法A.醋酸钠溶液显碱性的原因是: |
B.常温下,醋酸钠溶液中: |
C.向10mL上述溶液中滴加5滴饱和 溶液, 溶液,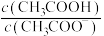 逐渐增大 逐渐增大 |
| D.在pH均为9的醋酸钠溶液和氨水中,水的电离程度:醋酸钠溶液>氨水 |
您最近一年使用:0次
6 . CO2的回收和资源化对于实现“碳中和”具有重要意义。
(1)CH4与CO2重整生成H2和CO的反应为CH4(g)+CO2(g)=2H2(g)+2CO(g) ΔH=+247.6kJ•mol-1
①已知H2(g)和CO(g)的燃烧热分别为285.8kJ•mol-1和283.0kJ•mol-1.则CH4的燃烧热为_______ 。
②CH4与CO2重整过程中还发生反应H2(g)+CO2(g)=H2O(g)+CO(g)ΔH=+41.2kJ•mol-1。在恒压、反应物起始物质的量比n(CH4):n(CO2)=1:1条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。
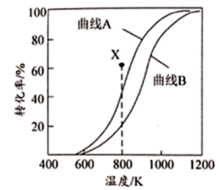
I.曲线_______ (填“A”或“B”)表示CH4的平衡转化率随温度的变化。
Ⅱ.800K、起始n(CH4):n(CO2)=1:1条件下,要让CH4平衡转化率达到X点的值,可以采取的措施是_______ (过程中不充入或分离出任何物质)。
(2)M中存在的粒子有Na+、A2-、HA-、H+、OH-、H2O和H2A。根据题意回答下列问题:
①H2A为_______ 酸(填“强”或“弱”),往H2A溶液中加水会使 的值
的值_______ (填“增大”、“减小”或“不变”)。
②往Na2A溶液中加入_______ 可抑制其水解(选填字母序号)。
a.浓盐酸 b.KOH固体 c.水 d.升高温度
③浓度均为0.1mol·L-1的Na2A、NaHA混合溶液中: =
=_______ 。
(1)CH4与CO2重整生成H2和CO的反应为CH4(g)+CO2(g)=2H2(g)+2CO(g) ΔH=+247.6kJ•mol-1
①已知H2(g)和CO(g)的燃烧热分别为285.8kJ•mol-1和283.0kJ•mol-1.则CH4的燃烧热为
②CH4与CO2重整过程中还发生反应H2(g)+CO2(g)=H2O(g)+CO(g)ΔH=+41.2kJ•mol-1。在恒压、反应物起始物质的量比n(CH4):n(CO2)=1:1条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。

I.曲线
Ⅱ.800K、起始n(CH4):n(CO2)=1:1条件下,要让CH4平衡转化率达到X点的值,可以采取的措施是
(2)M中存在的粒子有Na+、A2-、HA-、H+、OH-、H2O和H2A。根据题意回答下列问题:
①H2A为
 的值
的值②往Na2A溶液中加入
a.浓盐酸 b.KOH固体 c.水 d.升高温度
③浓度均为0.1mol·L-1的Na2A、NaHA混合溶液中:
 =
=
您最近一年使用:0次
解题方法
7 .  、
、 在分析试剂、医药、电子工业中用途广泛。回答下列问题:
在分析试剂、医药、电子工业中用途广泛。回答下列问题:
(1)常温时,0.1 的
的 溶液的pH=3。
溶液的pH=3。
①溶液中由水电离出的
___________  。
。
②
___________  (填精确计算式,无需计算出结果)。
(填精确计算式,无需计算出结果)。
(2)80℃时,0.1 的
的 溶液的pH小于3,分析导致pH随温度变化的原因,
溶液的pH小于3,分析导致pH随温度变化的原因,___________ 。
(3)常温时,向100mL 0.1
 溶液中滴加0.1
溶液中滴加0.1 的NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
的NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。

①图中a、b、c、d四点中水的电离程度最大的是___________ 。
②向 溶液中滴加NaOH溶液从a点到d点的过程中,发生反应的离子方程式:
溶液中滴加NaOH溶液从a点到d点的过程中,发生反应的离子方程式:___________ 。
③ 溶液中各离子浓度由大到小的排列顺序是
溶液中各离子浓度由大到小的排列顺序是___________ 。
④b点时溶液中各离子浓度由大到小的排列顺序是___________ 。
 、
、 在分析试剂、医药、电子工业中用途广泛。回答下列问题:
在分析试剂、医药、电子工业中用途广泛。回答下列问题:(1)常温时,0.1
 的
的 溶液的pH=3。
溶液的pH=3。①溶液中由水电离出的

 。
。②

 (填精确计算式,无需计算出结果)。
(填精确计算式,无需计算出结果)。(2)80℃时,0.1
 的
的 溶液的pH小于3,分析导致pH随温度变化的原因,
溶液的pH小于3,分析导致pH随温度变化的原因,(3)常温时,向100mL 0.1

 溶液中滴加0.1
溶液中滴加0.1 的NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
的NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
①图中a、b、c、d四点中水的电离程度最大的是
②向
 溶液中滴加NaOH溶液从a点到d点的过程中,发生反应的离子方程式:
溶液中滴加NaOH溶液从a点到d点的过程中,发生反应的离子方程式:③
 溶液中各离子浓度由大到小的排列顺序是
溶液中各离子浓度由大到小的排列顺序是④b点时溶液中各离子浓度由大到小的排列顺序是
您最近一年使用:0次
名校
8 . 根据实验操作及现象,下列结论中正确的是
| 实验目的 | 方案设计和现象 | 结论 | |
| A | 比较KMnO4、Cl2和Fe3+的氧化性 | 向酸性KMnO4溶液中滴入FeCl2溶液,紫红色溶液变浅并伴有黄绿色气体产生 | 氧化性:KMnO4>Cl2>Fe3+ |
| B | 比较Ksp(AgCl)、Ksp(AgI)的大小 | 向NaCl、NaI混合溶液中滴入少量AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl)大于Ksp(AgI) |
| C | 检验海带中是否含有碘元素 | 将海带灰溶解过滤后,取适量滤液于试管中,酸化后加入少量双氧水,充分反应后加入1-2滴淀粉溶液 | 溶液变蓝,则证明海带中含有碘元素 |
| D | 温度对SO 水解平衡的影响 水解平衡的影响 | 将25℃0.1mol•L-1Na2SO3溶液加热到40℃,用传感器监测溶液pH变化 | pH变小,温度升高,SO 的水解平衡正向移动 的水解平衡正向移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-03-11更新
|
187次组卷
|
2卷引用:四川省成都外国语学校2023-2024学年高三上学期期末考试理科综合试题-高中化学
9 . 向三份0.1mol/L  溶液中分别加入少量
溶液中分别加入少量 、
、 、
、 固体(忽略溶液体积变化),则
固体(忽略溶液体积变化),则 浓度的变化依次为
浓度的变化依次为
 溶液中分别加入少量
溶液中分别加入少量 、
、 、
、 固体(忽略溶液体积变化),则
固体(忽略溶液体积变化),则 浓度的变化依次为
浓度的变化依次为| A.减小、增大、减小 | B.增大、减小、减小 |
| C.减小、增大、增大 | D.增大、减小、增大 |
您最近一年使用:0次
名校
解题方法
10 . 某工厂以废旧电池正极材料为主要原料制取 及
及 ,其工艺流程如图所示(
,其工艺流程如图所示( 难溶于水及碱溶液,酸性条件下+3价的钴具有强氧化性)。
难溶于水及碱溶液,酸性条件下+3价的钴具有强氧化性)。

回答下列问题:
(1)要提高“碱浸”速率,可以采取的措施有___________ 、___________ (写两条)。
(2)常温下,以 的
的 标准液滴定20.00mL“碱浸”所用的NaOH溶液,试剂a为指示剂,达到滴定终点时消耗
标准液滴定20.00mL“碱浸”所用的NaOH溶液,试剂a为指示剂,达到滴定终点时消耗 标准液。
标准液。
①常温下, 的
的 标准液中,
标准液中,
___________  。
。
②试剂a为___________ ,
___________  。
。
(3)温度升高“滤液”碱性增强,其原因是___________ 。
(4)某温度下, 、
、 达到溶解平衡的某悬浊液中,
达到溶解平衡的某悬浊液中, ,
,
___________ {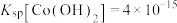 ,
, }。
}。
 及
及 ,其工艺流程如图所示(
,其工艺流程如图所示( 难溶于水及碱溶液,酸性条件下+3价的钴具有强氧化性)。
难溶于水及碱溶液,酸性条件下+3价的钴具有强氧化性)。
回答下列问题:
(1)要提高“碱浸”速率,可以采取的措施有
(2)常温下,以
 的
的 标准液滴定20.00mL“碱浸”所用的NaOH溶液,试剂a为指示剂,达到滴定终点时消耗
标准液滴定20.00mL“碱浸”所用的NaOH溶液,试剂a为指示剂,达到滴定终点时消耗 标准液。
标准液。①常温下,
 的
的 标准液中,
标准液中,
 。
。②试剂a为

 。
。(3)温度升高“滤液”碱性增强,其原因是
(4)某温度下,
 、
、 达到溶解平衡的某悬浊液中,
达到溶解平衡的某悬浊液中, ,
,
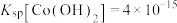 ,
, }。
}。
您最近一年使用:0次
2024-03-07更新
|
64次组卷
|
2卷引用:辽宁省本溪市第一中学2023-2024学年高二上学期11月期中考试化学试题



