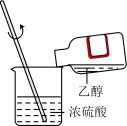
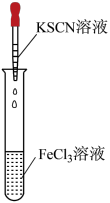1 . 为达到下列实验目的,其实验操作正确的是
| 实验目的 | A.验证温度对水解平衡的影响 | B.检查装置的气密性 |
| 实验操作 |
|
|
| 实验目的 | C.混合浓硫酸和乙醇 | D.检验溶液的 |
| 实验操作 |
|
|
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
7日内更新
|
96次组卷
|
2卷引用:天津市河北区2023-2024学年高三年级总复习质量检测(二)化学试卷
2 . 科学探究要实事求是、严谨细致。某化学兴趣小组设计实验进行有关氯化物的探究实验,回答下列问题:
Ⅰ.FeCl3在工业生产中应用广泛,某化学研究性学习小组模拟工业流程制备无水FeCl3。经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了以Fe粉和Cl2为原料制备无水FeCl3的实验方案,装置示意图如下:___________ 。
(2)装置A中设计g管的作用是___________ 。
(3)装置A中发生反应的离子方程式为___________ 。
Ⅱ.利用惰性电极电解0.1mol/LFeCl2溶液,探究外界条件对电极反应(离子放电顺序)的影响。
实验数据如表所示:
(4)由实验1、2现象可以得出结论:增大pH,___________ 优先于___________ 放电;
Ⅲ.为了探究外界条件对氯化铵水解平衡的影响,兴趣小组设计了如下实验方案:
(5)该实验限选药品和仪器:恒温水浴、pH传感器、烧杯、0.1mol/L硝酸银溶液、蒸馏水和各种浓度的NH4Cl溶液。
①实验中,“待测物理量X”是___________ ;
②为了探究浓度对氯化铵水解平衡的影响,实验6可与实验___________ 作对照实验;
③实验目的ii是___________ ;
④氯化铵在生产生活中有很多实用的用途,请写出一种应用:___________ 。
Ⅰ.FeCl3在工业生产中应用广泛,某化学研究性学习小组模拟工业流程制备无水FeCl3。经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了以Fe粉和Cl2为原料制备无水FeCl3的实验方案,装置示意图如下:
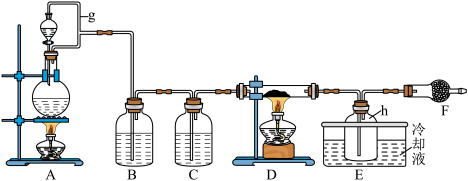
(2)装置A中设计g管的作用是
(3)装置A中发生反应的离子方程式为
Ⅱ.利用惰性电极电解0.1mol/LFeCl2溶液,探究外界条件对电极反应(离子放电顺序)的影响。
实验数据如表所示:
| 实验编号 | 电压/V | pH | 阳极现象 | 阴极现象 |
| 1 | 1.5 | 1.00 | 无气泡,滴加KSCN显红色 | 较多气泡,极少量金属析出 |
| 2 | 1.5 | 5.52 | 无气泡,滴加KSCN显红色 | 无气泡,银白色金属析出 |
| 3 | 3.0 | 5.52 | 少量气泡,滴加KSCN显红色 | 无气泡,银白色金属析出 |
| 4 | 4.5 | 5.52 | 大量气泡,滴加KSCN显红色 | 较多气泡,极少量金属析出 |
(4)由实验1、2现象可以得出结论:增大pH,
Ⅲ.为了探究外界条件对氯化铵水解平衡的影响,兴趣小组设计了如下实验方案:
| 实验编号 | c(NH4Cl)/mol·L-1 | 温度/℃ | 待测物理量X | 实验目的 |
| 5 | 0.5 | 30 | a | ___________ |
| 6 | 1.5 | i | b | 探究浓度对氯化铵水解平衡的影响 |
| 7 | 1.5 | 35 | c | ii |
| 8 | 2.0 | 40 | d | 探究温度、浓度同时对氯化铵化解平衡的影响 |
(5)该实验限选药品和仪器:恒温水浴、pH传感器、烧杯、0.1mol/L硝酸银溶液、蒸馏水和各种浓度的NH4Cl溶液。
①实验中,“待测物理量X”是
②为了探究浓度对氯化铵水解平衡的影响,实验6可与实验
③实验目的ii是
④氯化铵在生产生活中有很多实用的用途,请写出一种应用:
您最近半年使用:0次
3 . (1)已知25℃时,醋酸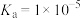 ,0.1mol/L的醋酸溶液的pH=
,0.1mol/L的醋酸溶液的pH=___________ 。
(2)相同物质的量浓度的五种溶液:①(NH4)2SO4 ②氨水③NH4HSO4 ④NH4Cl⑤(NH4)2Fe(SO4)2,c(NH4+)由大到小顺序是___________ (用序号表示)。
(3)可溶性铝盐常用作净水剂的原因:___________ (用离子方程式表示)。
(4)将等体积等物质的量浓度的CH3COONa和NaF溶液混合:c(CH3COOH)+c(HF)___________ c(OH-)-c(H+)(填 > 或 < 或 =)
(5)某温度下,测得的0.001mol/LHCl溶液中,由水电离出来的 。求此温度下,水离子积常数为
。求此温度下,水离子积常数为___________ 。在此温度下,将 的HCl溶液和
的HCl溶液和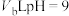 的
的 溶液混合均匀,测得溶液的pH=7,则
溶液混合均匀,测得溶液的pH=7,则
___________ 。
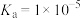 ,0.1mol/L的醋酸溶液的pH=
,0.1mol/L的醋酸溶液的pH=(2)相同物质的量浓度的五种溶液:①(NH4)2SO4 ②氨水③NH4HSO4 ④NH4Cl⑤(NH4)2Fe(SO4)2,c(NH4+)由大到小顺序是
(3)可溶性铝盐常用作净水剂的原因:
(4)将等体积等物质的量浓度的CH3COONa和NaF溶液混合:c(CH3COOH)+c(HF)
(5)某温度下,测得的0.001mol/LHCl溶液中,由水电离出来的
 。求此温度下,水离子积常数为
。求此温度下,水离子积常数为 的HCl溶液和
的HCl溶液和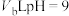 的
的 溶液混合均匀,测得溶液的pH=7,则
溶液混合均匀,测得溶液的pH=7,则
您最近半年使用:0次
4 . 为了探究温度对水解平衡的影响,用手持技术测定一定浓度 溶液的pH随温度变化的关系如图所示,下列说法不正确的是
溶液的pH随温度变化的关系如图所示,下列说法不正确的是
 溶液的pH随温度变化的关系如图所示,下列说法不正确的是
溶液的pH随温度变化的关系如图所示,下列说法不正确的是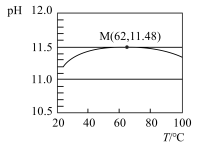
| A.该实验能证明升温促进水解 | B.点M之后 水解放热 水解放热 |
C.点M处溶液中 略大于 略大于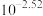 mol/L mol/L | D.点M后pH下降是因为升温对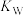 的影响更大 的影响更大 |
您最近半年使用:0次
5 . 根据实验目的,下列实验操作及现象与结论均正确的是
| 选项 | 实验目的 | 实验操作及现象 | 结论 |
| A | 比较CH3COO-和 的水解常数 的水解常数 | 分别测浓度均为0.1mol·L-1的CH3COONH4和NaHCO3溶液的pH, 后者大于前者 | Kh(CH3COO-)<Kh( ) ) |
| B | 验证Cl2与H2O的反应存在限度 | 取两份新制氯水,分别滴加AgNO3溶液和淀粉-KI溶液,前者有白色沉淀,后者溶液变蓝色 | 氯气与水的反应存在限度 |
| C | 探究氢离子浓度对 (黄色)。 (黄色)。 (橙红色)相互转化的影响 (橙红色)相互转化的影响 | 向K2CrO4溶液中缓慢滴加硫酸溶液,黄色变为橙红色 | 增大c(H+),转化平衡向生成 的方向移动 的方向移动 |
| D | 比较AgCl与AgI的溶度积大小 | 向2mL0.1 AgNO3溶液中先滴加4滴0.1 AgNO3溶液中先滴加4滴0.1 KCl溶液,再滴加4滴0.1 KCl溶液,再滴加4滴0.1 KI溶液,先产生白色沉淀,再产生黄色沉淀 KI溶液,先产生白色沉淀,再产生黄色沉淀 | AgCl转化为AgI,AgI的溶度积小于AgCl的 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
6 . Ⅰ.按要求回答下列问题:
(1)下列变化中属于吸热反应的是___________ 。
①铝片与稀盐酸的反应 ②将胆矾加热变为白色粉末 ③干冰汽化
④氯酸钾分解制氧气 ⑤甲烷在氧气中的燃烧反应 ⑥ 与盐酸的反应
与盐酸的反应
(2)反应 在一个容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
在一个容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是___________ 。
①增加 的量
的量
②将容器的体积缩小一半
③保持体积不变,充入 使体系压强增大
使体系压强增大
④保持压强不变,充入 使容器体积变大
使容器体积变大
Ⅱ.在体积为 的密闭容器中,充入
的密闭容器中,充入 和
和 ,一定条件下反应:
,一定条件下反应: ,测得
,测得 和
和 的浓度随时间变化如图:
的浓度随时间变化如图:
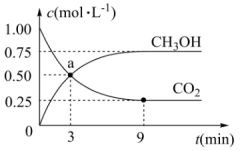
(3)从3min到9min,v(CO2)=___________ (结果保留两位有效数字);a点时v(正)___________ v(逆)(填>、<或=);
Ⅲ.某研究小组在实验室用硫化碱法制备 ,实验装置如图:
,实验装置如图:
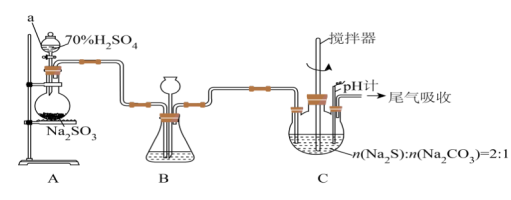
(4)装置 的作用是
的作用是___________ 。
(5)配制 溶液时,常加入少量
溶液时,常加入少量___________ 以防止出现浑浊和 的逸出。
的逸出。
(6)为了提高 的吸收效率,在不改变装置
的吸收效率,在不改变装置 中的溶液浓度、体积的条件下,还可采取的合理措施是
中的溶液浓度、体积的条件下,还可采取的合理措施是___________ (填序号)。
a.适当加快搅拌速率 b.加快 的流速 c.增大
的流速 c.增大 的接触面积
的接触面积
(1)下列变化中属于吸热反应的是
①铝片与稀盐酸的反应 ②将胆矾加热变为白色粉末 ③干冰汽化
④氯酸钾分解制氧气 ⑤甲烷在氧气中的燃烧反应 ⑥
 与盐酸的反应
与盐酸的反应(2)反应
 在一个容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
在一个容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是①增加
 的量
的量②将容器的体积缩小一半
③保持体积不变,充入
 使体系压强增大
使体系压强增大④保持压强不变,充入
 使容器体积变大
使容器体积变大Ⅱ.在体积为
 的密闭容器中,充入
的密闭容器中,充入 和
和 ,一定条件下反应:
,一定条件下反应: ,测得
,测得 和
和 的浓度随时间变化如图:
的浓度随时间变化如图:
(3)从3min到9min,v(CO2)=
Ⅲ.某研究小组在实验室用硫化碱法制备
 ,实验装置如图:
,实验装置如图:
(4)装置
 的作用是
的作用是(5)配制
 溶液时,常加入少量
溶液时,常加入少量 的逸出。
的逸出。(6)为了提高
 的吸收效率,在不改变装置
的吸收效率,在不改变装置 中的溶液浓度、体积的条件下,还可采取的合理措施是
中的溶液浓度、体积的条件下,还可采取的合理措施是a.适当加快搅拌速率 b.加快
 的流速 c.增大
的流速 c.增大 的接触面积
的接触面积
您最近半年使用:0次
解题方法
7 . 下列与实验相关的叙述正确的是
A.将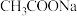 溶液从20℃升温至30℃,溶液中 溶液从20℃升温至30℃,溶液中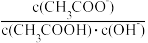 减小 减小 |
B.用湿润的 试纸测定 试纸测定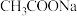 溶液的 溶液的 ,会使测得结果偏大 ,会使测得结果偏大 |
| C.酸碱滴定时,若加入待测液前用待测液润洗锥形瓶,将导致测定结果偏低 |
D.将 沉淀转入表面皿中,加入足量稀盐酸,加热蒸干得无水 沉淀转入表面皿中,加入足量稀盐酸,加热蒸干得无水 固体 固体 |
您最近半年使用:0次
解题方法
8 . 下表中实验操作、现象与结论对应关系正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 以酚酞为指示剂,用盐酸标准液滴定氢氧化钠溶液 | 溶液由红色变为浅红色便立刻读数 | 测得c(NaOH)偏大 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 有白色沉淀生成,溶液红色变浅 | 纯碱溶液呈碱性是由 水解引起 水解引起 |
| C | 测定等浓度的NaClO溶液、CH3COONa溶液的pH | 前者大 | 酸性:HClO>CH3COOH |
| D | 除去锅炉中沉积的CaSO4用饱和Na2CO3溶液浸泡,再用稀盐酸溶解除去 | 白色沉淀溶解 | CaSO4比CaCO3的 小 小 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
解题方法
9 . 下列叙述正确的是
A. 是一种一元强碱,则 是一种一元强碱,则 的 的 溶液的 溶液的 一定是13 一定是13 |
B.25℃时, 的硫酸和 的硫酸和 的醋酸等体积混合后,溶液 的醋酸等体积混合后,溶液 仍为2 仍为2 |
C.向醋酸钠溶液中加入食盐水,混合前后溶液 值相同 值相同 |
D.加热蒸发饱和 溶液,恢复至室温并过滤,滤液中溶质的质量分数小于原溶液 溶液,恢复至室温并过滤,滤液中溶质的质量分数小于原溶液 |
您最近半年使用:0次
解题方法
10 . 硫酸是基础化工的重要产品,硫酸的消费量可作为衡量一个国家工业发展水平的标志。生产硫酸的主要反应为: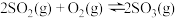 。
。
(1)该反应的催化剂为 ,其催化反应过程为:
,其催化反应过程为: 、
、 

 。则在相同温度下
。则在相同温度下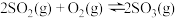 的平衡常数
的平衡常数
_______ (以含 、
、 的代数式表示)。
的代数式表示)。 加快反应速率的原因是
加快反应速率的原因是_______ 。
(2) 催化氧化生成
催化氧化生成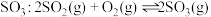
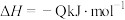 。某温度下,将
。某温度下,将 和
和 按物质的量之比2:1置于10L恒容密闭容器中反应,
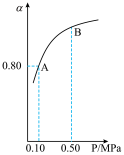
按物质的量之比2:1置于10L恒容密闭容器中反应, 的平衡转化率(a)与体系总压强(P)的关系如下图所示。根据图示回答下列问题:
的平衡转化率(a)与体系总压强(P)的关系如下图所示。根据图示回答下列问题:
①若起始时充入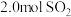 和
和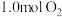 ,反应达平衡后,体系总压强为0.10MPa,则该反应的平衡常数等于
,反应达平衡后,体系总压强为0.10MPa,则该反应的平衡常数等于_______ L/mol。
②改在容器中加入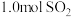 、
、 和
和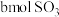 ,保持温度不变反应达平衡后,体系总压强也为0.10MPa,则b=
,保持温度不变反应达平衡后,体系总压强也为0.10MPa,则b=_______ mol,反应开始时
_______ 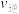 。反应中吸收或释放的热量为
。反应中吸收或释放的热量为_______ kJ。
③平衡状态由A变到B时,平衡常数
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(3)工业上可以用NaOH溶液或氨水吸收过量的 ,分别生成
,分别生成 、
、 ,其水溶液均呈酸性。相同条件下,同浓度的两种酸式盐的水溶液中
,其水溶液均呈酸性。相同条件下,同浓度的两种酸式盐的水溶液中 较小的是
较小的是_______ (填化学式),用文字和化学用语解释原因_______ 。
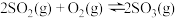 。
。(1)该反应的催化剂为
 ,其催化反应过程为:
,其催化反应过程为: 、
、 

 。则在相同温度下
。则在相同温度下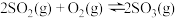 的平衡常数
的平衡常数
 、
、 的代数式表示)。
的代数式表示)。 加快反应速率的原因是
加快反应速率的原因是(2)
 催化氧化生成
催化氧化生成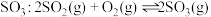
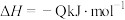 。某温度下,将
。某温度下,将 和
和 按物质的量之比2:1置于10L恒容密闭容器中反应,
按物质的量之比2:1置于10L恒容密闭容器中反应, 的平衡转化率(a)与体系总压强(P)的关系如下图所示。根据图示回答下列问题:
的平衡转化率(a)与体系总压强(P)的关系如下图所示。根据图示回答下列问题:
①若起始时充入
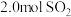 和
和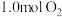 ,反应达平衡后,体系总压强为0.10MPa,则该反应的平衡常数等于
,反应达平衡后,体系总压强为0.10MPa,则该反应的平衡常数等于②改在容器中加入
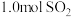 、
、 和
和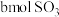 ,保持温度不变反应达平衡后,体系总压强也为0.10MPa,则b=
,保持温度不变反应达平衡后,体系总压强也为0.10MPa,则b=
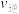 。反应中吸收或释放的热量为
。反应中吸收或释放的热量为③平衡状态由A变到B时,平衡常数

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(3)工业上可以用NaOH溶液或氨水吸收过量的
 ,分别生成
,分别生成 、
、 ,其水溶液均呈酸性。相同条件下,同浓度的两种酸式盐的水溶液中
,其水溶液均呈酸性。相同条件下,同浓度的两种酸式盐的水溶液中 较小的是
较小的是
您最近半年使用:0次