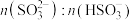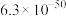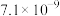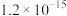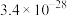名校
解题方法
1 . 10℃时加热 的饱和溶液,测得该溶液的pH发生如下变化:
的饱和溶液,测得该溶液的pH发生如下变化:
对于上述实验过程中的现象,甲同学和乙同学的观点如下:
(1)甲同学认为,最终该溶液的pH升高的原因是 的水解程度增大,故碱性增强,该反应的离子方程式为
的水解程度增大,故碱性增强,该反应的离子方程式为______________________________ 。
(2)乙同学认为最终溶液pH升高的原因是 受热分解,生成了
受热分解,生成了 ,该分解反应的化学方程式为
,该分解反应的化学方程式为______________________________ ,并判断 的水解程度
的水解程度__________ (选填“>”或“<”) 。
。
关于甲、乙同学的观点是否正确,两同学和丁同学的观点如下:
(3)丙同学认为只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则__________ (选填“甲”或“乙”)判断正确。试剂X是__________ 。
(4)丁同学则认为不需要添加任何试剂,只要在合适的条件下测定溶液的pH即可判断,请分析丁同学的实验方法和对应的结论。
___________________________________________________________
(5) 和
和 混合溶液的pH随
混合溶液的pH随 和
和 比例的不同而不同,数据如下:
比例的不同而不同,数据如下:
表中第__________ 组(选填序号)数据,可判断 溶液显
溶液显__________ (选填“酸”或“碱”)性。
 的饱和溶液,测得该溶液的pH发生如下变化:
的饱和溶液,测得该溶液的pH发生如下变化:温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)甲同学认为,最终该溶液的pH升高的原因是
 的水解程度增大,故碱性增强,该反应的离子方程式为
的水解程度增大,故碱性增强,该反应的离子方程式为(2)乙同学认为最终溶液pH升高的原因是
 受热分解,生成了
受热分解,生成了 ,该分解反应的化学方程式为
,该分解反应的化学方程式为 的水解程度
的水解程度 。
。关于甲、乙同学的观点是否正确,两同学和丁同学的观点如下:
(3)丙同学认为只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则
(4)丁同学则认为不需要添加任何试剂,只要在合适的条件下测定溶液的pH即可判断,请分析丁同学的实验方法和对应的结论。
(5)
 和
和 混合溶液的pH随
混合溶液的pH随 和
和 比例的不同而不同,数据如下:
比例的不同而不同,数据如下:序号 | ① | ② | ③ |
| 91:9 | 1:1 | 1:9 |
pH | 8.2 | 7.2 | 6.2 |
 溶液显
溶液显
您最近一年使用:0次
名校
解题方法
2 . 漂白粉在溶液中存在平衡: ,下列措施能增强漂白能力是
,下列措施能增强漂白能力是
 ,下列措施能增强漂白能力是
,下列措施能增强漂白能力是A.加 稀释 稀释 | B.加少量纯碱 | C.通入 | D.滴加适量食醋 |
您最近一年使用:0次
名校
3 . 酸碱盐等电解质溶液中存在的电离平衡、水解平衡和沉淀溶解平衡都与生命活动、日常生活、工农业生产和环境保护等息息相关。请回答下列问题:
(1)在0.1mol/L的重铬酸钾( )溶液中存在如下平衡:
)溶液中存在如下平衡: 。在强碱溶液中,+6价铬元素的主要存在形式为
。在强碱溶液中,+6价铬元素的主要存在形式为______ (填离子符号),向重铬酸钾溶液中加入适量稀硫酸,溶液中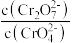 将
将______ (填“增大”“减小”或“不变”)。
(2)①NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品。相同条件下,0.1mol·L-1 NH4Al(SO4)2中c(NH )
)______ 0.1mol·L-1NH4HSO4中c(NH )。(填“>”“<”或“=”);
)。(填“>”“<”或“=”);
②25℃时,测得某浓度 NH4Al(SO4)2溶液的pH=3.2,其中2c(SO )-c(NH
)-c(NH )-3c(Al3+)
)-3c(Al3+)_____ mol·L-1。(不必化简,用代数式表示)
(3)重金属离子对河流、海洋造成严重污染。某化工厂废水(pH=2.0)中含有Ag+、Pb2+等重金属离子其浓度各约为0.01mol/L。排放前拟用沉淀法除去这两种离子,查找有关数据如下(常温):
①认为往废水中投入___________ (填字母序号),沉淀效果最好。
A.NaOH B.Na2S C.KI D.Ca(OH)2
②常温下,如果用生石灰处理上述废水,使溶液的pH=9.0,处理后的废水中c(Pb2+)=___________ 。
(1)在0.1mol/L的重铬酸钾(
 )溶液中存在如下平衡:
)溶液中存在如下平衡: 。在强碱溶液中,+6价铬元素的主要存在形式为
。在强碱溶液中,+6价铬元素的主要存在形式为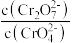 将
将(2)①NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品。相同条件下,0.1mol·L-1 NH4Al(SO4)2中c(NH
 )
) )。(填“>”“<”或“=”);
)。(填“>”“<”或“=”);②25℃时,测得某浓度 NH4Al(SO4)2溶液的pH=3.2,其中2c(SO
 )-c(NH
)-c(NH )-3c(Al3+)
)-3c(Al3+)(3)重金属离子对河流、海洋造成严重污染。某化工厂废水(pH=2.0)中含有Ag+、Pb2+等重金属离子其浓度各约为0.01mol/L。排放前拟用沉淀法除去这两种离子,查找有关数据如下(常温):
难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
Ksp |
|
|
|
|
|
|
A.NaOH B.Na2S C.KI D.Ca(OH)2
②常温下,如果用生石灰处理上述废水,使溶液的pH=9.0,处理后的废水中c(Pb2+)=
您最近一年使用:0次
名校
4 . 25℃时,对于浓度均为0.6mol•L-1的NaHCO3和Na2CO3溶液,下列判断不正确的是
| A.可用CaCl2溶液鉴别 |
| B.存在的粒子种类相同 |
| C.c(OH-)前者大于后者 |
D.分别加入NaOH固体,恢复到原温度时,c(CO )均增大 )均增大 |
您最近一年使用:0次
名校
5 . 在含有弱电解质的溶液中,往往有多个平衡共存。
(1)常温下,将 的某一元酸
的某一元酸 溶液和
溶液和 的
的 溶液等体积混合后溶液的
溶液等体积混合后溶液的 大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是
大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是___________ (填字母)。
A.
B.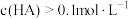
C.
(2)常温下,向 溶液中逐滴加入
溶液中逐滴加入 溶液,溶液中含碳元素的各种微粒(
溶液,溶液中含碳元素的各种微粒( 因逸出未画出)的物质的量分数(纵轴)随溶液的
因逸出未画出)的物质的量分数(纵轴)随溶液的 变化的部分情况如图所示。
变化的部分情况如图所示。

①在同一溶液中,
___________ (填“能”或“不能”)大量共存。
②当 时,溶液中
时,溶液中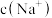
___________ (填“>”、“<”或“=”)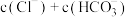 。
。
③ 时,
时, 水解反应的平衡常数
水解反应的平衡常数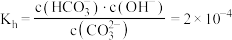 ,当溶液中
,当溶液中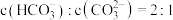 时,溶液的
时,溶液的
___________ 。
(3) 虽然具有净水作用,但是会腐蚀设备。聚合氯化铁是一种新型的絮凝剂,处理污水比
虽然具有净水作用,但是会腐蚀设备。聚合氯化铁是一种新型的絮凝剂,处理污水比 高效,且腐蚀性小。
高效,且腐蚀性小。
① 在溶液中分三步水解:
在溶液中分三步水解:


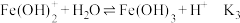
上述水解反应的平衡常数 由大到小的顺序是
由大到小的顺序是___________ 。
②通过控制条件,上述水獬产物聚合,生成聚合氯化铁,其离子方程式为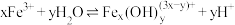 ,欲使平衡正向移动可采用的措施是
,欲使平衡正向移动可采用的措施是___________ (填字母)。
a.加水稀释 b.降温 c.加入
(1)常温下,将
 的某一元酸
的某一元酸 溶液和
溶液和 的
的 溶液等体积混合后溶液的
溶液等体积混合后溶液的 大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是
大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是A.

B.
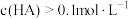
C.

(2)常温下,向
 溶液中逐滴加入
溶液中逐滴加入 溶液,溶液中含碳元素的各种微粒(
溶液,溶液中含碳元素的各种微粒( 因逸出未画出)的物质的量分数(纵轴)随溶液的
因逸出未画出)的物质的量分数(纵轴)随溶液的 变化的部分情况如图所示。
变化的部分情况如图所示。
①在同一溶液中,

②当
 时,溶液中
时,溶液中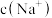
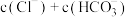 。
。③
 时,
时, 水解反应的平衡常数
水解反应的平衡常数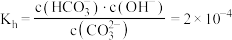 ,当溶液中
,当溶液中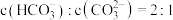 时,溶液的
时,溶液的
(3)
 虽然具有净水作用,但是会腐蚀设备。聚合氯化铁是一种新型的絮凝剂,处理污水比
虽然具有净水作用,但是会腐蚀设备。聚合氯化铁是一种新型的絮凝剂,处理污水比 高效,且腐蚀性小。
高效,且腐蚀性小。①
 在溶液中分三步水解:
在溶液中分三步水解:

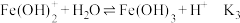
上述水解反应的平衡常数
 由大到小的顺序是
由大到小的顺序是②通过控制条件,上述水獬产物聚合,生成聚合氯化铁,其离子方程式为
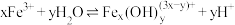 ,欲使平衡正向移动可采用的措施是
,欲使平衡正向移动可采用的措施是a.加水稀释 b.降温 c.加入

您最近一年使用:0次
名校
6 . 一定温度下,稀释 的
的 溶液,溶液的某种量x与加入水的体积之间的关系如图所示,则x可以表示的是
溶液,溶液的某种量x与加入水的体积之间的关系如图所示,则x可以表示的是
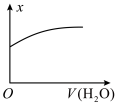
 的
的 溶液,溶液的某种量x与加入水的体积之间的关系如图所示,则x可以表示的是
溶液,溶液的某种量x与加入水的体积之间的关系如图所示,则x可以表示的是
A. 水解的平衡常数 水解的平衡常数 | B. |
C. | D. |
您最近一年使用:0次
名校
7 . 下列关于盐类水解的说法错误的是
A.在NH4Cl溶液中加入稀盐酸能抑制 水解 水解 |
| B.常温下,醋酸分子不可能存在于pH>7的碱性溶液中 |
| C.实验室配制FeCl3溶液时,常将FeCl3晶体溶于较浓的盐酸中,再加水稀释到所需浓度 |
| D.滴有酚酞的CH3COONa溶液加热,溶液颜色会变深 |
您最近一年使用:0次
名校
8 . 下列物质溶于水后,抑制水的电离且溶液显碱性的是
| A.KNO3 | B.Na2O2 | C.NH4Cl | D.CH3COONa |
您最近一年使用:0次
2024-01-01更新
|
64次组卷
|
2卷引用:黑龙江省哈尔滨师范大学附属中学2023-2024学年高二上学期11月期中化学试题
名校
解题方法
9 . 某实验小组对 溶液与
溶液与 溶液的反应进行探究。
溶液的反应进行探究。
已知:铁氰化钾的化学式为 ,用于检验
,用于检验 ,遇
,遇 离子产生蓝色沉淀
离子产生蓝色沉淀
(1)配制 溶液时,先将
溶液时,先将 溶于浓盐酸,再稀释至指定浓度。从化学平衡角度说明浓盐酸的作用
溶于浓盐酸,再稀释至指定浓度。从化学平衡角度说明浓盐酸的作用___________ 。
【探究现象ⅰ产生的原因】
(2)甲同学认为发生反应: (胶体)
(胶体) ;他取少量红褐色溶液于试管中,继续滴加1mol/L
;他取少量红褐色溶液于试管中,继续滴加1mol/L 溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是
溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是___________ (填化学式)。
(3)乙同学认为还发生了氧化还原反应。他取少许红褐色溶液于试管中,加入___________ ,有白色沉淀产生,证明产物中含有 。并依据反应现象判断出两种反应活化能较大的是
。并依据反应现象判断出两种反应活化能较大的是___________ (填“水解反应”或“氧化还原反应”)。
丙同学认为乙同学的实验不严谨,因为在上述过程中 可能被其它物质氧化。为了进一步确认
可能被其它物质氧化。为了进一步确认 被氧化的原因,丙同学设计了实验2。
被氧化的原因,丙同学设计了实验2。
【实验2】用如图装置(a、b均为石墨电极)进行实验。闭合开关后灵敏电流计指针偏转。

(4)实验2中正极的电极反应式为___________ 。
(5)丙同学又用铁氰化钾溶液检验正极的产物,观察到有蓝色沉淀产生。他得出的结论是___________ 。
【解释现象ⅱ产生的原因】
(6)综合上述结果,请从平衡移动角度解释,现象ⅱ产生的原因为___________ 。
 溶液与
溶液与 溶液的反应进行探究。
溶液的反应进行探究。已知:铁氰化钾的化学式为
 ,用于检验
,用于检验 ,遇
,遇 离子产生蓝色沉淀
离子产生蓝色沉淀| 【实验1】装置 | 实验现象 |
 | 现象ⅰ:一开始溶液颜色加深,由棕黄色变为红褐色。 现象ⅱ:一段时间后溶液颜色变浅,变为浅黄色。 |
(1)配制
 溶液时,先将
溶液时,先将 溶于浓盐酸,再稀释至指定浓度。从化学平衡角度说明浓盐酸的作用
溶于浓盐酸,再稀释至指定浓度。从化学平衡角度说明浓盐酸的作用【探究现象ⅰ产生的原因】
(2)甲同学认为发生反应:
 (胶体)
(胶体) ;他取少量红褐色溶液于试管中,继续滴加1mol/L
;他取少量红褐色溶液于试管中,继续滴加1mol/L 溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是
溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是(3)乙同学认为还发生了氧化还原反应。他取少许红褐色溶液于试管中,加入
 。并依据反应现象判断出两种反应活化能较大的是
。并依据反应现象判断出两种反应活化能较大的是丙同学认为乙同学的实验不严谨,因为在上述过程中
 可能被其它物质氧化。为了进一步确认
可能被其它物质氧化。为了进一步确认 被氧化的原因,丙同学设计了实验2。
被氧化的原因,丙同学设计了实验2。【实验2】用如图装置(a、b均为石墨电极)进行实验。闭合开关后灵敏电流计指针偏转。

(4)实验2中正极的电极反应式为
(5)丙同学又用铁氰化钾溶液检验正极的产物,观察到有蓝色沉淀产生。他得出的结论是
【解释现象ⅱ产生的原因】
(6)综合上述结果,请从平衡移动角度解释,现象ⅱ产生的原因为
您最近一年使用:0次
解题方法
10 . 聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,少量碳及二氧化硅)为原料制备的流程如下:

(1)为了提高废铁渣的浸出率,应该采用___________ (至少写一项)。
(2)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等,其中酸浸温度对铁浸取率的影响如图所示:

①加热条件下酸浸时,Fe3O4与硫酸反应的化学方程式为___________ 。
②酸浸时,通入O2的目的是___________ ,该反应的离子方程式为___________ 。
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是___________ 。
(3)滤渣的主要成分为___________ (填化学式)。
(4)“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+( 被还原为Cr3+),该滴定反应的离子方程式为
被还原为Cr3+),该滴定反应的离子方程式为___________ 。

(1)为了提高废铁渣的浸出率,应该采用
(2)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等,其中酸浸温度对铁浸取率的影响如图所示:

①加热条件下酸浸时,Fe3O4与硫酸反应的化学方程式为
②酸浸时,通入O2的目的是
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是
(3)滤渣的主要成分为
(4)“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(
 被还原为Cr3+),该滴定反应的离子方程式为
被还原为Cr3+),该滴定反应的离子方程式为
您最近一年使用:0次