解题方法
1 . 亚硫酰氯(SOCl2)又名氯化亚砜,是一种无色或淡黄色发烟液体,有强烈刺激性气味,其熔点-105°C ,沸点79 °C,140°C 以上时易分解。遇水剧烈反应生成SO2和HCl两种气体,常用作脱水剂,主要用于制造酰基氯化物,还用于医药、农药、染料等的生产。
(1)实验室合成SOCl2的原理之一为SO2 +Cl2 + SCl2 2SOCl2,部分装置(夹持、加热装置略去)如图所示。
2SOCl2,部分装置(夹持、加热装置略去)如图所示。
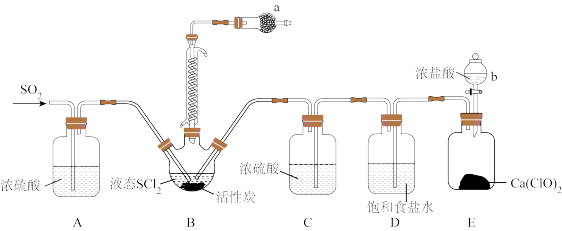
①实验室用亚硫酸钠固体与70%硫酸制备SO2,不用稀硫酸的原因为_______ 。
②装置A、C除干燥气体外,另一作用是_______ ;装置D的作用为_______ 。
③仪器b的名称为_______ ;写出装置 E中发生反应的化学方程式:_______ 。
④仪器a中的试剂为_______ 。
(2)甲同学设计实验利用SOCl2和AlCl3·6H2O混合加热制取无水AlCl3。
①用SOCl2和AlCl3·6H2O混合加热制取无水AlCl3时,SOCl2的作用为_______ 。
②实验室常用过量NaOH溶液吸收SOCl2,写出反应的离子方程式:_______ 。
(1)实验室合成SOCl2的原理之一为SO2 +Cl2 + SCl2
 2SOCl2,部分装置(夹持、加热装置略去)如图所示。
2SOCl2,部分装置(夹持、加热装置略去)如图所示。
①实验室用亚硫酸钠固体与70%硫酸制备SO2,不用稀硫酸的原因为
②装置A、C除干燥气体外,另一作用是
③仪器b的名称为
④仪器a中的试剂为
(2)甲同学设计实验利用SOCl2和AlCl3·6H2O混合加热制取无水AlCl3。
①用SOCl2和AlCl3·6H2O混合加热制取无水AlCl3时,SOCl2的作用为
②实验室常用过量NaOH溶液吸收SOCl2,写出反应的离子方程式:
您最近一年使用:0次
解题方法
2 . 化学与生产、生活及环境密切相关,下列说法不 正确的是
| A.新型冠状病毒疫苗一般应冷藏存放,其目的是避免蛋白质变性 |
| B.泡沫灭火器中的Al2(SO4)3溶液应贮存在铁制内筒中 |
| C.制作N95型口罩的核心材料是聚丙烯,属于有机高分子材料 |
| D.用“静电除尘”“燃煤固硫”“汽车尾气催化净化”等方法,可提高空气质量 |
您最近一年使用:0次
3 . 下列实验操作不能达到相应实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 配制 溶液 溶液 | 先将 固体溶于较浓的盐酸中,再加蒸馏水稀释到所需要的浓度 固体溶于较浓的盐酸中,再加蒸馏水稀释到所需要的浓度 |
| B | 比较醋酸与碳酸酸性的强弱 | 将 计分别伸入 计分别伸入 溶液和 溶液和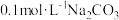 溶液,读取 溶液,读取 |
| C | 检验溶液中是否含有 | 取少量试剂于试管中,加入浓 溶液并加热,用湿润的红色石蕊纸检验产生的气体 溶液并加热,用湿润的红色石蕊纸检验产生的气体 |
| D | 试清洗碘升华实验所用试管 | 先用酒精清洗,再用水冲洗 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 化学与生产生活密切相关,下列有关说法中不正确的是
| A.酒精能使蛋白质变性,酒精纯度越高杀菌消毒效果越好 |
| B.酸雨以及光化学烟雾的形成通常都与氮的含氧化合物有关 |
| C.泡沫灭火器中用的是小苏打和硫酸铝 |
| D.金属焊接前常用NH4Cl溶液处理焊接处 |
您最近一年使用:0次
2019-02-20更新
|
521次组卷
|
2卷引用:西藏自治区昌都市第一高级中学2020届高三下学期第一次模拟考试理综化学试题
5 . 下列过程与“盐类的水解平衡”或“难溶电解质的溶解平衡”无关的是( )
| A.将NaOH溶液加入NaHSO4溶液中使其转化为Na2SO4 |
| B.将TiCl4加入水中并加热使其转化为TiO2•xH2O |
| C.将Na2CO3溶液加入水垢中使CaSO4转化为CaCO3 |
| D.将Na2S溶液加入含Hg2+的废水中使其转化为HgS沉淀 |
您最近一年使用:0次
2019-02-20更新
|
516次组卷
|
8卷引用:西藏拉萨市2020届高三第二次模拟考试理科综合化学试题
名校
6 . 用下列实验装置进行相应实验,设计正确且能达到实验目的的是
A.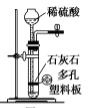 用于实验室制取少量CO2 用于实验室制取少量CO2 |
B. 用于配制一定物质的量浓度的硫酸 用于配制一定物质的量浓度的硫酸 |
C.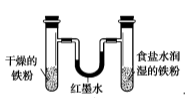 用于模拟生铁的电化学腐蚀 用于模拟生铁的电化学腐蚀 |
D. 用于蒸干AlCl3溶液制备无水AlCl3 用于蒸干AlCl3溶液制备无水AlCl3 |
您最近一年使用:0次
2018-06-03更新
|
1109次组卷
|
11卷引用:西藏日喀则市上海实验学校2020-2021学年高三下学期第二次模拟考试理综化学试题
西藏日喀则市上海实验学校2020-2021学年高三下学期第二次模拟考试理综化学试题【全国百强校】福建省厦门外国语学校2018届高三下学期5月适应性考试(最后压轴模拟)理综-化学试题【全国百强校】甘肃省天水市第一中学2019届高三下学期第三次模拟考试理科综合化学试题宁夏吴忠市2020届高三一轮联考理科综合化学试题(已下线)高考母题题源11 化学实验仪器、基本操作河北省隆化县存瑞中学2019届高三上学期期中考试化学试题安徽省蚌埠市第一中学2019届高三上学期期中考试化学试题黑龙江省哈尔滨市第六中学2020届高三上学期期中考试化学试题黑龙江省双鸭山市第一中学2020届高三12月月考化学试题江西省安远县第一中学2020届高三上学期第三次月考化学试题上海交通大学附属中学2021-2022学年高三上学期摸底测试化学试卷题
7 . 下列操作能达到实验目的的是
| 目的 | 操作 | |
| A | 制备无水氯化铝 | 将SOCl2 与AlCl3.6H2O |
| B | 制备乙酸乙酯 | 在试管中先加2mL浓硫酸,再加入2mL乙醇和乙酸,连接好装置加热 |
| C | 配制硝酸银溶液 | 将硝酸银固体溶于适量自来水 |
| D | 测定次氯酸钠的pH | 用玻璃棒蘸去溶液,点在湿润的pH试纸上 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-04-25更新
|
355次组卷
|
3卷引用:西藏山南市三校2019届高三5月模拟考试理综化学试题
未知-未知
|
适中(0.65)
|
名校
8 . NA表示阿伏伽德罗常数,下列叙述正确的是
| A.18g H216O 和20g H218O 含有的质子数均为10NA |
| B.1L 1mol/L的KAl(SO4)2 溶液中阳离子总数为2NA |
| C.0.2mol的铁与足量的稀硝酸反应,生成氢气的分子数目为0.3NA |
D.反应N2+3H2  2NH3 达平衡时,每消耗3molH2同时有2NA 个N-H 键断裂 2NH3 达平衡时,每消耗3molH2同时有2NA 个N-H 键断裂 |
您最近一年使用:0次
单选题
|
适中(0.65)
|
名校
9 . 下列有关叙述正确的是
| A.PH=4.3的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) |
| B.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
| C.若Ksp(AgCl)>Ksp(Ag2CrO4),则AgCl 的溶解度大于Ag2CrO4的溶解度 |
| D.向醋酸溶液中加少量水稀释后,溶液中 c(CH3COOH)增大 |
您最近一年使用:0次
名校
解题方法
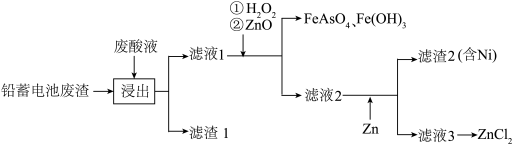
10 . ZnCI2是重要的工业原料,在电化学、冶金、印染等领域用途广泛,以某厂排放的废酸液(主要成分为盐酸,含Fe2+、Cu2+、Ni2+、H3AsO3等杂质)和锌蓄电池废渣(主要成分为ZnO、Zn)为原料制备ZnCl2的流程如图所示:
已知:
①25℃时,Ksp[Fe(OH)3]=4.0×10-38;Ksp[Zn(OH)2]=1.2×10-17;Ksp[Ni(OH)2]=2.0×10-15;
②溶液中的离子浓度小于等于10-5mol·L-1时,认为该离子沉淀完全。
请问答下列问题:
(1)在元素周期表中,砷(As)元素与氮元素同主族且处于第4 周期,则砷元素的最简单氢化物的电子式为_______________ ;其最高价氧化物对应水化物的化学式为___________________ 。
(2)“浸出”过程中主要生成两种单质,其化学式为________________ 。
(3)控制温度为75℃左右,向滤液1中加入H2O2,生成FeAsO4的离子方程式为_________ 。此过程中,所加入H2O2的量需适当大于理论值,原因因为____________ 。
(4)蒸发滤液3制备ZnCl2时,需不断通入HCl的理由为____________ 。
(5)某纽扣电池放电时,总反应为Zn+Ag2O+H2O═Zn(OH)2+ 2Ag,其正极反应式为______________ 。
(6)25℃时,向浓度为1.0 mol·L-1的Fe3+、Zn2+、Ni2+的混合溶液中滴加NaOH溶液,当Fe3+恰好沉淀完全时,所得溶液中c(Zn2+):c(Ni2+)=_______________ 。
已知:
①25℃时,Ksp[Fe(OH)3]=4.0×10-38;Ksp[Zn(OH)2]=1.2×10-17;Ksp[Ni(OH)2]=2.0×10-15;
②溶液中的离子浓度小于等于10-5mol·L-1时,认为该离子沉淀完全。
请问答下列问题:
(1)在元素周期表中,砷(As)元素与氮元素同主族且处于第4 周期,则砷元素的最简单氢化物的电子式为
(2)“浸出”过程中主要生成两种单质,其化学式为
(3)控制温度为75℃左右,向滤液1中加入H2O2,生成FeAsO4的离子方程式为
(4)蒸发滤液3制备ZnCl2时,需不断通入HCl的理由为
(5)某纽扣电池放电时,总反应为Zn+Ag2O+H2O═Zn(OH)2+ 2Ag,其正极反应式为
(6)25℃时,向浓度为1.0 mol·L-1的Fe3+、Zn2+、Ni2+的混合溶液中滴加NaOH溶液,当Fe3+恰好沉淀完全时,所得溶液中c(Zn2+):c(Ni2+)=
您最近一年使用:0次
2017-04-22更新
|
576次组卷
|
2卷引用:西藏山南地区第二高级中学2017届高三第三次模拟考试理综化学试题



