名校
1 . 钪是一种稀土金属元素,在国防、航天、核能等领域具有重要应用。氯化钪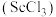 是制备钪的重要原料。工业上利用固体废料“赤泥”(含
是制备钪的重要原料。工业上利用固体废料“赤泥”(含 、
、 、
、 、
、 、
、 等)制取
等)制取 的流程如图。
的流程如图。 难溶于盐酸;②草酸可与多种金属离子形成可溶性络合物。
难溶于盐酸;②草酸可与多种金属离子形成可溶性络合物。
回答下列问题:
(1)酸浸中,滤渣的主要成分是_______ (填化学式), 溶解的离子反应方程式为
溶解的离子反应方程式为_______ 。
(2)“步骤Ⅰ”中加入 后选择合适试剂调pH,再将溶液加热煮沸一段时间,加热煮沸的目的是
后选择合适试剂调pH,再将溶液加热煮沸一段时间,加热煮沸的目的是_______ 。
(3)草酸用量过多时,钪的沉淀率反而下降,原因是_______ 。
(4)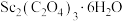 在空气中加热分解时,
在空气中加热分解时,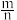 %随温度变化如图所示。
%随温度变化如图所示。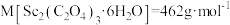 。
。
250℃时固体的主要成分是:_______ (填化学式)。
(5)传统制备 的方法是先得到
的方法是先得到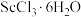 沉淀,再高温脱水得
沉淀,再高温脱水得 ,但通常含有
,但通常含有 杂质,原因是
杂质,原因是_______ 。
(6)“加热氯化”过程主要发生反应的化学方程式为:_______ 。
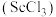 是制备钪的重要原料。工业上利用固体废料“赤泥”(含
是制备钪的重要原料。工业上利用固体废料“赤泥”(含 、
、 、
、 、
、 、
、 等)制取
等)制取 的流程如图。
的流程如图。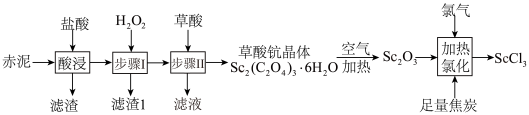
 难溶于盐酸;②草酸可与多种金属离子形成可溶性络合物。
难溶于盐酸;②草酸可与多种金属离子形成可溶性络合物。回答下列问题:
(1)酸浸中,滤渣的主要成分是
 溶解的离子反应方程式为
溶解的离子反应方程式为(2)“步骤Ⅰ”中加入
 后选择合适试剂调pH,再将溶液加热煮沸一段时间,加热煮沸的目的是
后选择合适试剂调pH,再将溶液加热煮沸一段时间,加热煮沸的目的是(3)草酸用量过多时,钪的沉淀率反而下降,原因是
(4)
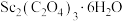 在空气中加热分解时,
在空气中加热分解时,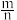 %随温度变化如图所示。
%随温度变化如图所示。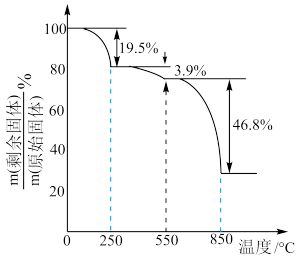
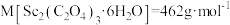 。
。250℃时固体的主要成分是:
(5)传统制备
 的方法是先得到
的方法是先得到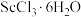 沉淀,再高温脱水得
沉淀,再高温脱水得 ,但通常含有
,但通常含有 杂质,原因是
杂质,原因是(6)“加热氯化”过程主要发生反应的化学方程式为:
您最近一年使用:0次
名校
2 . 三氯三(四氢呋喃)合铬(Ⅲ) 可催化烯烃加聚,制备的方法加下。
可催化烯烃加聚,制备的方法加下。
已知:① 易潮解,易升华,高温下易被氧气氧化。
易潮解,易升华,高温下易被氧气氧化。
② 气体有毒,遇水发生水解产生两种酸性气体。
气体有毒,遇水发生水解产生两种酸性气体。
Ⅰ.制备无水 :
:
某化学小组用 (沸点76.8℃)和
(沸点76.8℃)和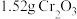 在高温下制备无水
在高温下制备无水 ,同时生成
,同时生成 气体,实验装置如图所示:
气体,实验装置如图所示: ,实验装置合理的连接顺序为A→C→F→
,实验装置合理的连接顺序为A→C→F→_______ →B(填装置字母标号,可重复使用)。
(2)装置乙名称为_______ ,装置D中粗导管的作用是_______ 。
(3)尾气处理时发生反应的离子方程式:_______ 。
Ⅱ.合成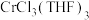 :
: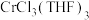 原理为:
原理为:
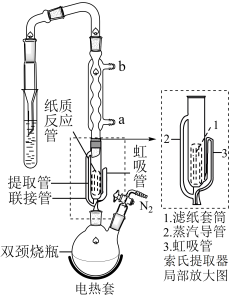
实验操作:按如图组装仪器,将步骤Ⅰ所得无水 和
和 锌粉放入滤纸套筒内,双颈烧瓶中加入
锌粉放入滤纸套筒内,双颈烧瓶中加入 无水四氢呋喃(THF),通
无水四氢呋喃(THF),通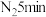 后关闭,接通冷却水,加热四氢呋喃至沸腾,在索氏提取器中发生反应,回流
后关闭,接通冷却水,加热四氢呋喃至沸腾,在索氏提取器中发生反应,回流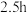 后再通入
后再通入 冷却至室温;取下双颈烧瓶,在通风橱中蒸发至有较多固体析出,冷却、抽滤、干燥后称量即得产品
冷却至室温;取下双颈烧瓶,在通风橱中蒸发至有较多固体析出,冷却、抽滤、干燥后称量即得产品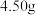 。
。_______ 。
(5)产品沿索氏提取器的管_______ (2或3)流回双颈烧瓶。
(6)已知Cr(Ⅱ)对该反应有催化作用,推断加入Zn粉发生反应的化学方程式为:_______ 。
(7)实验所用的四氢呋喃需进行无水处理,下列可以除去四氢呋喃中少量水分的试剂是_______ 。
A.金属钠 B.浓硫酸 C.具有吸水能力的分子筛
(8)产品产率为____ %(结果保留小数点后一位)[已知: 的摩尔质量为
的摩尔质量为 ;
;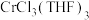 的摩尔质量为
的摩尔质量为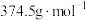 ]。
]。
 可催化烯烃加聚,制备的方法加下。
可催化烯烃加聚,制备的方法加下。已知:①
 易潮解,易升华,高温下易被氧气氧化。
易潮解,易升华,高温下易被氧气氧化。②
 气体有毒,遇水发生水解产生两种酸性气体。
气体有毒,遇水发生水解产生两种酸性气体。Ⅰ.制备无水
 :
:某化学小组用
 (沸点76.8℃)和
(沸点76.8℃)和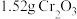 在高温下制备无水
在高温下制备无水 ,同时生成
,同时生成 气体,实验装置如图所示:
气体,实验装置如图所示: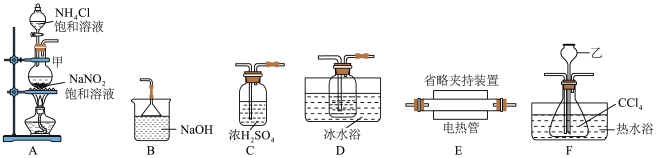
 ,实验装置合理的连接顺序为A→C→F→
,实验装置合理的连接顺序为A→C→F→(2)装置乙名称为
(3)尾气处理时发生反应的离子方程式:
Ⅱ.合成
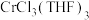 :
:①四氢呋喃(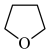 THF)为常见的有机溶剂,沸点66℃,易燃。
THF)为常见的有机溶剂,沸点66℃,易燃。
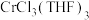 原理为:
原理为:
实验操作:按如图组装仪器,将步骤Ⅰ所得无水
 和
和 锌粉放入滤纸套筒内,双颈烧瓶中加入
锌粉放入滤纸套筒内,双颈烧瓶中加入 无水四氢呋喃(THF),通
无水四氢呋喃(THF),通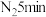 后关闭,接通冷却水,加热四氢呋喃至沸腾,在索氏提取器中发生反应,回流
后关闭,接通冷却水,加热四氢呋喃至沸腾,在索氏提取器中发生反应,回流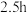 后再通入
后再通入 冷却至室温;取下双颈烧瓶,在通风橱中蒸发至有较多固体析出,冷却、抽滤、干燥后称量即得产品
冷却至室温;取下双颈烧瓶,在通风橱中蒸发至有较多固体析出,冷却、抽滤、干燥后称量即得产品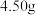 。
。
(5)产品沿索氏提取器的管
(6)已知Cr(Ⅱ)对该反应有催化作用,推断加入Zn粉发生反应的化学方程式为:
(7)实验所用的四氢呋喃需进行无水处理,下列可以除去四氢呋喃中少量水分的试剂是
A.金属钠 B.浓硫酸 C.具有吸水能力的分子筛
(8)产品产率为
 的摩尔质量为
的摩尔质量为 ;
;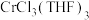 的摩尔质量为
的摩尔质量为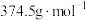 ]。
]。
您最近一年使用:0次
解题方法
3 . 用下列实验装置进行相应实验,其中装置正确且能达到实验目的的是
|
|
| A.制取NaHCO3 | B.为装有KMnO4溶液的滴定管排气泡 |
|
|
| C.煅烧石灰石 | D.制取无水MgCl2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-04-11更新
|
526次组卷
|
4卷引用:2024届内蒙古锡林郭勒盟高三第三次模拟考试理综试卷-高中化学
解题方法
4 . 镉( Cd)在合金、电池等方面具有重要应用。某铜镉渣中主要含有Cd、CdO,还含有Cu、Zn、Pb、Fe、CuO和SiO2等杂质,从铜镉渣中回收Cd的某种工艺流程如图所示。

已知:①Ksp[CaSO4] =9.1 ×10-6 Ksp[PbSO4]=1.6×10-8
②溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)将铜镉渣先“浆化”再“酸浸”的目的是_______ 。
(2)“酸浸”时,保持温度和pH均不宜过高的原因是_______ ;“压滤 ”所得滤渣I的主要成分是_______ ( 填化学式); “酸浸”后滤液中还含有微量的Pb2+,其微量存在的主要原因是_______ 。
(3)“除铁”时,加入的石灰乳调节溶液pH的范围是_______ , 若石灰乳加过量,缺陷是_______ 。
(4)将“置换”出来的海绵镉在空气中堆放进行“自然氧化” ,再用硫酸进行“酸溶”,“置换净化”处理是将残余的微量的Cu2+和Pb2+进行深度脱除,以提高阴极镉产品的纯度,“置换净化”所发生的离子反应方程式为_______ 。
(5)电极电位是表示某种离子或原子在溶液中得失电子的难易程度。在25°C下,部分电对的电极电位如表所示。
根据表中信息和已有知识可知,电对的电极电位数值越大,电对中氧化态粒子的氧化性_______ (填“越强”或“越弱”)。采用低电流条件“电积”时,阴极主要发生的电极反应是_______ 。

已知:①Ksp[CaSO4] =9.1 ×10-6 Ksp[PbSO4]=1.6×10-8
②溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
| 离子 | Zn2+ | Cd2+ | Fe2+ | Pb2+ | Cu2+ | Fe3+ |
| 开始沉淀时(c=0.01 mol · L-1)的pH | 8.2 | 7.8 | 7.5 | 6.7 | 5.2 | 2.2 |
| 完全沉淀时(c=1.0 ×10-5mol·L-1)的pH | 9.7 | 9.3 | 9.0 | 8.5 | 6.7 | 3.2 |
(1)将铜镉渣先“浆化”再“酸浸”的目的是
(2)“酸浸”时,保持温度和pH均不宜过高的原因是
(3)“除铁”时,加入的石灰乳调节溶液pH的范围是
(4)将“置换”出来的海绵镉在空气中堆放进行“自然氧化” ,再用硫酸进行“酸溶”,“置换净化”处理是将残余的微量的Cu2+和Pb2+进行深度脱除,以提高阴极镉产品的纯度,“置换净化”所发生的离子反应方程式为
(5)电极电位是表示某种离子或原子在溶液中得失电子的难易程度。在25°C下,部分电对的电极电位如表所示。
| 电对 | Fe3+/Fe2+ | Cu2+/Cu | H+/H2 | Pb2+/Pb | Cd2+/Cd | Fe2+/Fe | Zn2+/Zn | Ca2+/Ca |
| 电极电位/V | +0.771 | +0.337 | 0 | -0.126 | - 0.402 | -0.442 | -0.762 | -2. 86 |
您最近一年使用:0次
5 . 化学与社会生活密切相关,下列说法正确的是
| A.复合膨松剂中添加柠檬酸,是利用其还原性 |
| B.补铁口服液不能与维生素C一起服用 |
| C.长期施用铵态氮肥,会使土壤酸化,导致土壤板结 |
| D.“汽车限行”措施不会减轻碳排放 |
您最近一年使用:0次
2022-03-27更新
|
412次组卷
|
5卷引用:内蒙古自治区赤峰市2022届高三下学期3月份模拟考试理综化学试题
名校
6 . 某固体X,可能含有 、
、 、
、 、
、 中的一种或几种,进行如下实验:
中的一种或几种,进行如下实验:
①取一定量样品溶于水中,得到固体A和溶液B;②向A中加入足量稀盐酸,得到澄清溶液C.下列说法不正确的是
 、
、 、
、 、
、 中的一种或几种,进行如下实验:
中的一种或几种,进行如下实验:①取一定量样品溶于水中,得到固体A和溶液B;②向A中加入足量稀盐酸,得到澄清溶液C.下列说法不正确的是
| A.固体A可能溶于NaOH溶液 |
B.向溶液B中加入NaOH溶液,若出现白色沉淀,则X中必定有 和 和 |
C.溶液C不能与 溶液反应产生沉淀 溶液反应产生沉淀 |
D.向溶液C中加入KSCN溶液,若变色,则混合物X一定含 |
您最近一年使用:0次
2021-12-04更新
|
396次组卷
|
5卷引用:内蒙古自治区呼和浩特市2021-2022学年高三上学期月考调研化学试题
内蒙古自治区呼和浩特市2021-2022学年高三上学期月考调研化学试题江西省萍乡市芦溪中学2021-2022学年高三上学期第一次段考化学(理)试题(已下线)卷13 无机综合推断-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)湖北省襄阳市第五中学2022 届高三适应性考试(三)化学试题湖北省襄阳市第五中学2022届高三下学期5月适应性考试(三)化学试题
7 . 下列除杂方法不合理的是
A.除去 溶液中的 溶液中的 :加过量铜粉,过滤 :加过量铜粉,过滤 |
B.除去 固体中的 固体中的 :加热到固体质量不变 :加热到固体质量不变 |
C.除去 中混有的HCl:依次用饱和碳酸氢钠溶液、浓硫酸洗气 中混有的HCl:依次用饱和碳酸氢钠溶液、浓硫酸洗气 |
| D.除去Mg粉中混有的Al粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥 |
您最近一年使用:0次
名校
解题方法
8 . 2019年度诺贝尔化学奖奖励锂电池的发明者,锂离子电池已经彻底改变了我们的生活。如果废旧电池处理不当就会对环境造成严重污染,影响人们的健康生活。一种以废旧锂离子电池的正极材料(主要含LiCoO2、Al、C等)为原料制备CoC2O4•2H2O的流程如图1:

(1)除铝时发生反应的离子方程式为_______
(2)灼烧的主要目的是_______ ,实验室中灼烧实验用到最重要的仪器是_______
(3)还原步骤在70℃左右,LiCoO2发生反应的化学方程式为_______ ,若用盐酸代替H2SO4和H2O2,也可以达到目的,但其缺点是_______
(4)沉淀时,证明Co2+已经沉淀完全的实验操作与现象是_______
(5)已知:NH3•H2O⇌ +OH-,Kb=1.8×10-5,H2C2O4⇌H++
+OH-,Kb=1.8×10-5,H2C2O4⇌H++ ,Ka1=5.4×10-2,
,Ka1=5.4×10-2, ⇌H++
⇌H++ Ka2=5.4×10-5,则该流程中所用(NH4)2C2O4溶液的pH
Ka2=5.4×10-5,则该流程中所用(NH4)2C2O4溶液的pH_______ 7(填“>”或“<”或“=”)

(1)除铝时发生反应的离子方程式为
(2)灼烧的主要目的是
(3)还原步骤在70℃左右,LiCoO2发生反应的化学方程式为
(4)沉淀时,证明Co2+已经沉淀完全的实验操作与现象是
(5)已知:NH3•H2O⇌
 +OH-,Kb=1.8×10-5,H2C2O4⇌H++
+OH-,Kb=1.8×10-5,H2C2O4⇌H++ ,Ka1=5.4×10-2,
,Ka1=5.4×10-2, ⇌H++
⇌H++ Ka2=5.4×10-5,则该流程中所用(NH4)2C2O4溶液的pH
Ka2=5.4×10-5,则该流程中所用(NH4)2C2O4溶液的pH
您最近一年使用:0次
2021-08-19更新
|
600次组卷
|
3卷引用:内蒙古包钢第一中学2021-2022学年高三下学期一模检测(B)化学试题
内蒙古包钢第一中学2021-2022学年高三下学期一模检测(B)化学试题江苏省宿迁市沐阳如东中学2021-2022学年高三8月第一次调研(线上)化学试题(已下线)备战2022年高考化学精准检测卷【全国卷】11
9 . 以硫酸渣(含Fe2O3、SiO2等)为原料制备铁黄(FeOOH)的一种工艺流程如下:
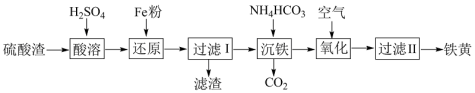
(1)“酸溶”中加快溶解的方法为_____________ (写出两种)。
(2)“还原”过程中的离子方程式为__________________________ 。
(3)滤渣中主要成分的化学式__________ ,__________
(4)①“沉铁”过程中生成Fe(OH)2的化学方程式为___________________________________ 。
②若用CaCO3“沉铁”,则生成FeCO3沉淀。当反应完成时,溶液中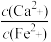 =
=_____________ 。[已知Ksp(CaCO3)=2.8×10-9,Ksp(FeCO3)=2×10-11]
(5)“氧化”时,用NaNO2浓溶液代替空气氧化Fe(OH)2浆液,能缩短氧化时间,但缺点是______________________________________ 。
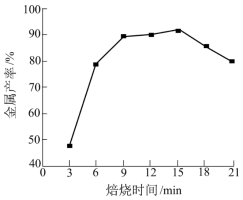
(6)焦炭还原硫酸渣炼铁能充分利用铁资源,在1225℃、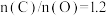 时,焙烧时间与金属产率的关系如图,时间超过15min金属产率下降的原因是
时,焙烧时间与金属产率的关系如图,时间超过15min金属产率下降的原因是__________________________ 。

(1)“酸溶”中加快溶解的方法为
(2)“还原”过程中的离子方程式为
(3)滤渣中主要成分的化学式
(4)①“沉铁”过程中生成Fe(OH)2的化学方程式为
②若用CaCO3“沉铁”,则生成FeCO3沉淀。当反应完成时,溶液中
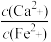 =
=(5)“氧化”时,用NaNO2浓溶液代替空气氧化Fe(OH)2浆液,能缩短氧化时间,但缺点是
(6)焦炭还原硫酸渣炼铁能充分利用铁资源,在1225℃、
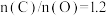 时,焙烧时间与金属产率的关系如图,时间超过15min金属产率下降的原因是
时,焙烧时间与金属产率的关系如图,时间超过15min金属产率下降的原因是
您最近一年使用:0次
2011·山东·高考真题
10 . Al、Fe、Cu都是重要的金属元素。下列说法正确的是
| A.三者对应的氧化物均为碱性氧化物 |
| B.三者的单质放置在空气中均只生成氧化物 |
| C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 |
| D.电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al |
您最近一年使用:0次
2019-01-30更新
|
334次组卷
|
14卷引用:2012届内蒙古呼伦贝尔市牙克石林业一中高三第二次模拟考试化学试卷
(已下线)2012届内蒙古呼伦贝尔市牙克石林业一中高三第二次模拟考试化学试卷2015届山东省菏泽市高三第一次模拟考试理科综合化学试卷2011年普通高等学校招生全国统一考试化学卷(山东)(已下线)2010—2011学年安徽省合肥一中、6中、168中学高二下学期期末联考化学试卷(已下线)2010—2011学年辽宁省沈阳二中高二下学期期末考试化学试卷(已下线)2012届陕西省兴平市秦岭中学高三上学期期末练习化学试卷(已下线)2012届宁夏贺兰一中高三下学期第三次月考化学试卷(已下线)2013届浙江省湖州市菱湖中学高三上学期期中考试化学试卷(已下线)2013届广东省深圳市南山区高三上学期期末考试化学试卷2015届山东省淄博七中高三上学期期中考试化学试卷2015届福建省长汀县第一中学高三上学期第四次月考化学试卷2015-2016学年河南省安阳三十六中高二6月月考化学试卷2016-2017学年河北省武邑中学高一下学期第一次月考化学试卷山西省阳高县第一中学2018届高三上学期第二次月考化学试题