1 . SOCl2(氯化亚砜)是一种重要的化工原料,是常用的氯化剂,也是制造电池的重要原料。
(1)SOCl2是一种液态化合物,沸点为78.4℃,在水中会剧烈水解。在水解得到的溶液中加入AgNO3溶液可得到白色沉淀,水解产生的气体能使品红溶液褪色。
①SOCl2分子的中心原子杂化方式为___________ 。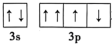 不能表示基态硫原子的价电子轨道表示式,因为违背了
不能表示基态硫原子的价电子轨道表示式,因为违背了___________ 。
②SOCl2的水解方程式为___________ 。
③AlCl3·6H2O加热时得不到AlCl3,但在加入:SOCl2并加热时可得到无水AlCl3,其原因是___________ 。
(2)SOCl2可用于制造心脏起搏器的微型电池。将等物质的量的LiCl、AlCl3溶解在SOCl2溶液中形成电解质溶液,以石墨和锂为电极材料,电池总反应为4Li+2SOCl2=4LiCl+SO2+S,硫和二氧化硫溶解在过量的氯化亚砜电解液中。该电池放电时,Li+移向___________ 极(填“正”或“负”),正极反应式为___________ 。该电池为可充电电池,充电时阴极反应式为___________ 。
(1)SOCl2是一种液态化合物,沸点为78.4℃,在水中会剧烈水解。在水解得到的溶液中加入AgNO3溶液可得到白色沉淀,水解产生的气体能使品红溶液褪色。
①SOCl2分子的中心原子杂化方式为
 不能表示基态硫原子的价电子轨道表示式,因为违背了
不能表示基态硫原子的价电子轨道表示式,因为违背了②SOCl2的水解方程式为
③AlCl3·6H2O加热时得不到AlCl3,但在加入:SOCl2并加热时可得到无水AlCl3,其原因是
(2)SOCl2可用于制造心脏起搏器的微型电池。将等物质的量的LiCl、AlCl3溶解在SOCl2溶液中形成电解质溶液,以石墨和锂为电极材料,电池总反应为4Li+2SOCl2=4LiCl+SO2+S,硫和二氧化硫溶解在过量的氯化亚砜电解液中。该电池放电时,Li+移向
您最近一年使用:0次
名校
2 . 按要求回答下列问题:
(1) 水解的离子方程式为
水解的离子方程式为_______
(2)25℃时,pH相同的醋酸和盐酸溶液分别用蒸馏水稀释至原来的m倍和n倍,若稀释后两溶液的pH仍相同,则m_______ n(填“>”“<”或“=”)
(3) 的电离常数依次为
的电离常数依次为 和
和 ,则
,则 的水解常数
的水解常数
_______ (用 和
和 的电离常数表示)
的电离常数表示)
(4)物质的量浓度相同的下列溶液:
① ②
② ③
③ ④
④ ⑤
⑤
按 由小到大排列的顺序是
由小到大排列的顺序是_______ (填序号)
(1)
 水解的离子方程式为
水解的离子方程式为(2)25℃时,pH相同的醋酸和盐酸溶液分别用蒸馏水稀释至原来的m倍和n倍,若稀释后两溶液的pH仍相同,则m
(3)
 的电离常数依次为
的电离常数依次为 和
和 ,则
,则 的水解常数
的水解常数
 和
和 的电离常数表示)
的电离常数表示)(4)物质的量浓度相同的下列溶液:
①
 ②
② ③
③ ④
④ ⑤
⑤
按
 由小到大排列的顺序是
由小到大排列的顺序是
您最近一年使用:0次
2022-12-02更新
|
159次组卷
|
2卷引用:河南省郑州外国语学校2022-2023学年高二上学期期中考试化学试题
名校
3 . 氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)图1是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图(a、b均大于0),且已知:2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-ckJ·mol-1(c>0),请写出CO将NO2还原至N2时的热化学方程式____ 。

(2)图2是实验室在三个不同条件的密闭容器中合成氨时,N2的浓度随时间的变化曲线(以a、b、c表示)。已知三个条件下起始加入浓度均为:c(N2)=0.1mol·L-1,c(H2)=0.3mol·L-1;合成氨的反应:N2(g)+3H2(g) 2NH3(g) △H<0。
2NH3(g) △H<0。

①计算在曲线a达平衡时H2的转化率为____ 。
②由图2可知,b、c各有一个条件与a不同,则c的条件改变可能是____ ;写出判断b与a条件不同的理由____ 。
(3)利用图2中c条件下合成氨(容积固定)。已知化学平衡常数K与温度(T)的关系如表:
①试确定K1的相对大小,K1____ 4.1×106(填写“>”、“=”或“<”)
②恒温恒容时,下列各项能作为判断该反应达到化学平衡状态的依据的是____ 。
A.容器内NH3的浓度保持不变 B.2v(N2)正=v(H2)逆
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)明矾[KAl(SO4)2·12H2O]可用作净水剂,是因为水解生成氢氧化铝胶体吸附水中的悬浮杂质。写出水解反应的离子方程式____
(1)图1是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图(a、b均大于0),且已知:2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-ckJ·mol-1(c>0),请写出CO将NO2还原至N2时的热化学方程式

(2)图2是实验室在三个不同条件的密闭容器中合成氨时,N2的浓度随时间的变化曲线(以a、b、c表示)。已知三个条件下起始加入浓度均为:c(N2)=0.1mol·L-1,c(H2)=0.3mol·L-1;合成氨的反应:N2(g)+3H2(g)
 2NH3(g) △H<0。
2NH3(g) △H<0。
①计算在曲线a达平衡时H2的转化率为
②由图2可知,b、c各有一个条件与a不同,则c的条件改变可能是
(3)利用图2中c条件下合成氨(容积固定)。已知化学平衡常数K与温度(T)的关系如表:
| T/(K) | 298 | 398 | 498 | …… |
| K | 4.1×106 | K1 | K2 | …… |
②恒温恒容时,下列各项能作为判断该反应达到化学平衡状态的依据的是
A.容器内NH3的浓度保持不变 B.2v(N2)正=v(H2)逆
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)明矾[KAl(SO4)2·12H2O]可用作净水剂,是因为水解生成氢氧化铝胶体吸附水中的悬浮杂质。写出水解反应的离子方程式
您最近一年使用:0次
2022-03-18更新
|
145次组卷
|
3卷引用:河南省豫北名校联盟2021-2022学年高二下学期第二次联考化学试题
4 . 水是生命的源泉、工业的血液、城市的命脉。河水是主要的饮用水源,污染物通过饮用水可宵接毒害人体,也可通过食物链和灌溉农田间接危及健康。请回答下列问题:
(1)纯水在100℃时,pH=6,该温度下1mol·L-1的NaOH溶液中,由水电离出的c(OH-)=_____ mol·L-1。
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为___________ 。
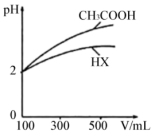
(3)体积均为100mLpH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则相同温度时,HX的电离平衡常数___________ (填“大于”或“小于”或“等于”)CH3COOH的电离平衡常数,理由是___________ 。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
①25℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三种溶液的pH由大到小的顺序为___________ 。
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为___________ 。
(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=___________ mol·L-1(填精确值)。
(1)纯水在100℃时,pH=6,该温度下1mol·L-1的NaOH溶液中,由水电离出的c(OH-)=
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为
(3)体积均为100mLpH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则相同温度时,HX的电离平衡常数

(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为
(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=
您最近一年使用:0次
2021-12-25更新
|
358次组卷
|
7卷引用:河南省洛阳市2019-2020学年高二上学期期末考试化学试题
河南省洛阳市2019-2020学年高二上学期期末考试化学试题(已下线)3.2.1 水的电离 溶液的酸碱性与pH 练习-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)山东省2021-2022学年高二12月“山东学情”联考(鲁科版)化学试题江西省赣州市信丰中学2021-2022学年高二下学期A+班段考化学试题江西省吉安市2021-2022学年高二上学期期末教学质量检测化学试题甘肃省白银市白银区大成学校2022-2023学年高二下学期开学考试(上期末)化学试题四川省江油市太白中学2023-2024学年高二下学期开学考试化学试题
5 . 请预测下列盐溶液的酸碱性,若盐能发生水解反应,请写出水解反应的离子方程式
(1)硫酸钾溶液_________________________________ ;
(2)磷酸钠溶液_________________________________ ;
(3)氯化铁溶液_________________________________ ;
(4)溴化钠溶液__________________________________ ;
(5)硫化钾溶液__________________________________
(1)硫酸钾溶液
(2)磷酸钠溶液
(3)氯化铁溶液
(4)溴化钠溶液
(5)硫化钾溶液
您最近一年使用:0次
2018-01-19更新
|
827次组卷
|
4卷引用:河南正阳县高级中学2020-2021学年高二上学期第三次素质检测化学试题
河南正阳县高级中学2020-2021学年高二上学期第三次素质检测化学试题陕西省黄陵中学2017-2018学年高二(普通班)上学期期末考试化学试题新疆吾尔自治区沙雅县第一中学2019-2020学年高二下学期期末考试化学试题(已下线)3.3.1 盐类的水解反应(基础练)-2020-2021学年高二化学十分钟同步课堂专练(苏教版选修4)
名校
6 . 用相关化学反应原理解释下列问题。
(1)请用离子方程式表示热纯碱溶液除油污原理_______ 。
(2)请解释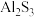 不能通过水溶液的离子反应制备,其原因是
不能通过水溶液的离子反应制备,其原因是_______ 。
(3)氯碱工业原理_______ 。
(4)难溶物ZnS作沉淀剂除去废水中 ,写出该过程的离子方程式
,写出该过程的离子方程式_______ 。
(5)将0.3mol的气态高能燃料乙硼烷( )在氧气中燃烧生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为
)在氧气中燃烧生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为_______ 。
(1)请用离子方程式表示热纯碱溶液除油污原理
(2)请解释
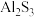 不能通过水溶液的离子反应制备,其原因是
不能通过水溶液的离子反应制备,其原因是(3)氯碱工业原理
(4)难溶物ZnS作沉淀剂除去废水中
 ,写出该过程的离子方程式
,写出该过程的离子方程式(5)将0.3mol的气态高能燃料乙硼烷(
 )在氧气中燃烧生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为
)在氧气中燃烧生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为
您最近一年使用:0次
7 . 请按要求用化学用语作答。
(1)已知 在氧气中燃烧完全转化为S单质放出
在氧气中燃烧完全转化为S单质放出 热量,完全转化为
热量,完全转化为 放出
放出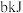 热量,写出表示
热量,写出表示 燃烧热的热化学方程式
燃烧热的热化学方程式_______ 。
(2)明矾[化学式为 ]可以作净水剂的原因是
]可以作净水剂的原因是_______ (用离子方程式表示)。
(3)已知 是一种一元酸,写出它的正盐水解的离子方程式
是一种一元酸,写出它的正盐水解的离子方程式_______ 。
(4) 溶液可通过调节
溶液可通过调节 改变颜色,原因是
改变颜色,原因是_______ (用离子方程式表示)。
(5)将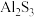 固体放入水中,写出该反应的化学方程式
固体放入水中,写出该反应的化学方程式_______ 。
(1)已知
 在氧气中燃烧完全转化为S单质放出
在氧气中燃烧完全转化为S单质放出 热量,完全转化为
热量,完全转化为 放出
放出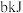 热量,写出表示
热量,写出表示 燃烧热的热化学方程式
燃烧热的热化学方程式(2)明矾[化学式为
 ]可以作净水剂的原因是
]可以作净水剂的原因是(3)已知
 是一种一元酸,写出它的正盐水解的离子方程式
是一种一元酸,写出它的正盐水解的离子方程式(4)
 溶液可通过调节
溶液可通过调节 改变颜色,原因是
改变颜色,原因是(5)将
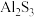 固体放入水中,写出该反应的化学方程式
固体放入水中,写出该反应的化学方程式
您最近一年使用:0次
8 . “ 还原法”制备高纯度氢碘酸和亚磷酸钠
还原法”制备高纯度氢碘酸和亚磷酸钠 的工业流程如图。
的工业流程如图。

已知:ⅰ. 为一元弱酸
为一元弱酸
ⅱ. 为二元酸,25℃时其电离常数:
为二元酸,25℃时其电离常数: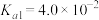 ,
,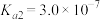
ⅲ.25℃时: ,
,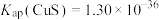
回答下列问题:
(1) 属于
属于______ (填“正盐”或“酸式盐”)。
(2)“合成”过程,主要氧化产物为 ,相应的化学方程式为
,相应的化学方程式为______ 。
(3)“除铜”过程发生的反应为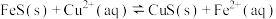 ,经过计算可得该反应的平衡常数
,经过计算可得该反应的平衡常数
______ 。
(4)常温下 的
的
______ 7(填“>”、“=”或“<”)。
(5)常温下 溶液呈碱性的原因为(用离子方程式表示)
溶液呈碱性的原因为(用离子方程式表示)______ 。
 还原法”制备高纯度氢碘酸和亚磷酸钠
还原法”制备高纯度氢碘酸和亚磷酸钠 的工业流程如图。
的工业流程如图。
已知:ⅰ.
 为一元弱酸
为一元弱酸ⅱ.
 为二元酸,25℃时其电离常数:
为二元酸,25℃时其电离常数: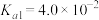 ,
,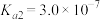
ⅲ.25℃时:
 ,
,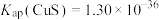
回答下列问题:
(1)
 属于
属于(2)“合成”过程,主要氧化产物为
 ,相应的化学方程式为
,相应的化学方程式为(3)“除铜”过程发生的反应为
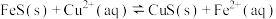 ,经过计算可得该反应的平衡常数
,经过计算可得该反应的平衡常数
(4)常温下
 的
的
(5)常温下
 溶液呈碱性的原因为(用离子方程式表示)
溶液呈碱性的原因为(用离子方程式表示)
您最近一年使用:0次
名校
解题方法
9 . 醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐。[已知:25℃,Ka(CH3COOH)=1.69×10-5]。请回答下列问题:
(1)写出醋酸钠溶液中存在的平衡(离子方程式):___________ 。
(2)常温时,pH=3的醋酸和pH=11的NaOH溶液等体积混合后,溶液中c(Na+)___________ c(CH3COO-)(填“>”“<”或“=”),该溶液中电荷守恒表达式为___________ 。
(3)常温时,将mmol·L-1的醋酸和nmol·L-1的NaOH溶液等体积混合后,所得溶液的pH=7,则m与n的大小关系是m________ n,醋酸溶液中c(H+)_________ NaOH溶液中c(OH-)(填“>”“<”或“=”)。
(4)某小组研究25℃下CH3COOH电离平衡的影响因素。
提出假设稀释CH3COOH溶液或改变CH3COO-浓度,CH3COOH电离平衡会发生移动。
设计方案并完成实验用浓度均为0.1mol·L-1的CH3COOH和CH3COONa溶液,按下表配制总体积相同的系列溶液;测定pH,记录数据。
①根据表中信息,补充数据:a=___________ ,b=___________ 。
②由实验Ⅰ和Ⅱ可知,稀释CH3COOH溶液,电离平衡___________ (填“正”或“逆”)向移动;结合表中数据,给出判断理由:___________ 。
③由实验Ⅱ~Ⅷ可知,增大CH3COO-浓度,CH3COOH电离平衡逆向移动。
实验结论假设成立。
(1)写出醋酸钠溶液中存在的平衡(离子方程式):
(2)常温时,pH=3的醋酸和pH=11的NaOH溶液等体积混合后,溶液中c(Na+)
(3)常温时,将mmol·L-1的醋酸和nmol·L-1的NaOH溶液等体积混合后,所得溶液的pH=7,则m与n的大小关系是m
(4)某小组研究25℃下CH3COOH电离平衡的影响因素。
提出假设稀释CH3COOH溶液或改变CH3COO-浓度,CH3COOH电离平衡会发生移动。
设计方案并完成实验用浓度均为0.1mol·L-1的CH3COOH和CH3COONa溶液,按下表配制总体积相同的系列溶液;测定pH,记录数据。
| 序号 | V(CH3COOH)/mL | V(CH3COONa)/mL | V(H2O)/mL | n(CH3COONa)∶n(CH3COOH) | pH |
| Ⅰ | 40.00 | / | / | 0 | 2.86 |
| Ⅱ | 4.00 | / | 36.00 | 0 | 3.36 |
| … | |||||
| Ⅶ | 4.00 | a | b | 3∶4 | 4.53 |
| Ⅷ | 4.00 | 4.00 | 32.00 | 1∶1 | 4.65 |
②由实验Ⅰ和Ⅱ可知,稀释CH3COOH溶液,电离平衡
③由实验Ⅱ~Ⅷ可知,增大CH3COO-浓度,CH3COOH电离平衡逆向移动。
实验结论假设成立。
您最近一年使用:0次
名校
10 . Ⅰ.NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
(1)NaClO溶液的pH>7,用离子方程式表示原因___ 。
(2)某小组同学把饱和的NaClO溶液和饱和的KAl(SO4)2溶液混合反应,发现产生大量的白色胶状沉淀,同时生成一种有漂白、杀菌作用的物质。反应的离子方程式是___ 。
(3)已知在常温下测得浓度均为0.1mol•L-1的下列5种溶液的pH:
则下列离子CH3COO-,HCO ,CO
,CO ,ClO-,CN-结合质子(H+)的能力最强的是
,ClO-,CN-结合质子(H+)的能力最强的是___ 。
Ⅱ.请回答下列问题(注意:溶液混合时,均忽略溶液体积变化):
(4)25℃时,pH=2的盐酸溶液与pH=4的H2SO4溶液等体积混合,求混合后的pH=__ 。
(5)25℃时,将pH=3的H2SO4溶液和pH=12的NaOH溶液混合,充分混合后所得溶液的pH=10,则H2SO4溶液与NaOH溶液的体积比为__ 。
(6)室温下pH=9的NaOH溶液和pH=9的CH3COONa溶液,设由水电离产生的OH-的物质的量浓度分别为A和B,则 等于
等于__ 。
Ⅲ.25℃时,现有浓度均为0.1mol.L-1的下列溶液:①盐酸,②醋酸,③硫酸。请回答下列问题:
(7)等浓度,等体积的①、②、③三种溶液,用等物质的量浓度的NaOH溶液恰好完全中和时,消耗NaOH溶液的体积由大到小顺序为__ 。
(8)等体积,等pH①、②、③三种溶液,分别加入形状大小相同的镁片,开始产生气泡的速率由快到慢的关系为__ 。
(1)NaClO溶液的pH>7,用离子方程式表示原因
(2)某小组同学把饱和的NaClO溶液和饱和的KAl(SO4)2溶液混合反应,发现产生大量的白色胶状沉淀,同时生成一种有漂白、杀菌作用的物质。反应的离子方程式是
(3)已知在常温下测得浓度均为0.1mol•L-1的下列5种溶液的pH:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
则下列离子CH3COO-,HCO
 ,CO
,CO ,ClO-,CN-结合质子(H+)的能力最强的是
,ClO-,CN-结合质子(H+)的能力最强的是Ⅱ.请回答下列问题(注意:溶液混合时,均忽略溶液体积变化):
(4)25℃时,pH=2的盐酸溶液与pH=4的H2SO4溶液等体积混合,求混合后的pH=
(5)25℃时,将pH=3的H2SO4溶液和pH=12的NaOH溶液混合,充分混合后所得溶液的pH=10,则H2SO4溶液与NaOH溶液的体积比为
(6)室温下pH=9的NaOH溶液和pH=9的CH3COONa溶液,设由水电离产生的OH-的物质的量浓度分别为A和B,则
 等于
等于Ⅲ.25℃时,现有浓度均为0.1mol.L-1的下列溶液:①盐酸,②醋酸,③硫酸。请回答下列问题:
(7)等浓度,等体积的①、②、③三种溶液,用等物质的量浓度的NaOH溶液恰好完全中和时,消耗NaOH溶液的体积由大到小顺序为
(8)等体积,等pH①、②、③三种溶液,分别加入形状大小相同的镁片,开始产生气泡的速率由快到慢的关系为
您最近一年使用:0次
2021-12-04更新
|
192次组卷
|
2卷引用:河南省温县第一高级中学2021-2022学年高二上学期1月月考化学试题



