解题方法
1 . 三硫代碳酸钠(Na2CS3)是强碱弱酸盐,可用于矿石浮选,一般情况下Na2CS3都是以溶液形式存在。某化学兴趣小组利用下图装置测定其溶液的浓度,实验步骤如下:
I.取100.0mL Na2CS3溶液置于仪器M中,打开K,通入一段时间氮气;
II.关闭K,打开分液漏斗活塞,滴入足量2.0mol·L-1稀H2SO4,关闭活塞;
III.反应结束后,再打开K,通入一段时间的热氮气;
IV.将B中混合物进行过滤、洗涤、干燥、称量,得到14.4g固体。
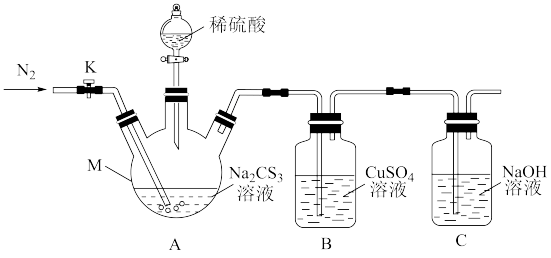
已知:Na2CS3+H2SO4=Na2SO4+CS2+H2S↑。CS2和H2S均有毒,且CS2不溶于水,沸点46℃,与CO2某些性质相似。
回答下列问题:
(1)Na2CS3溶液遇酚酞试液变红,原因是___________ (用离子方程式表示)。
(2)仪器M的名称是___________ ;反应开始前通入氮气的目的是___________ 。
(3)B中发生反应的离子方程式为___________ 。
(4)装置C的作用是___________ 。
(5)根据实验数据计算,Na2CS3溶液的物质的量浓度为___________ 。
(6)反应结束后通入热氮气的目的是___________ 。
I.取100.0mL Na2CS3溶液置于仪器M中,打开K,通入一段时间氮气;
II.关闭K,打开分液漏斗活塞,滴入足量2.0mol·L-1稀H2SO4,关闭活塞;
III.反应结束后,再打开K,通入一段时间的热氮气;
IV.将B中混合物进行过滤、洗涤、干燥、称量,得到14.4g固体。

已知:Na2CS3+H2SO4=Na2SO4+CS2+H2S↑。CS2和H2S均有毒,且CS2不溶于水,沸点46℃,与CO2某些性质相似。
回答下列问题:
(1)Na2CS3溶液遇酚酞试液变红,原因是
(2)仪器M的名称是
(3)B中发生反应的离子方程式为
(4)装置C的作用是
(5)根据实验数据计算,Na2CS3溶液的物质的量浓度为
(6)反应结束后通入热氮气的目的是
您最近一年使用:0次
2 . 已知:25℃时, 、
、 、
、 。
。

(1)常温下,将pH和体积均相同的 和
和 溶液分别稀释,溶液pH随加水体积的变化如图:
溶液分别稀释,溶液pH随加水体积的变化如图:
①曲线I代表___________ 溶液(填“ ”或“
”或“ ”)。
”)。
②a、b两点对应的溶液中,水的电离程度a___________ b(填“>”“<”或“=”)。
③向上述 溶液和
溶液和 溶液分别滴加等浓度的NaOH溶液,当恰好中和时,消耗NaOH溶液体积分别为
溶液分别滴加等浓度的NaOH溶液,当恰好中和时,消耗NaOH溶液体积分别为 和
和 ,则
,则
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
④酸度(AG)也可表示溶液的酸碱性,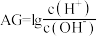 。常温下,pH=2的硝酸溶液AG=
。常温下,pH=2的硝酸溶液AG=___________ 。
(2)25℃时,往 溶液中加入NaOH溶液。
溶液中加入NaOH溶液。
①当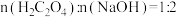 ,生成
,生成 ,
, 水解的离子方程式为
水解的离子方程式为___________ 。
②当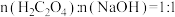 ,溶液显
,溶液显___________ 性(填“酸”、“碱”或“中”),
③等浓度等体积的 、
、 混合,溶液中
混合,溶液中
___________ 。
 、
、 、
、 。
。
(1)常温下,将pH和体积均相同的
 和
和 溶液分别稀释,溶液pH随加水体积的变化如图:
溶液分别稀释,溶液pH随加水体积的变化如图:①曲线I代表
 ”或“
”或“ ”)。
”)。②a、b两点对应的溶液中,水的电离程度a
③向上述
 溶液和
溶液和 溶液分别滴加等浓度的NaOH溶液,当恰好中和时,消耗NaOH溶液体积分别为
溶液分别滴加等浓度的NaOH溶液,当恰好中和时,消耗NaOH溶液体积分别为 和
和 ,则
,则
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。④酸度(AG)也可表示溶液的酸碱性,
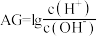 。常温下,pH=2的硝酸溶液AG=
。常温下,pH=2的硝酸溶液AG=(2)25℃时,往
 溶液中加入NaOH溶液。
溶液中加入NaOH溶液。①当
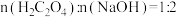 ,生成
,生成 ,
, 水解的离子方程式为
水解的离子方程式为②当
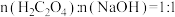 ,溶液显
,溶液显③等浓度等体积的
 、
、 混合,溶液中
混合,溶液中
您最近一年使用:0次
名校
3 . 硼、镁及其化合物在工农业生产中应用广泛。已知:硼镁矿主要成分为 ,硼砂的化学式为
,硼砂的化学式为 ,利用硼镁矿制取金属镁及粗硼的工艺流程如图,请回答下列有关问题:
,利用硼镁矿制取金属镁及粗硼的工艺流程如图,请回答下列有关问题:
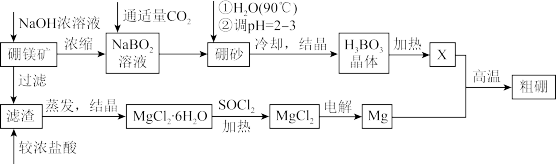
(1)滤渣的主要成分为___________ ,X为 晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为
晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为___________ 。
(2) 是一种一元弱酸,也可写作
是一种一元弱酸,也可写作 ,它与水作用时结合水电离的
,它与水作用时结合水电离的 而呈酸性,这一变化的离子方程式为
而呈酸性,这一变化的离子方程式为___________ 。以硼酸为原料可制得硼氢化钠( ),它是有机合成中的重要还原剂,其电子式为
),它是有机合成中的重要还原剂,其电子式为___________ 。
(3)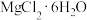 在
在 氛围中加热的化学方程式为
氛围中加热的化学方程式为___________ 。
(4)制得的粗硼在一定条件下可生成 ,
, 加热分解可以得到纯净的单质硼。现将
加热分解可以得到纯净的单质硼。现将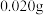 粗硼制成的
粗硼制成的 完全分解,生成的
完全分解,生成的 用
用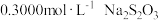 (
( 为弱酸)溶液滴定至终点,消耗
为弱酸)溶液滴定至终点,消耗 溶液
溶液 。该粗硼样品的纯度为
。该粗硼样品的纯度为___________ (提示: )。
)。
 ,硼砂的化学式为
,硼砂的化学式为 ,利用硼镁矿制取金属镁及粗硼的工艺流程如图,请回答下列有关问题:
,利用硼镁矿制取金属镁及粗硼的工艺流程如图,请回答下列有关问题:
(1)滤渣的主要成分为
 晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为
晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为(2)
 是一种一元弱酸,也可写作
是一种一元弱酸,也可写作 ,它与水作用时结合水电离的
,它与水作用时结合水电离的 而呈酸性,这一变化的离子方程式为
而呈酸性,这一变化的离子方程式为 ),它是有机合成中的重要还原剂,其电子式为
),它是有机合成中的重要还原剂,其电子式为(3)
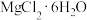 在
在 氛围中加热的化学方程式为
氛围中加热的化学方程式为(4)制得的粗硼在一定条件下可生成
 ,
, 加热分解可以得到纯净的单质硼。现将
加热分解可以得到纯净的单质硼。现将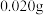 粗硼制成的
粗硼制成的 完全分解,生成的
完全分解,生成的 用
用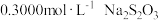 (
( 为弱酸)溶液滴定至终点,消耗
为弱酸)溶液滴定至终点,消耗 溶液
溶液 。该粗硼样品的纯度为
。该粗硼样品的纯度为 )。
)。
您最近一年使用:0次
2022-09-12更新
|
231次组卷
|
3卷引用:河南省洛阳市第一高级中学2022~2023学年高三上学期9月月考化学试题
名校
4 . 研究碳、氮、硫等元素化合物的性质或转化对建设生态文明、美丽中国具有重要意义。
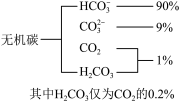
(1)海水中无机碳的存在形式及分布如图所示,用离子方程式表示海水呈弱碱性的主要原因______________________ 。已知春季海水pH=8.1,预测冬季海水碱性将会_______ (填“增强”或“减弱”),理由是_________________ 。
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)===CH3OH(g) ΔH<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是________ (填字母)。
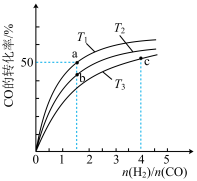
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.c点状态下再通入1molCO和4molH2,新平衡中H2的体积分数增大
D.a点状态下再通入0.5molCO和0.5molCH3OH,平衡不移动
(3)NO加速臭氧层被破坏,其反应过程如下图所示:
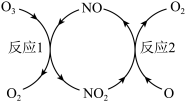
①NO的作用是_________________ 。
②已知:O3(g)+O(g)===2O2(g) ΔH=-143kJ·mol-1
反应1:O3(g)+NO(g)===NO2(g)+O2(g) ΔH1=-200.2kJ·mol-1。
反应2:热化学方程式为____________________________ 。
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-759.8kJ·mol -1,反应达到平衡时,N的体积分数随n(CO)n(NO)的变化曲线如下图。
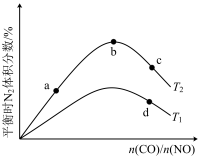
①b点时,平衡体系中C、N原子个数之比接近________ 。
②a、b、c三点CO的转化率从小到大的顺序为________ ;b、c、d三点的平衡常数从大到小的顺序为__________ 。
③若n(CO)n(NO)=0.8,反应达平衡时,N的体积分数为20%,则NO的转化率为_____ 。

(1)海水中无机碳的存在形式及分布如图所示,用离子方程式表示海水呈弱碱性的主要原因
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)===CH3OH(g) ΔH<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是

A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.c点状态下再通入1molCO和4molH2,新平衡中H2的体积分数增大
D.a点状态下再通入0.5molCO和0.5molCH3OH,平衡不移动
(3)NO加速臭氧层被破坏,其反应过程如下图所示:

①NO的作用是
②已知:O3(g)+O(g)===2O2(g) ΔH=-143kJ·mol-1
反应1:O3(g)+NO(g)===NO2(g)+O2(g) ΔH1=-200.2kJ·mol-1。
反应2:热化学方程式为
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-759.8kJ·mol -1,反应达到平衡时,N的体积分数随n(CO)n(NO)的变化曲线如下图。

①b点时,平衡体系中C、N原子个数之比接近
②a、b、c三点CO的转化率从小到大的顺序为
③若n(CO)n(NO)=0.8,反应达平衡时,N的体积分数为20%,则NO的转化率为
您最近一年使用:0次
2020-03-05更新
|
448次组卷
|
2卷引用:河南省驻马店市2020年3月高三模拟测试理综化学试题
名校
5 . 回答下列问题:
(1)砷酸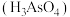 分步电离的平衡常数(25℃)为
分步电离的平衡常数(25℃)为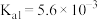 ,
,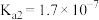 ,
,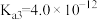 。
。 第一步水解的离子方程式为
第一步水解的离子方程式为___________ ,该步水解的平衡常数(25℃)为___________ 。
(2)以镁铝复合氧化物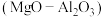 为载体的负载型镍铜双金属催化剂
为载体的负载型镍铜双金属催化剂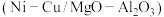 是一种新型高效加氢或脱氢催化剂,其制备流程如下:
是一种新型高效加氢或脱氢催化剂,其制备流程如下:
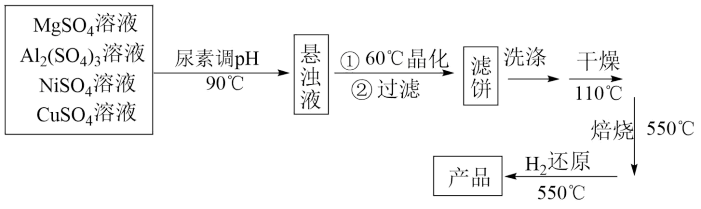
已知:常温下,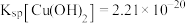 ,
,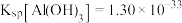 。回答下列问题:
。回答下列问题:
①在加热条件下,尿素 在水中发生水解反应,放出
在水中发生水解反应,放出___________ 和___________ 两种气体(写化学式)。
②“晶化”过程中,需保持恒温60℃,可采用的加热方式为___________
③“洗涤”过程中,检验滤饼是否洗净的方法是___________ 。
④常温下,若“悬浊液”中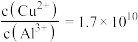 ,则溶液的
,则溶液的
___________ 。
(3)请写出泡沫灭火器灭火的原理___________ (用离子方程式表示)
(1)砷酸
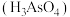 分步电离的平衡常数(25℃)为
分步电离的平衡常数(25℃)为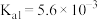 ,
,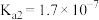 ,
,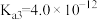 。
。 第一步水解的离子方程式为
第一步水解的离子方程式为(2)以镁铝复合氧化物
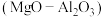 为载体的负载型镍铜双金属催化剂
为载体的负载型镍铜双金属催化剂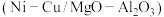 是一种新型高效加氢或脱氢催化剂,其制备流程如下:
是一种新型高效加氢或脱氢催化剂,其制备流程如下:
已知:常温下,
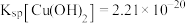 ,
,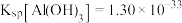 。回答下列问题:
。回答下列问题:①在加热条件下,尿素
 在水中发生水解反应,放出
在水中发生水解反应,放出②“晶化”过程中,需保持恒温60℃,可采用的加热方式为
③“洗涤”过程中,检验滤饼是否洗净的方法是
④常温下,若“悬浊液”中
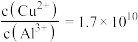 ,则溶液的
,则溶液的
(3)请写出泡沫灭火器灭火的原理
您最近一年使用:0次
名校
6 . SO2、Na2S2O3、Na2S、Na2SO3等含化合物在工业上有广泛的用途。
(1)硫原子核外电子排布式___________ ,钠离子的核外有___________ 种不同能级的电子。
(2)SO2分子构型为“折线型”,则SO2是___________ (选填“极性”、“非极性”)分子,从结构的角度解释原因:___________ ;其在水中的溶解度比氯气___________ (选填“大”、“小”、“一样”)。
(3)棉织物用氯气漂白后,加入Na2S2O3除去余氯时,发生如下反应: ____S2O + ____ Cl2 +____H2O → _______SO
+ ____ Cl2 +____H2O → _______SO + _____Cl- + _____H+;配平该反应方程式
+ _____Cl- + _____H+;配平该反应方程式______ 。
(4)Na2S 又称臭碱、硫化碱,用离子方程式说明 Na2S 溶液呈碱性的原因:___________ 。
(5)如图是Na2SO3溶液中各离子浓度的相对大小关系示意图。其中,②是___________ (填微粒符号)。在Na2SO3溶液中各微粒浓度等式关系正确的是___________ 。

a. [Na+] = [SO ]+ 2[HSO
]+ 2[HSO ] + 2[H2SO3]
] + 2[H2SO3]
b. [Na+] + [H+] = 2[SO ] + [HSO
] + [HSO ] +[OH-]
] +[OH-]
c. [OH-] = [HSO ] + [H+] + [H2SO3]
] + [H+] + [H2SO3]
(1)硫原子核外电子排布式
(2)SO2分子构型为“折线型”,则SO2是
(3)棉织物用氯气漂白后,加入Na2S2O3除去余氯时,发生如下反应: ____S2O
 + ____ Cl2 +____H2O → _______SO
+ ____ Cl2 +____H2O → _______SO + _____Cl- + _____H+;配平该反应方程式
+ _____Cl- + _____H+;配平该反应方程式(4)Na2S 又称臭碱、硫化碱,用离子方程式说明 Na2S 溶液呈碱性的原因:
(5)如图是Na2SO3溶液中各离子浓度的相对大小关系示意图。其中,②是

a. [Na+] = [SO
 ]+ 2[HSO
]+ 2[HSO ] + 2[H2SO3]
] + 2[H2SO3]b. [Na+] + [H+] = 2[SO
 ] + [HSO
] + [HSO ] +[OH-]
] +[OH-]c. [OH-] = [HSO
 ] + [H+] + [H2SO3]
] + [H+] + [H2SO3]
您最近一年使用:0次
2022-09-29更新
|
140次组卷
|
2卷引用:河南省周口市周口恒大中学2023-2024学年高二上学期1月期末化学试题
名校
7 . 镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,如图是从该矿渣中回收NiSO4的工艺路线:

已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是____________
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为__________ ,“浸渣”的成分除Fe2O3、FeO(OH)外还含有_______ (填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+;除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为_________ 。
(4)“浸出液”中c(Ca2+)=1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-)=__________ mol·L-1。[已知Ksp(CaF2)=4.0×10-11]
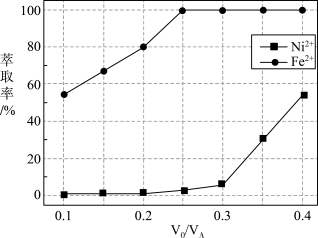
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+萃取率的影响如图所示,V0/VA的最佳取值是____ 。

已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+;除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为
(4)“浸出液”中c(Ca2+)=1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-)=
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+萃取率的影响如图所示,V0/VA的最佳取值是

您最近一年使用:0次
解题方法
8 . Q、W、X、Y、Z 是位于不同主族的五种短周期元素,其原子序数依次增大。
①W 的氢化物与 W 最高价氧化物对应水化物反应生成化合物甲。
②X、Y、Z 的最高价氧化物对应水化物之间两两反应均可生成盐和水。
③常温下,Q 的最高价气态氧化物与化合物 X2O2 发生反应生成盐乙。
请回答下列各题:
(1)甲的水溶液呈酸性,用离子方程式表示其原因____________________________________________________________________________ 。
(2)③中反应的化学方程式为________________________________________________________________________________________________ 。
(3)已知:ZO3n-+M2++H+→Z-+M4+ + H2O(M 为金属元素,方程式未配平)由上述信息可推测 Z 在周期表中位置为________________________________________________________________________________________________ 。
(4)Y 形成的难溶半导体材料 CuYO2 可溶于稀硝酸,同时生成 NO。写出此反应的离子方秳式_____________________________ 。
①W 的氢化物与 W 最高价氧化物对应水化物反应生成化合物甲。
②X、Y、Z 的最高价氧化物对应水化物之间两两反应均可生成盐和水。
③常温下,Q 的最高价气态氧化物与化合物 X2O2 发生反应生成盐乙。
请回答下列各题:
(1)甲的水溶液呈酸性,用离子方程式表示其原因
(2)③中反应的化学方程式为
(3)已知:ZO3n-+M2++H+→Z-+M4+ + H2O(M 为金属元素,方程式未配平)由上述信息可推测 Z 在周期表中位置为
(4)Y 形成的难溶半导体材料 CuYO2 可溶于稀硝酸,同时生成 NO。写出此反应的离子方秳式
您最近一年使用:0次
名校
9 . 从粉煤灰(含SiO2、CaO、MgO、GeO)中提取锗的一种实验流程如图。回答下列问题:

(1)“浸出”时,NaClO3被GeO还原为NaCl,则GeO被浸出的离子方程式为____ ;浸渣的成分有MgF2、CaF2、SiO2和____ (填化学式);反应器适宜的材质是____ (填标号)。
A.不锈钢 B.陶瓷 C.聚四氟乙烯 D.铝合金
(2)“沉锗”得到的滤液中主要阳离子有H+、____ 。
(3)“焙烧”时,1molGe(C34H27O22)4完全转化为GeO2至少消耗____ molO2。
(4)“水解”时发生反应的化学方程式为____ 。

(1)“浸出”时,NaClO3被GeO还原为NaCl,则GeO被浸出的离子方程式为
A.不锈钢 B.陶瓷 C.聚四氟乙烯 D.铝合金
(2)“沉锗”得到的滤液中主要阳离子有H+、
(3)“焙烧”时,1molGe(C34H27O22)4完全转化为GeO2至少消耗
(4)“水解”时发生反应的化学方程式为
您最近一年使用:0次
2022-06-18更新
|
44次组卷
|
2卷引用:河南省安阳市2021-2022学年高二下学期阶段性测试(五)化学试题
解题方法
10 . 回答下列问题:
(1)①取20 mL pH=3的CH3COOH溶液,加入0.2 mol·L-1的氨水,测得溶液导电性变化如图1,则加入氨水前CH3COOH的电离度(分子电离的百分数)为_______ ,加入0~10 mL的氨水导电能力增强的原因_______ 。

②将醋酸铵固体溶于水,配成0.1 mol·L-1溶液,请写出醋酸铵水解的离子方程式_______ 。
(2)在25℃时,碳酸钙在水中的沉淀溶解平衡曲线如图2所示,已知25℃时硫酸钙的Ksp=9.1×10-6。

①通过蒸发,可使稀溶液由_______ 点变化到_______ 点。
②在25℃时,反应CaSO4(s)+ (aq)⇌CaCO3(s)+
(aq)⇌CaCO3(s)+ (aq)的平衡常数K
(aq)的平衡常数K_______
(3)某带盐桥的原电池构造如图3所示。

该原电池工作时,银电极的电极反应式为_______ ,当外电路中每通过0.2 mol电子,铜电极的质量减小_______ g。
(1)①取20 mL pH=3的CH3COOH溶液,加入0.2 mol·L-1的氨水,测得溶液导电性变化如图1,则加入氨水前CH3COOH的电离度(分子电离的百分数)为

②将醋酸铵固体溶于水,配成0.1 mol·L-1溶液,请写出醋酸铵水解的离子方程式
(2)在25℃时,碳酸钙在水中的沉淀溶解平衡曲线如图2所示,已知25℃时硫酸钙的Ksp=9.1×10-6。

①通过蒸发,可使稀溶液由
②在25℃时,反应CaSO4(s)+
 (aq)⇌CaCO3(s)+
(aq)⇌CaCO3(s)+ (aq)的平衡常数K
(aq)的平衡常数K(3)某带盐桥的原电池构造如图3所示。

该原电池工作时,银电极的电极反应式为
您最近一年使用:0次



