醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐。[已知:25℃,Ka(CH3COOH)=1.69×10-5]。请回答下列问题:
(1)写出醋酸钠溶液中存在的平衡(离子方程式):___________ 。
(2)常温时,pH=3的醋酸和pH=11的NaOH溶液等体积混合后,溶液中c(Na+)___________ c(CH3COO-)(填“>”“<”或“=”),该溶液中电荷守恒表达式为___________ 。
(3)常温时,将mmol·L-1的醋酸和nmol·L-1的NaOH溶液等体积混合后,所得溶液的pH=7,则m与n的大小关系是m________ n,醋酸溶液中c(H+)_________ NaOH溶液中c(OH-)(填“>”“<”或“=”)。
(4)某小组研究25℃下CH3COOH电离平衡的影响因素。
提出假设稀释CH3COOH溶液或改变CH3COO-浓度,CH3COOH电离平衡会发生移动。
设计方案并完成实验用浓度均为0.1mol·L-1的CH3COOH和CH3COONa溶液,按下表配制总体积相同的系列溶液;测定pH,记录数据。
①根据表中信息,补充数据:a=___________ ,b=___________ 。
②由实验Ⅰ和Ⅱ可知,稀释CH3COOH溶液,电离平衡___________ (填“正”或“逆”)向移动;结合表中数据,给出判断理由:___________ 。
③由实验Ⅱ~Ⅷ可知,增大CH3COO-浓度,CH3COOH电离平衡逆向移动。
实验结论假设成立。
(1)写出醋酸钠溶液中存在的平衡(离子方程式):
(2)常温时,pH=3的醋酸和pH=11的NaOH溶液等体积混合后,溶液中c(Na+)
(3)常温时,将mmol·L-1的醋酸和nmol·L-1的NaOH溶液等体积混合后,所得溶液的pH=7,则m与n的大小关系是m
(4)某小组研究25℃下CH3COOH电离平衡的影响因素。
提出假设稀释CH3COOH溶液或改变CH3COO-浓度,CH3COOH电离平衡会发生移动。
设计方案并完成实验用浓度均为0.1mol·L-1的CH3COOH和CH3COONa溶液,按下表配制总体积相同的系列溶液;测定pH,记录数据。
| 序号 | V(CH3COOH)/mL | V(CH3COONa)/mL | V(H2O)/mL | n(CH3COONa)∶n(CH3COOH) | pH |
| Ⅰ | 40.00 | / | / | 0 | 2.86 |
| Ⅱ | 4.00 | / | 36.00 | 0 | 3.36 |
| … | |||||
| Ⅶ | 4.00 | a | b | 3∶4 | 4.53 |
| Ⅷ | 4.00 | 4.00 | 32.00 | 1∶1 | 4.65 |
②由实验Ⅰ和Ⅱ可知,稀释CH3COOH溶液,电离平衡
③由实验Ⅱ~Ⅷ可知,增大CH3COO-浓度,CH3COOH电离平衡逆向移动。
实验结论假设成立。
更新时间:2023-10-04 09:50:41
|
相似题推荐
填空题
|
较易
(0.85)
【推荐1】现有浓度均为0.01 mol/L的盐酸、硫酸、醋酸三种溶液,回答下列问题:
(1)分别用以上三种酸中和一定量(且等量)的NaOH溶液生成正盐,若需要酸的体积分别为V1、V2、 V3,其大小关系为______________ 。
(2)分别与Zn反应,开始时生成H2的速率为v1、v2、v3,其大小关系为_____________ 。
(3)将以上三种酸溶液稀释100倍后,pH分别变成a、b、c,其大小关系为__________ 。
(4)将上述盐酸稀释106倍后,c(H+):c(Cl-)=__________ 。
(5)常温下,某浓度的盐酸和NaOH溶液的pH之和为16,当它们按一定体积比混合时, 溶液的pH恰好等于7,则盐酸与氢氧化钠溶液的体积比是______________ 。
(1)分别用以上三种酸中和一定量(且等量)的NaOH溶液生成正盐,若需要酸的体积分别为V1、V2、 V3,其大小关系为
(2)分别与Zn反应,开始时生成H2的速率为v1、v2、v3,其大小关系为
(3)将以上三种酸溶液稀释100倍后,pH分别变成a、b、c,其大小关系为
(4)将上述盐酸稀释106倍后,c(H+):c(Cl-)=
(5)常温下,某浓度的盐酸和NaOH溶液的pH之和为16,当它们按一定体积比混合时, 溶液的pH恰好等于7,则盐酸与氢氧化钠溶液的体积比是
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】室温下有5种稀溶液:①HCl、②H2SO4、③CH3COOH、④氨水、⑤NaOH,回答下列问题:
(1)若溶液①②③④⑤浓度均为0.01mol/L,pH由大到小的顺序是___________ 。(用序号填写,下同)
(2)中和等体积、pH相同的①②③溶液消耗NaOH最多的是___________ 。
(3)pH相同的④⑤溶液,则溶液的离子总浓度④___________ ⑤(填“>,<或=”)。
(4)常温下,pH=3的②溶液中水电离出的 ___________mol/L。
___________mol/L。
(1)若溶液①②③④⑤浓度均为0.01mol/L,pH由大到小的顺序是
(2)中和等体积、pH相同的①②③溶液消耗NaOH最多的是
(3)pH相同的④⑤溶液,则溶液的离子总浓度④
(4)常温下,pH=3的②溶液中水电离出的
 ___________mol/L。
___________mol/L。A.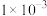 | B.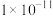 | C.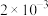 | D. |
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】按要求回答下列问题:
(1)已知下列物质电离平衡常数
①次氯酸的电离方程式为___________ 。
②物质的量浓度相同的HF、CH3COOH、H2CO3、HClO中,酸性由小到大的顺序为___________ 。
③下列实验事实不能证明醋酸是弱酸的是___________ 。
A.相同pH的醋酸溶液和盐酸分别与同样颗粒大小的锌反应时,产生H2的起始速率相等
B.常温下,测得0.1mol·L-1醋酸溶液的pH=4
C.常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4
D.在相同条件下,同浓度醋酸溶液的导电性比盐酸的弱
(2)高温下H2O可以分解成分子或原子。
①若在相同温度下,1molH2O按下列两种途径转化成氢原子与氧原子。则△H1、△H2、△H3三者之间的关系是___________ 。
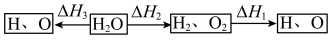
②高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中A表示的物质(或微粒)是___________ 。等物质的量的A、H2相比,化学能较低的物质是___________ 。
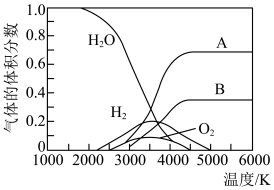
(1)已知下列物质电离平衡常数
| 化学式 | HF |  |  |  |
| 电离平衡常数 | 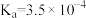 |  | 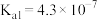  | 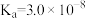 |
②物质的量浓度相同的HF、CH3COOH、H2CO3、HClO中,酸性由小到大的顺序为
③下列实验事实不能证明醋酸是弱酸的是
A.相同pH的醋酸溶液和盐酸分别与同样颗粒大小的锌反应时,产生H2的起始速率相等
B.常温下,测得0.1mol·L-1醋酸溶液的pH=4
C.常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4
D.在相同条件下,同浓度醋酸溶液的导电性比盐酸的弱
(2)高温下H2O可以分解成分子或原子。
①若在相同温度下,1molH2O按下列两种途径转化成氢原子与氧原子。则△H1、△H2、△H3三者之间的关系是
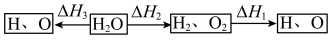
②高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中A表示的物质(或微粒)是

您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】(1)室温下,0.01mol/L的 HCl溶液的pH=_____________ ;0.01mol/L的 NaOH溶液的pH=_____________
(2)取10mLpH=2HCl的溶液加水稀释到1000mL,稀释后溶液的pH=________
(3)取10mLpH=2的CH3COOH溶液加水稀释到100mL,稀释后溶液的pH_________ ;若将上述溶液加水无限稀释,则稀释后的pH_________
(2)取10mLpH=2HCl的溶液加水稀释到1000mL,稀释后溶液的pH=
(3)取10mLpH=2的CH3COOH溶液加水稀释到100mL,稀释后溶液的pH
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】回答下列问题。
(1)醋酸是常见的弱酸。
 醋酸在水溶液中的电离方程式为
醋酸在水溶液中的电离方程式为 ___________ 。
 下列方法中,可以使醋酸稀溶液中
下列方法中,可以使醋酸稀溶液中 电离程度增大的是
电离程度增大的是___________  填字母序号
填字母序号 。
。
a.滴加少量浓盐酸 b.微热溶液 c.加水稀释 d.加入少量醋酸钠晶体
(2)用 溶液分别滴定体积均为
溶液分别滴定体积均为 、浓度均为
、浓度均为 的盐酸和醋酸溶液,得到滴定过程中溶液
的盐酸和醋酸溶液,得到滴定过程中溶液 随加入
随加入 溶液体积而变化的两条滴定曲线。
溶液体积而变化的两条滴定曲线。

 滴定醋酸的曲线是
滴定醋酸的曲线是___________  填“
填“ ”或“Ⅱ”
”或“Ⅱ” 。
。
 滴定开始前,三种溶液中由水电离出的
滴定开始前,三种溶液中由水电离出的 最大的是
最大的是___________ 。
 上述用
上述用 的
的 溶液滴定
溶液滴定 的盐酸,下列操作不正确的是
的盐酸,下列操作不正确的是___________ 。
A.用标准 溶液润洗碱式滴定管后,再装入标准碱溶液
溶液润洗碱式滴定管后,再装入标准碱溶液
B.用待测酸溶液润洗锥形瓶后,再装入待测酸溶液
C.滴定时两眼应注视滴定管中液面的变化,以免滴定过量
D.读数时,视线应与滴定管凹液面的最低点保持水平
(1)醋酸是常见的弱酸。
 醋酸在水溶液中的电离方程式为
醋酸在水溶液中的电离方程式为  下列方法中,可以使醋酸稀溶液中
下列方法中,可以使醋酸稀溶液中 电离程度增大的是
电离程度增大的是 填字母序号
填字母序号 。
。a.滴加少量浓盐酸 b.微热溶液 c.加水稀释 d.加入少量醋酸钠晶体
(2)用
 溶液分别滴定体积均为
溶液分别滴定体积均为 、浓度均为
、浓度均为 的盐酸和醋酸溶液,得到滴定过程中溶液
的盐酸和醋酸溶液,得到滴定过程中溶液 随加入
随加入 溶液体积而变化的两条滴定曲线。
溶液体积而变化的两条滴定曲线。
 滴定醋酸的曲线是
滴定醋酸的曲线是 填“
填“ ”或“Ⅱ”
”或“Ⅱ” 。
。 滴定开始前,三种溶液中由水电离出的
滴定开始前,三种溶液中由水电离出的 最大的是
最大的是 上述用
上述用 的
的 溶液滴定
溶液滴定 的盐酸,下列操作不正确的是
的盐酸,下列操作不正确的是A.用标准
 溶液润洗碱式滴定管后,再装入标准碱溶液
溶液润洗碱式滴定管后,再装入标准碱溶液B.用待测酸溶液润洗锥形瓶后,再装入待测酸溶液
C.滴定时两眼应注视滴定管中液面的变化,以免滴定过量
D.读数时,视线应与滴定管凹液面的最低点保持水平
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】与化学平衡类似,电离平衡的平衡常数,叫做电离常数,几种弱酸的电离常数(25℃)如下表:
回答下列问题:
(1)上述4种酸中,酸性最弱的是___________ (用化学式表示),往 溶液中加入
溶液中加入 溶液,
溶液,___________ (填“能”或“不能”)发生反应,若能反应,则写出该反应的离子方程式___________ 。
(2)试写出草酸(H2C2O4)的第一步电离的电离方程式为:___________ 。
(3)水是一种极弱的电解质,在水的电离平衡中, 和
和 的关系如图所示:
的关系如图所示:
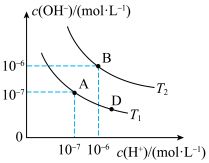
①A点水的离子积常数为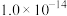 ,B点水的离子积常数为
,B点水的离子积常数为___________ ,造成水的离子积变化的因素是___________ 。
② 时,若某盐酸中
时,若某盐酸中 ,则由水电离产生的
,则由水电离产生的
___________ mol/L。
| 化学式 |  |  |  |  |
| 电离常数 |  | 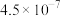 (第一步) (第一步) |  |  (第一步) (第一步) |
(1)上述4种酸中,酸性最弱的是
 溶液中加入
溶液中加入 溶液,
溶液,(2)试写出草酸(H2C2O4)的第一步电离的电离方程式为:
(3)水是一种极弱的电解质,在水的电离平衡中,
 和
和 的关系如图所示:
的关系如图所示:
①A点水的离子积常数为
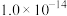 ,B点水的离子积常数为
,B点水的离子积常数为②
 时,若某盐酸中
时,若某盐酸中 ,则由水电离产生的
,则由水电离产生的
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐1】(1)写出下列物质在水中电离的方程式:
(a)氢硫酸_____________________________________________ .
(b)碳酸氢钠____________________________
(c)硫酸氢钠___________________________
(2)写出下列物质水解的离子方程式:
(a)硫酸铝__________ (b)次氯酸钠 ______________________
(a)氢硫酸
(b)碳酸氢钠
(c)硫酸氢钠
(2)写出下列物质水解的离子方程式:
(a)硫酸铝
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】填空。
(1)FeCl3的水溶液呈_______ (填“酸性”、“中性”、“碱性”),原因是(用离子方程式表示):_______ ;实验室在配制FeCl3溶液时,常将FeCl3固体先溶于盐酸中,再用蒸馏水稀释,以_______ 其水解。将FeCl3溶液加热蒸干并灼烧,最后得到的固体物质是_______ 。
(2)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的________ 。
(3)请用适当的离子方程式解释下列现象:
①NaHSO3溶液呈酸性_______ ;
②NaAlO2溶液呈碱性_______ ;
③明矾可用于净水:_______ ;
④泡沫灭火器里盛有Al2(SO4)3溶液和NaHCO3溶液,当倒置灭火器时,两种溶液混合立即喷出大量泡沫_______ 。
(1)FeCl3的水溶液呈
(2)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的
(3)请用适当的离子方程式解释下列现象:
①NaHSO3溶液呈酸性
②NaAlO2溶液呈碱性
③明矾可用于净水:
④泡沫灭火器里盛有Al2(SO4)3溶液和NaHCO3溶液,当倒置灭火器时,两种溶液混合立即喷出大量泡沫
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】将硫化钾溶于水:
(1)其水溶液呈___________ 性;
(2)水解的离子方程式为___________ ,___________ ;
(3)溶液中c(S2-)、c(HS-)、c(H2S)的相对大小关系是___________ 。
(1)其水溶液呈
(2)水解的离子方程式为
(3)溶液中c(S2-)、c(HS-)、c(H2S)的相对大小关系是
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】NaHS溶液:
水解方程式:______________________ ;
离子浓度大小关系:__________________ ;
电荷守恒:__________________________ ;
物料守恒:__________________________ ;
质子守恒:__________________________ 。
水解方程式:
离子浓度大小关系:
电荷守恒:
物料守恒:
质子守恒:
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐3】已知常温下部分弱电解质的电离平衡常数如下表:
(1)常温下,物质的量浓度相同的三种溶液①NaF溶液②NaClO溶液③Na2CO3溶液,其pH由大到小的顺序是_______ (填序号)
(2)25℃时,pH=4的NH4Cl溶液中各离子浓度的大小关系为_______
(3)NaClO溶液中的质子守恒关系为_______
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为_______
(5)常温下,0.1mol/L的氨水和0.1mol/L的NH4Cl溶液等体积混合,判断混合溶液的酸碱性_______ (填“酸性”“碱性”“中性”)
(6)25℃时,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应完后溶液中c(NH )=c(Cl-),用含a的代数式表示NH3·H2O的电离平衡常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离平衡常数Kb=_______ 。
| 化学式 | HF | HClO | H2CO3 | NH3·H2O |
| 电离常数 | 6.8×10−4 | 4.7×10−8 | K1=4.3×10−7 K2=5.6×10−11 | Kb=1.7×10−5 |
(1)常温下,物质的量浓度相同的三种溶液①NaF溶液②NaClO溶液③Na2CO3溶液,其pH由大到小的顺序是
(2)25℃时,pH=4的NH4Cl溶液中各离子浓度的大小关系为
(3)NaClO溶液中的质子守恒关系为
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为
(5)常温下,0.1mol/L的氨水和0.1mol/L的NH4Cl溶液等体积混合,判断混合溶液的酸碱性
(6)25℃时,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应完后溶液中c(NH
 )=c(Cl-),用含a的代数式表示NH3·H2O的电离平衡常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离平衡常数Kb=
您最近一年使用:0次



