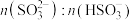1 . 氧化铝法制取无水三氯化铝的反应如下:Al2O3(s)+C(s)+Cl2(g) AlCl3(g)+CO(g)
AlCl3(g)+CO(g)
(1)配平上述方程式,并用单线桥法标出上述反应的电子转移方向和数目__________ 。
(2)Al2O3是离子晶体,AlCl3是分子晶体,在工业上通常采用电解熔融态的Al2O3来进行制备单质铝,请从晶体结构角度说明原因:__________________ 。
(3)铝盐可以用于做净水剂,请写出Al3+水解的离子方程式:____________ 。
 AlCl3(g)+CO(g)
AlCl3(g)+CO(g)(1)配平上述方程式,并用单线桥法标出上述反应的电子转移方向和数目
(2)Al2O3是离子晶体,AlCl3是分子晶体,在工业上通常采用电解熔融态的Al2O3来进行制备单质铝,请从晶体结构角度说明原因:
(3)铝盐可以用于做净水剂,请写出Al3+水解的离子方程式:
您最近一年使用:0次
名校
2 .  溶于重水
溶于重水 生成一水合氨和水合离子的化学式为
生成一水合氨和水合离子的化学式为
 溶于重水
溶于重水 生成一水合氨和水合离子的化学式为
生成一水合氨和水合离子的化学式为A. 和 和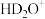 | B.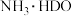 和 和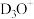 |
C.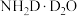 和 和 | D. 和 和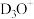 |
您最近一年使用:0次
名校
解题方法
3 . 10℃时加热 的饱和溶液,测得该溶液的pH发生如下变化:
的饱和溶液,测得该溶液的pH发生如下变化:
对于上述实验过程中的现象,甲同学和乙同学的观点如下:
(1)甲同学认为,最终该溶液的pH升高的原因是 的水解程度增大,故碱性增强,该反应的离子方程式为
的水解程度增大,故碱性增强,该反应的离子方程式为______________________________ 。
(2)乙同学认为最终溶液pH升高的原因是 受热分解,生成了
受热分解,生成了 ,该分解反应的化学方程式为
,该分解反应的化学方程式为______________________________ ,并判断 的水解程度
的水解程度__________ (选填“>”或“<”) 。
。
关于甲、乙同学的观点是否正确,两同学和丁同学的观点如下:
(3)丙同学认为只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则__________ (选填“甲”或“乙”)判断正确。试剂X是__________ 。
(4)丁同学则认为不需要添加任何试剂,只要在合适的条件下测定溶液的pH即可判断,请分析丁同学的实验方法和对应的结论。
___________________________________________________________
(5) 和
和 混合溶液的pH随
混合溶液的pH随 和
和 比例的不同而不同,数据如下:
比例的不同而不同,数据如下:
表中第__________ 组(选填序号)数据,可判断 溶液显
溶液显__________ (选填“酸”或“碱”)性。
 的饱和溶液,测得该溶液的pH发生如下变化:
的饱和溶液,测得该溶液的pH发生如下变化:温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)甲同学认为,最终该溶液的pH升高的原因是
 的水解程度增大,故碱性增强,该反应的离子方程式为
的水解程度增大,故碱性增强,该反应的离子方程式为(2)乙同学认为最终溶液pH升高的原因是
 受热分解,生成了
受热分解,生成了 ,该分解反应的化学方程式为
,该分解反应的化学方程式为 的水解程度
的水解程度 。
。关于甲、乙同学的观点是否正确,两同学和丁同学的观点如下:
(3)丙同学认为只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则
(4)丁同学则认为不需要添加任何试剂,只要在合适的条件下测定溶液的pH即可判断,请分析丁同学的实验方法和对应的结论。
(5)
 和
和 混合溶液的pH随
混合溶液的pH随 和
和 比例的不同而不同,数据如下:
比例的不同而不同,数据如下:序号 | ① | ② | ③ |
| 91:9 | 1:1 | 1:9 |
pH | 8.2 | 7.2 | 6.2 |
 溶液显
溶液显
您最近一年使用:0次
名校
4 . 下列化学用语表达正确的是
| A.H2S的电离方程式:H2S⇌H++HS- |
B.NaHCO3在水溶液中的电离方程式:NaHCO3=Na++H++CO |
C.CO 的水解方程式:CO 的水解方程式:CO +2H2O⇌HCO +2H2O⇌HCO +2OH- +2OH- |
| D.HS-的水解方程式:HS-+H2O⇌S2- +H3O+ |
您最近一年使用:0次
2023-12-27更新
|
374次组卷
|
4卷引用:上海市控江中学2023-2024学年高二上学期等级班阶段测验卷二 化学试题
名校
5 . 市售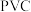 是由
是由 水解产生的一系列中间产物脱水聚合而成,其中稳定存在形态为聚十三铝
水解产生的一系列中间产物脱水聚合而成,其中稳定存在形态为聚十三铝 ,简称
,简称 。
。 含量的高低直接影响
含量的高低直接影响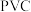 的净水效能。
的净水效能。
(1) 溶液中,
溶液中, 逐级水解能生成
逐级水解能生成 、
、 等单体。生成
等单体。生成 的离子方程式为
的离子方程式为___________ 。
(2)向 溶液中缓慢滴加一定量
溶液中缓慢滴加一定量 溶液,若只生成
溶液,若只生成 ,则理论上
,则理论上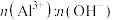 =
=___________ 提纯 胶体可采取的措施是
胶体可采取的措施是___________ 。
(3)为了发挥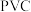 净水的最佳效能,一般要将水的
净水的最佳效能,一般要将水的 调节在6.0~8.5.若在强酸或强碱环境下使用
调节在6.0~8.5.若在强酸或强碱环境下使用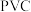 ,净水效果不佳,结合铝元素的存在形式分析原因
,净水效果不佳,结合铝元素的存在形式分析原因___________ 。
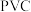 是由
是由 水解产生的一系列中间产物脱水聚合而成,其中稳定存在形态为聚十三铝
水解产生的一系列中间产物脱水聚合而成,其中稳定存在形态为聚十三铝 ,简称
,简称 。
。 含量的高低直接影响
含量的高低直接影响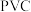 的净水效能。
的净水效能。(1)
 溶液中,
溶液中, 逐级水解能生成
逐级水解能生成 、
、 等单体。生成
等单体。生成 的离子方程式为
的离子方程式为(2)向
 溶液中缓慢滴加一定量
溶液中缓慢滴加一定量 溶液,若只生成
溶液,若只生成 ,则理论上
,则理论上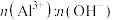 =
= 胶体可采取的措施是
胶体可采取的措施是(3)为了发挥
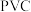 净水的最佳效能,一般要将水的
净水的最佳效能,一般要将水的 调节在6.0~8.5.若在强酸或强碱环境下使用
调节在6.0~8.5.若在强酸或强碱环境下使用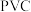 ,净水效果不佳,结合铝元素的存在形式分析原因
,净水效果不佳,结合铝元素的存在形式分析原因
您最近一年使用:0次
名校
6 . 盐酸肼(N2H6Cl2)属于离子化合物,易溶于水,溶液呈酸性,水解原理与 类似。
类似。
(1)盐酸肼第一步水解反应的离子方程式___________ 。
(2)盐酸肼水溶液中离子浓度的排列顺序正确的是___________(选填编号)。
 类似。
类似。(1)盐酸肼第一步水解反应的离子方程式
(2)盐酸肼水溶液中离子浓度的排列顺序正确的是___________(选填编号)。
A.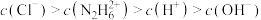 |
B. |
C. |
D.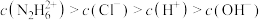 |
您最近一年使用:0次
名校
7 . 下列表示盐类水解的离子方程式中,正确 的是
A.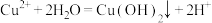 |
B. |
C. |
D.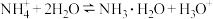 |
您最近一年使用:0次
2023-10-14更新
|
788次组卷
|
2卷引用:上海市建平中学2023-2024学年高二上学期第一次月考化学试题
名校
8 . Ⅰ.某浓度碳酸钠溶液的pH随温度的变化如下左图所示,室温下碳酸钠溶液的pH随浓度的变化如下右图所示。

完成下列问题:
(1)用离子方程式表示Na2CO3溶液呈碱性的主要原因:___________ 。
(2)下列判断正确的是___________。
Ⅱ.向0.6 mol∙L−1的Na2CO3溶液中滴加盐酸至Na2CO3浓度约为0.5 mol∙L−1。
(3)根据上右图判断,所得溶液的pH___________ 12.0 (填“>”、“<”或“=”) 。
(4)关于所得溶液中离子浓度关系判断正确的是___________。
(5)将上述溶液与足量盐酸反应后的CO2通入Na2SiO3溶液,溶液变浑浊。该现象___________ (填“能”或“不能”)说明酸性H2CO3>H2SiO3。若能,说明理由,若不能,说明实验的改进方案。___________ 。

完成下列问题:
(1)用离子方程式表示Na2CO3溶液呈碱性的主要原因:
(2)下列判断正确的是___________。
| A.a点Na2CO3的水解程度最小 |
| B.b点水的电离程度最大 |
C.c点溶液中的 约为 约为 |
| D.根据上右图推断,上左图中溶液的浓度约为0.3 mol∙L−1 |
Ⅱ.向0.6 mol∙L−1的Na2CO3溶液中滴加盐酸至Na2CO3浓度约为0.5 mol∙L−1。
(3)根据上右图判断,所得溶液的pH
(4)关于所得溶液中离子浓度关系判断正确的是___________。
A. |
B. |
C. |
D. |
您最近一年使用:0次
名校
9 . (NH4)2SO4是一种优良的氮肥,能使枝叶生长旺盛,提高果实的品质和产量,(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气。
(1)请写出(NH4)2SO4溶液的水解方程式:_______ (用离子方程式表示);写出(NH4)2SO3溶液中的电荷守恒:_______ 。
(2)常温下,相同物质的量浓度的(NH4)2SO3溶液与(NH4)2SO4溶液中,c(NH )较大的是
)较大的是_______ 溶液。
(3)SO2用pH相同、体积相同的三种碱:①氨水;②NaOH;③Ba(OH)2来吸收,吸收SO2的量由大到小的顺序为_______ (用编号表示)。
(1)请写出(NH4)2SO4溶液的水解方程式:
(2)常温下,相同物质的量浓度的(NH4)2SO3溶液与(NH4)2SO4溶液中,c(NH
 )较大的是
)较大的是(3)SO2用pH相同、体积相同的三种碱:①氨水;②NaOH;③Ba(OH)2来吸收,吸收SO2的量由大到小的顺序为
您最近一年使用:0次
2023·上海·模拟预测
解题方法
10 . 聚合氯化铝用于城市给排水净化。氧化铝法制取无水三氯化铝的反应如下: 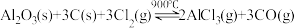
(1)标出上述反应的电子转移方向和数目_______ 。
(2)写出该反应的平衡常数表达式:
_______ 。
(3)Al原子核外有_______ 种不同能量的电子。
聚合氯化铝(PAC)是一种介于 和
和 之间的水溶性无机高分子聚合物,PAC的水解过程中会有一种聚合稳定态物质
之间的水溶性无机高分子聚合物,PAC的水解过程中会有一种聚合稳定态物质 称为
称为 ,
, 对水中胶体和颗粒物具有高度电中和桥联作用,是净水过程中的重要物质。
对水中胶体和颗粒物具有高度电中和桥联作用,是净水过程中的重要物质。
(4) Al13在水解过程中会产生[Al(OH)2]+、[Al(OH)]2+等产物,写出[Al(OH)]2+水解的离子方程式_______ 。
(5) 溶液与NaOH溶液反应,若参与反应的铝离子最终全部转化生成
溶液与NaOH溶液反应,若参与反应的铝离子最终全部转化生成 ,则理论上参与反应的
,则理论上参与反应的 与
与 的物质的量之比是
的物质的量之比是_______
(6)使用 净水时应控制pH在6.8~8.02之间,否则净水效果不佳。请结合使用
净水时应控制pH在6.8~8.02之间,否则净水效果不佳。请结合使用 水解净化水时铝元素存在的形态,分析在强酸性和强碱性环境时净水效果差的原因。
水解净化水时铝元素存在的形态,分析在强酸性和强碱性环境时净水效果差的原因。_______
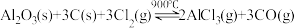
(1)标出上述反应的电子转移方向和数目
(2)写出该反应的平衡常数表达式:

(3)Al原子核外有
聚合氯化铝(PAC)是一种介于
 和
和 之间的水溶性无机高分子聚合物,PAC的水解过程中会有一种聚合稳定态物质
之间的水溶性无机高分子聚合物,PAC的水解过程中会有一种聚合稳定态物质 称为
称为 ,
, 对水中胶体和颗粒物具有高度电中和桥联作用,是净水过程中的重要物质。
对水中胶体和颗粒物具有高度电中和桥联作用,是净水过程中的重要物质。(4) Al13在水解过程中会产生[Al(OH)2]+、[Al(OH)]2+等产物,写出[Al(OH)]2+水解的离子方程式
(5)
 溶液与NaOH溶液反应,若参与反应的铝离子最终全部转化生成
溶液与NaOH溶液反应,若参与反应的铝离子最终全部转化生成 ,则理论上参与反应的
,则理论上参与反应的 与
与 的物质的量之比是
的物质的量之比是(6)使用
 净水时应控制pH在6.8~8.02之间,否则净水效果不佳。请结合使用
净水时应控制pH在6.8~8.02之间,否则净水效果不佳。请结合使用 水解净化水时铝元素存在的形态,分析在强酸性和强碱性环境时净水效果差的原因。
水解净化水时铝元素存在的形态,分析在强酸性和强碱性环境时净水效果差的原因。
您最近一年使用:0次