2011·江西新余·模拟预测
1 . 相同温度下,两种弱酸HA、HB的电离平衡常数Ka(HA)>Ka(HB)。下列有关说法正确的是
| A.浓度均为0.1 mol·L-1的HA、HB溶液中,其溶液的pH大小为:pH(HA)>pH(HB) |
| B.浓度均为0.1 mol·L-1的NaA、NaB溶液中,其溶液的pH大小为:pH(NaA)>pH(NaB) |
| C.等体积pH相同的HA、HB溶液,分别加入等浓度的NaOH溶液,恰好完全反应消耗的NaOH溶液体积HA比HB多 |
| D.在0.1 mol·L-1NaA溶液中各离子浓度关系为:c(Na+)>c(A一)>c(OH一)>c(H+) |
您最近一年使用:0次
10-11高三上·江西九江·阶段练习
2 . 有下列词语:①渗析 ②盐析 ③聚沉 ④溶胶 ⑤凝胶 ⑥布朗运动 ⑦电泳
⑧丁达尔效应 ⑨中和 ⑩水解,选出适当的词语将其序号填入下列空格中。
(1)往浓肥皂中加入饱和食盐水(或固体食盐),肥皂凝聚,这种现象称为___________ 。
(2)在肥皂水中透过强光,可看到光带,这种现象称为___________________________ 。
(3)使热的浓肥皂水冷却并完全固化后的物质叫__________________________________ 。
(4)在肥皂水中加入酚酞变红色,说明高级脂肪酸根离子发生了___________________ 。
(5)在Fe(OH)3胶体中加入(NH4)2SO4产生红褐色沉淀,这种现象叫做_______________ 。
(6)用半透膜把制取Fe(OH)3胶体中生成的氯化钠分离出的方法叫做________________ 。
(7)在水泥和冶金工厂常用高压电对气溶胶作用,除去大量烟尘,以减少对空气的污染。这种做法应用的主要原理是__________________________ 。
⑧丁达尔效应 ⑨中和 ⑩水解,选出适当的词语将其序号填入下列空格中。
(1)往浓肥皂中加入饱和食盐水(或固体食盐),肥皂凝聚,这种现象称为
(2)在肥皂水中透过强光,可看到光带,这种现象称为
(3)使热的浓肥皂水冷却并完全固化后的物质叫
(4)在肥皂水中加入酚酞变红色,说明高级脂肪酸根离子发生了
(5)在Fe(OH)3胶体中加入(NH4)2SO4产生红褐色沉淀,这种现象叫做
(6)用半透膜把制取Fe(OH)3胶体中生成的氯化钠分离出的方法叫做
(7)在水泥和冶金工厂常用高压电对气溶胶作用,除去大量烟尘,以减少对空气的污染。这种做法应用的主要原理是
您最近一年使用:0次
9-10高二下·江西·期末
3 . 已知:甲酸的酸性比乙酸强。则物质的量浓度相等的下列物质①C6H5ONa ②CH3COONa ③Na2CO3④NaHCO3⑤HCOONa ⑥NaOH的溶液的pH 按由大到小的顺序排列正确的是
| A.③⑥①④②⑤ | B.⑥③①④②⑤ | C.⑤②①④③⑥ | D.⑥③④②①⑤ |
您最近一年使用:0次
9-10高二下·江西吉安·期末
4 . 已知常温下0.1 mol·L-1的二元酸H2A溶液的pH=4.0。在标准状况下,将2.24 L H2A气体通入到100 mL 1.5 mol·L-1NaOH溶液中,充分反应后(假设溶液体积不发生变化),下列关系式不正确的是
| A.c(Na+)+c(H+)= 2c(A2-)+c(OH-)+c(HA-) |
| B.c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+) |
| C.c(Na+)>c(HA-)>c(A2-)>c(OH-)>c(H+) |
| D.c(A2-)+c(HA-)+c(H2A)="1.0" mol·L-1 |
您最近一年使用:0次
5 . 下列溶液中微粒浓度关系一定正确的是
| A.氨水与氯化铵的pH=7的混合溶液中:C(Cl-)>C(NH4+) |
| B.pH=2的一元酸和pH=12的一元强碱等体积混合:C(OH-)=C(H+) |
| C.O.1mol/L的硫酸铵溶液中:C(NH4+)>C(SO42-)>C(H+) |
| D.0.1mol/L的硫化钠溶液中:C(OH-)=C(H+)>C(HS-)>C(H2S) |
您最近一年使用:0次
2016-12-09更新
|
653次组卷
|
22卷引用:2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷
(已下线)2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷2010年全国普通高等学校招生统一考试上海卷化学试题2010年高考化学试题分项专题十 电解质溶液(已下线)2010年湖北省孝感高中高二上学期期中考试化学试卷(已下线)2010年河北省黄骅中学高二上学期期中考试化学试卷(已下线)2011-2012学年广西武鸣高中高二上学期段考化学(理)试卷(已下线)2011-2012学年浙江省浙东北三校高二下学期期中联考化学试卷(已下线)2012-2013学年陕西省西安市第一中学高二上学期期末考试理科化学卷(已下线)2014届新疆乌鲁木齐市兵团二中高二(上)期末化学试卷2015-2016学年贵州遵义航天中学高二上第三次月考化学卷2017届福建省宁德市高三上学期单科质检模拟化学试卷2016-2017学年甘肃省嘉峪关市酒钢三中高二上学期期末考试化学试卷新疆维吾尔自治区阿克苏市农一师高级中学2017-2018学年高二第二次月考化学试卷(已下线)2018年11月9日——《每日一题》 人教 必修4-离子浓度大小比较的思路辽宁省沈阳市东北育才学校2019届高三上学期第三次模拟化学试题【百强校】黑龙江省牡丹江市第一高级中学2019届高三上学期期末考试化学试题河南省洛阳市2018-2019学年高二第一学期期中考试化学试题(已下线)2019年11月8日 《每日一题》选修4——离子浓度大小比较的思路夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——与pH相关的计算综合(基础过关)吉林省桦甸市第八中学2020届高三上学期第三次月考化学试题人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第三节 盐类的水解 作业帮宁夏回族自治区银川市北方民族大学附属中学2020-2021学年高二下学期3月月考化学试题
名校
6 . 温度相同,浓度均为0.1 mol·L-1的:①(NH4)2CO3,②(NH4)2Fe(SO4)2,③氨水,④NH4NO3,⑤ NH4HSO4溶液,它们中的c(NH )由大到小的排列顺序是
)由大到小的排列顺序是
 )由大到小的排列顺序是
)由大到小的排列顺序是| A.②⑤④①③ | B.③⑤②④① |
| C.②①⑤④③ | D.⑤②①④③ |
您最近一年使用:0次
2016-12-05更新
|
171次组卷
|
3卷引用:江西省南昌市安义中学2019-2020学年高二上学期期中考试化学试题
名校
解题方法
7 . 下列说法正确的是
| A.室温下,pH=11的氨水与pH=3的盐酸等体积混合:c(Cl﹣)=c(NH4+)>c(OH﹣)=c(H+) |
| B.醋酸与醋酸钠的pH=7的混合溶液中:c(CH3COO﹣)+c(CH3COOH)<c(Na+) |
| C.相同物质的量浓度的NaClO和NaHCO3混合溶液中:c(HClO)+c(ClO﹣)=c(HCO3﹣)+c(H2CO3)+c(CO32﹣) |
| D.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl) |
您最近一年使用:0次
2016-12-05更新
|
365次组卷
|
9卷引用:江西省赣州市赣州县第三中学2019-2020学年高二下学期入学考试化学试题
江西省赣州市赣州县第三中学2019-2020学年高二下学期入学考试化学试题2015届内蒙古呼伦贝尔市高三高考模拟考(一)理综化学试卷2016-2017学年湖北省襄阳五中高二上10月月考化学试卷2016-2017学年辽宁省沈阳铁路中学高二上期中化学试卷【全国百强校】河北省石家庄市第一中学2018-2019学年高二上学期期中考试化学试题河南省林州市第一中学2020-2021学年高二下学期第二次月考化学试题云南省玉溪第三中学2021-2022学年高二上学期期末考试化学试题云南省开远市第一中学校2022-2023学年高二下学期3月半月考化学试题黑龙江省哈尔滨市宾县第二中学2022-2023学年高二上学期期中考试化学试题
名校
8 . 现有两正盐的稀溶液,分别是a mol·L-1 NaX溶液和b mol·L-1 NaY溶液。下列说法不正确的是
| A.若a>b,测得c(X-)=c(Y-),可推出溶液中的c(HX)>c(HY) |
| B.若a>b,测得c(X-)=c(Y-),可推出溶液中的c(HX)=c(HY) |
| C.若a=b,且pH(NaX)>pH(NaY),则相同浓度时,酸性HX<HY |
| D.若a=b,并测得a=c(X-)=c(Y-)+c(HY),则HX是强酸,HY是弱酸 |
您最近一年使用:0次
2016-11-03更新
|
768次组卷
|
8卷引用:【全国百强校】江西省南昌市第二中学2018-2019学年高二上学期第三次月考化学试题
名校
9 . 室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是
| A.向0.10mol•L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-) |
| B.向0.10mol•L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-) |
| C.向0.10mol•L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] |
| D.向0.10mol•L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-) |
您最近一年使用:0次
2016-06-27更新
|
265次组卷
|
2卷引用:2016届江西省吉安一中高三第三次模拟理综化学试卷
解题方法
10 . 常温下,浓度均为0.10 mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随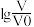 的变化如图所示,下列叙述正确的是
的变化如图所示,下列叙述正确的是

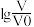 的变化如图所示,下列叙述正确的是
的变化如图所示,下列叙述正确的是
| A.该温度下HB的电离平衡常数约等于1.11×10-5 |
| B.相同条件下NaA溶液的pH大于NaB溶液的pH |
| C.溶液中水的电离程度:a=c>b |
D.当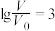 时,若两溶液同时升高温度,则 时,若两溶液同时升高温度,则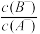 减小 减小 |
您最近一年使用:0次
2016-05-21更新
|
345次组卷
|
5卷引用:2016届江西省九江一中、临川二中高三下联考理综化学试卷
2016届江西省九江一中、临川二中高三下联考理综化学试卷2016届江西省上高二中高三5月月考理综化学试卷2017届安徽省六安一中高三上学期第一次月考化学试卷安徽省无为县2018届高三上学期第一次月考化学试题(已下线)二轮复习 专题11 水溶液中的离子平衡 押题专练



