名校
1 . 常温下,通过下列实验探究H2S、Na2S溶液的性质。
实验1:向0.1mol·L-1H2S溶液中通入一定体积NH3,测得溶液pH为7。
实验2:向0.1mol·L-1H2S溶液中滴加等体积同浓度的NaOH溶液,充分反应后再滴入2滴酚酞,溶液呈红色。
实验3:向5mL0.1mol·L-1Na2S溶液中滴入1mL0.1mol·L-1ZnSO4溶液,产生白色沉淀;再滴入几滴0.1mol·L-1CuSO4溶液,立即出现黑色沉淀。
实验4:向0.1mol·L-1Na2S溶液中逐滴滴加等体积同浓度的盐酸,无明显现象。
下列说法正确的是
实验1:向0.1mol·L-1H2S溶液中通入一定体积NH3,测得溶液pH为7。
实验2:向0.1mol·L-1H2S溶液中滴加等体积同浓度的NaOH溶液,充分反应后再滴入2滴酚酞,溶液呈红色。
实验3:向5mL0.1mol·L-1Na2S溶液中滴入1mL0.1mol·L-1ZnSO4溶液,产生白色沉淀;再滴入几滴0.1mol·L-1CuSO4溶液,立即出现黑色沉淀。
实验4:向0.1mol·L-1Na2S溶液中逐滴滴加等体积同浓度的盐酸,无明显现象。
下列说法正确的是
A.实验1得到的溶液中存在c(NH )=2c(S2—) )=2c(S2—) |
| B.由实验2可得出:Kw<Ka1(H2S)·Ka2(H2S) |
| C.由实验3可得出:Ksp(ZnS)>Ksp(CuS) |
| D.实验4得到的溶液中存在c(H+)—c(OH—)=c(S2—)—c(H2S) |
您最近一年使用:0次
2022-04-02更新
|
938次组卷
|
5卷引用:东北育才学校超常教育实验部(少32届)2022届高三第十次模拟考试化学试题
东北育才学校超常教育实验部(少32届)2022届高三第十次模拟考试化学试题(已下线)二轮专题强化练 专题14 溶液中的三大平衡及应用江苏省苏锡常镇四市2022届高三下学期教学情况调研(一)化学试题(已下线)必刷卷03-2022年高考化学考前信息必刷卷(江苏专用)江苏省盐城市五校2023届高三下学期3月联考化学试题
名校
2 . 室温下,向10mL 0.1000mol∙L-1二元酸H2B溶液中滴加0.1000 mol∙L-1 KOH溶液,测得溶液的pH与lgY [Y代表 或
或 ]的关系如图所示。下列相关结论不正确的是
]的关系如图所示。下列相关结论不正确的是

 或
或 ]的关系如图所示。下列相关结论不正确的是
]的关系如图所示。下列相关结论不正确的是
A.曲线N表示的是lg 与pH的变化关系 与pH的变化关系 |
| B.当滴加10mL KOH溶液时,溶液中c(H2B)>c(B2-) |
| C.X点对应的pH为6.5 |
| D.若用酚酞做指示剂,则滴定终点颜色变化为无色变粉红色 |
您最近一年使用:0次
2022-04-01更新
|
619次组卷
|
4卷引用:重庆市西南大学附属中学校2022届高三模拟考试(一)化学试题
重庆市西南大学附属中学校2022届高三模拟考试(一)化学试题(已下线)必刷卷01-2022年高考化学考前信息必刷卷(全国甲卷)河南省洛阳市孟津区第一高级中学2022-2023学年高三下学期入学考试化学试题湖北省普通高中2022届高三学业水平选择性考试5月适应性考试化学试题
3 . 常温下,向一定浓度的NaA溶液中加适量强酸或强碱(忽略溶液体积变化),溶液中 、
、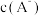 、
、 、
、 的负对数
的负对数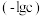 随溶液pH的变化关系如下图所示。下列叙述不正确的是
随溶液pH的变化关系如下图所示。下列叙述不正确的是

 、
、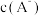 、
、 、
、 的负对数
的负对数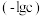 随溶液pH的变化关系如下图所示。下列叙述不正确的是
随溶液pH的变化关系如下图所示。下列叙述不正确的是
A.曲线①表示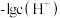 随溶液pH的变化情况 随溶液pH的变化情况 |
B.曲线①和曲线②的交点对应的溶液中存在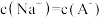 |
C.常温下,将A点对应溶液加水稀释,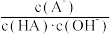 不变 不变 |
D.等物质的量浓度、等体积的NaA溶液与HA溶液混合后: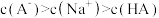 |
您最近一年使用:0次
2022-03-31更新
|
2762次组卷
|
6卷引用:必刷卷02-2022年高考化学考前信息必刷卷(全国甲卷)
(已下线)必刷卷02-2022年高考化学考前信息必刷卷(全国甲卷)(已下线)微专题39 水溶液中平衡图像的拓展与探析-备战2023年高考化学一轮复习考点微专题广东省2021-2022学年高三下学期一模化学试题广东省普通高中2022届高三学业水平选择考化学模拟测试(一)(已下线)押广东卷化学第8题 电解质溶液-备战2022年高考化学临考题号押题(广东卷)湖北省2022届高三5月联考化学试题
4 . 常温下,向1L0.10mol·L-1的Na2S溶液中通入SO2气体,溶液pH与SO2通入量的关系如图所示。pH<7.5时,有硫单质生成。已知:常温下,H2SO3的Ka1=1.4×10-2,Ka2=6.0×10-8;H2S的Ka1=1.1×10-7,Ka2=1.3×10-13。下列说法正确的是


| A.常温下,Na2SO3溶液pH大于相同浓度的Na2S溶液 |
B.a点发生的主要反应的离子方程式为2S2-+SO2+H2O=2HS-+SO |
C.a点存在c(S2-)+c(HS-)=2c(SO )+2c(HSO )+2c(HSO )+2c(H2SO3) )+2c(H2SO3) |
D.b点存在c(S2-)▪c(SO )=7.8×10-7▪c(HS-)▪c(HSO )=7.8×10-7▪c(HS-)▪c(HSO ) ) |
您最近一年使用:0次
2022·全国·模拟预测
5 . NaH2A—Na2HA溶液是人体存在的缓冲溶液。常温下,H3A溶液中各微粒组成随着pH而变化,溶液中A3-、HA2-、H2A-、H3A浓度所占分数(δ)随pH变化的关系如图所示。
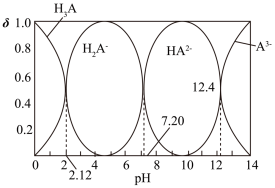
下列说法错误的是

下列说法错误的是
| A.0.1mol/LNaH2A溶液显酸性 |
| B.H3A+HA2—=2H2A—的平衡常数K=105.08 |
| C.将等物质的量的Na2HA和NaH2A配制成溶液,pH=7.20 |
| D.pH=12.40时,存在关系:c(H+)<2c(HA2—)+c(H2A—)+3c(A3—)+c(OH—) |
您最近一年使用:0次
2022-03-24更新
|
1345次组卷
|
4卷引用:高考化学预测卷(七)
名校
6 . 为了探究外界条件对氯化铵水解平衡的影响,某研究性学习小组设计实验方案,获得如下数据:
下列说法不正确 的是
| 实验 | c(NH4Cl)/mol·L−1 | V(NH4Cl)/mL | 温度/℃ | pH |
| 1 | 0.02 | 5 | 25 | x |
| 2 | 0.02 | 5 | 30 | y |
| 3 | 0.2 | 5 | 25 | z |
| A.由 x>y可知:升高温度能促进氯化铵的水解 |
| B.由x >z可知:增大盐的浓度,水解平衡正向移动,水解程度增大 |
| C.由z < x < z +1可知:稀释氯化铵溶液,水解平衡正向移动 |
D.Kh(NH4Cl)与Kb(NH3·H2O)的关系为:Kh=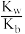 (Kw为水的离子积常数) (Kw为水的离子积常数) |
您最近一年使用:0次
2022-03-23更新
|
444次组卷
|
7卷引用:河南省郑州市第四高级中学2021-2022学年高二下学期第二次调研考试化学试题
名校
解题方法
7 . 常温下,下列有关电解质溶液的说法不正确 的是
A.向Na2CO3溶液中通入NH3,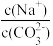 减小 减小 |
B.将0.1 mol·L-1的K2C2O4溶液从25 ℃升温至35 ℃,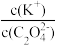 增大 增大 |
C.向0.1 mol·L-1的HF溶液中滴加NaOH溶液至中性, =1 =1 |
D.向0.1 mol·L-1的CH3COONa溶液中加入少量水,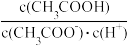 增大 增大 |
您最近一年使用:0次
2022-03-23更新
|
554次组卷
|
17卷引用:【全国百强校】山西省山西大学附属中学2019届高三上学期9月模块诊断化学试题
【全国百强校】山西省山西大学附属中学2019届高三上学期9月模块诊断化学试题安徽省长丰县双墩中学2018-2019学年高二上学期期末调研化学试题安徽省肥东县第二中学2019-2020学年高二上学期期中考试化学试题备考突破2020高三化学专题强化集训——盐类水解中的三大守恒的应用夯基提能2020届高三化学选择题对题专练 ——选修四化学反应原理——电离平衡常数及其影响因素专练 (2)【百强校】天津市静海区第一中学2020届高三下学期第七周周末训练化学试题天津市实验中学2020届高三下学期4月第一次测试化学试题解题达人.化学选择题(2021全国卷)巩固小卷02河南省郑州市第四高级中学2021-2022学年高二下学期第二次调研考试化学试题河南省郑州市2021-2022学年高二上学期期末考试化学试题(已下线)第八章 水溶液中的离子反应与平衡 第49练 盐类的水解广西防城港市2018届高三1月模拟考试理综化学试题广东省云浮市2018-2019学年高二上学期期末考试化学试题甘肃省白银市第十中学2019-2020学年高二上学期期中考试化学试题黑龙江省大兴安岭呼玛县高级中学2021-2022学年高三上学期期末考试化学试题湖北省宜昌英杰学校2021-2022学年高三上学期10月月考化学试题安徽省桐城中学2022-2023学年高二上学期月考(1)化学试题
名校
解题方法
8 . 联氨( )溶于水后是一种二元弱碱,在水中的电离方式与氨相似。25℃时,
)溶于水后是一种二元弱碱,在水中的电离方式与氨相似。25℃时,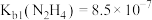 ,
,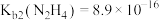 。下列说法错误的是
。下列说法错误的是
 )溶于水后是一种二元弱碱,在水中的电离方式与氨相似。25℃时,
)溶于水后是一种二元弱碱,在水中的电离方式与氨相似。25℃时,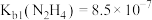 ,
,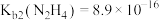 。下列说法错误的是
。下列说法错误的是A. 的 的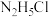 溶液呈酸性 溶液呈酸性 |
B. 的第二步电离方程式为 的第二步电离方程式为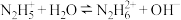 |
C. 与稀 与稀 中和生成的酸式盐的化学式为 中和生成的酸式盐的化学式为 |
D. 的稀溶液中存在 的稀溶液中存在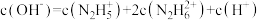 |
您最近一年使用:0次
2022-03-23更新
|
477次组卷
|
4卷引用:河北省张家口市2022届高三第一次模拟考试化学试题
河北省张家口市2022届高三第一次模拟考试化学试题(已下线)押新高考卷13题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(新高考通版)河南省开封市杞县高中2021-2022学年高二下学期月考化学试题(已下线)专题20 溶液中粒子浓度大小的比较-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
9 . 弱酸、弱碱的电离都比较弱,已知25C时部分弱酸的电离平衡常数(Ka)如下表:
下列说法正确的是
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| Ka | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.0×10-7 |
A.0.1mol·L-1Na2SO3溶液中通入CO2至恰好完全反应(不考虑溶液体积变化),溶液中存在:c(H+)-c(OH-)=2c(SO )+c(HSO )+c(HSO )+2c(CO )+2c(CO )+c(HCO )+c(HCO )-0.1 )-0.1 |
| B.25℃时,0.1mol·L-1Na2SO3溶液的pH约等于10(忽略二级水解和H2O的电离) |
| C.25℃时,0.1mol·L-1CH3COONa溶液中通入HCl气体,至pH=7(溶液体积变化忽略不计):c(Na+)>c(Cl-)>c(CH3COOH) |
| D.足量CH3COOH与Na2SO3溶液反应的化学方程式为:2CH3COOH+Na2SO3=2CH3COONa+SO2↑+H2O |
您最近一年使用:0次
名校
10 . 常温下,已知弱酸H3RO3溶液中含R物种的浓度之和为0.1mol·L-1,溶液中所有含R物种的lgc-pOH的关系如图所示,下列说法错误的是
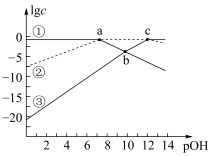
已知,①pOH表示OH-浓度的负对数[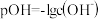 ]。
]。
②a、b、c三点的坐标,a(7.3,-1.3)、b(10.0,-3.6)、c(12.6,-1.3)。

已知,①pOH表示OH-浓度的负对数[
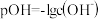 ]。
]。②a、b、c三点的坐标,a(7.3,-1.3)、b(10.0,-3.6)、c(12.6,-1.3)。
A. 为二元弱酸 为二元弱酸 |
B.曲线③表示 随pOH的变化 随pOH的变化 |
C.pH=6.7的溶液中: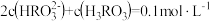 |
D.反应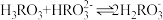 的平衡常数K=1×10-5.3 的平衡常数K=1×10-5.3 |
您最近一年使用:0次



