名校
1 . 常温下,向 0.1mol/LNa2A溶液中不断通入HCl。H2A、HA-、A2-在溶液中所占物质的量分数与 pOH[pOH=-lgc(OH-)]的关系如图所示,下列说法正确的是( )
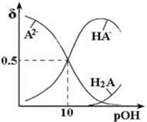

| A.H2A的第二级电离平衡常数为10-10 |
| B.随着HCl的通入 c(H+)/c(H2A)先减小后增大 |
| C.当溶液呈中性时:c(Na+)=c(HA-)+2c(A2-) |
| D.将等浓度等体积的 Na2A与H2A溶液混合后,溶液显碱性 |
您最近一年使用:0次
2018-01-29更新
|
799次组卷
|
9卷引用:天津市第一中学2017-2018学年高二上学期期末考试化学试题
天津市第一中学2017-2018学年高二上学期期末考试化学试题备考突破2020高三化学专题强化集训——溶液中微粒浓度大小的关系分析山东师范大学附属中学2021-2022学年高二上学期期中考试化学试题(已下线)专题07 电解质溶液—2022年高考化学二轮复习讲练测(全国版)-测试北京市第二中学2022-2023学年高二上学期11月月考化学试题湖南省长沙市周南中学2022-2023学年高二上学期期末考试化学试题黑龙江省大庆市第四中学2020届高三下学期第四次检测理综化学试题黑龙江省大庆市大庆铁人中学2021-2022学年高二上学期第一次月考化学试题黑龙江省齐齐哈尔市讷河市第一中学2023-2024学年高二下学期开学考试化学试题
名校
2 . 已知常温下CH3COOH和NH3·H2O的电离平衡常数分别为Ka、Kb。若在常温下向0.1mol/L的醋酸溶液中逐滴加入相同浓度的氨水直至完全过量,则下列说法正确的是
| A.加入氨水的过程中,溶液的导电性一直不断增强 |
| B.CH3COONH4在水溶液中的水解平衡常数Kh=Kw/(Ka+Kb) |
| C.若Ka≈Kb,当加入等体积的氨水时,溶液基本呈中性 |
| D.该等式在滴加过程中始终成立c(CH3COO-)+c(CH3COOH)=c(NH4+)+c(NH3·H2O) |
您最近一年使用:0次
2018-01-15更新
|
246次组卷
|
5卷引用:江苏省泰州中学2018届高三3月月度检测(二模模拟)化学试题
江苏省泰州中学2018届高三3月月度检测(二模模拟)化学试题(已下线)【中等生百日捷进提升系列-技能方法】专题11 电解质溶液类选择题解题方法和策略(已下线)模块十 水溶液中的离子平衡(模块检测)-2022年高考化学一轮复习小题多维练(全国通用)江苏省海安高级中学2018届高三1月月考化学试题(已下线)【新东方】高中化学163
3 . 硒(Se)和碲(Te)有许多优良性能,被广泛用于冶金、化工、医药卫生等领域。工业上以铜阳极泥(含有Cu、Cu2S、Cu2Se、Cu2Te等)为原料制备硒和碲的一种生产工艺如下图所示:

已知:“酸浸”过程中TeO2与硫酸反应生成TeOSO4。
(1)焙烧时通入氧气使铜阳极泥沸腾,目的是________________ 。
(2)SeO2与SO2的混合烟气可用水吸收制得单质Se,该反应中氧化产物与还原产物的物质的量之比为_____________ 。已知25℃时,亚硒酸(H2SeO3)的Ka1=2.5×10-3,Ka2=2.6×10-7,NaHSeO3溶液的pH________ 7(填“>”、“<”或“=”),理由是____________________ 。
(3)“浸出液”的溶质成分除了TeOSO4外,还有_______________ 。上述整个流程中可 以循环使用的物质是
以循环使用的物质是___________________ 。
(4)“还原”步骤中生成Te的化学方程式为_______________________ ;Te也可以通过碱性环境下电解Na2TeO3溶液获得,其阴极的电极反应式为___________________ 。
(5)粗硒中硒的含量可用如下方法测定:
①Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O;
②SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O;
③I2+2Na2S2O3=Na2S4O6+2NaI
通过用Na2S2O3标准溶液滴定反应②中生成的I2来计算硒的含量。实验中准确称量0.1200 g粗硒样品,滴定中消耗0.2000 mol·L-1Na2S2O3溶液24.00 mL,则粗硒样品中硒的质量分数为_______________ 。

已知:“酸浸”过程中TeO2与硫酸反应生成TeOSO4。
(1)焙烧时通入氧气使铜阳极泥沸腾,目的是
(2)SeO2与SO2的混合烟气可用水吸收制得单质Se,该反应中氧化产物与还原产物的物质的量之比为
(3)“浸出液”的溶质成分除了TeOSO4外,还有
 以循环使用的物质是
以循环使用的物质是(4)“还原”步骤中生成Te的化学方程式为
(5)粗硒中硒的含量可用如下方法测定:
①Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O;
②SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O;
③I2+2Na2S2O3=Na2S4O6+2NaI
通过用Na2S2O3标准溶液滴定反应②中生成的I2来计算硒的含量。实验中准确称量0.1200 g粗硒样品,滴定中消耗0.2000 mol·L-1Na2S2O3溶液24.00 mL,则粗硒样品中硒的质量分数为
您最近一年使用:0次
2017-05-12更新
|
310次组卷
|
2卷引用:山东省临沂市2017届高三下学期第二次模拟考试理科综合化学试题
解题方法
4 . 常温下,在20mL0.1mol/L HR 溶液中滴加0.1000mol/LNaOH溶液,混合溶液的PH与所加NaOH溶液体积的关系如图所示。下列推断正确的是
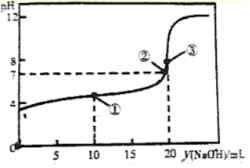

| A.①、②、③三点中,③对应的溶液中c水(H+)·c水(OH-)最大 |
| B.HR溶液中只存在H+、R-、OH-、H2O四种微粒 |
| C.②点溶液中一定存在c(Na+)>c(R-)>c(H+)=c(OH-) |
| D.NaR的水解常数Kh和水解程度:③>②>① |
您最近一年使用:0次
2017-04-13更新
|
279次组卷
|
2卷引用:夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——盐类水解平衡的影响因素及探究
名校
5 . 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2 mol/L NaOH溶液,含A元素的有关微粒物质的量变化如下图所示。根据图示判断,下列说法正确的是
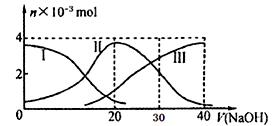
A.H2A在水中的电离方程式是:H2A == H+ +HA- ; HA-  H++A2- H++A2- |
| B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
| C.当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+ c(HA-)+ 2c(H2A)=c(A2-)+2c(OH-) |
| D.当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(OH-) |
您最近一年使用:0次
2017-04-06更新
|
662次组卷
|
4卷引用:2017届浙江省杭州市学军中学高三选考模拟化学试卷
2017届浙江省杭州市学军中学高三选考模拟化学试卷(已下线)课时44 滴定曲线、分布系数曲线的分析-2022年高考化学一轮复习小题多维练(全国通用)安徽省淮北市第一中学2016-2017学年高二下学期期中考试化学试题浙江省东阳中学2016-2017学年高二下学期期中考试化学试题
名校
解题方法
6 . 归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是
①对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的产量一定增加
②常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合后形成溶液a,等浓度的盐酸与NaOH溶液等体积混合后形成溶液b,水的电离程度a>b。
③常温下,AgCl在同物质的量浓度的氨水和NaCl溶液中的溶解度比较,前者大。
④若将适量CO2通入0.1 mol/LNa2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化) 2c(CO32-)+ c(HCO3ˉ)= 0.1 mol/L
⑤常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:Ka·Kh=Kw
①对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的产量一定增加
②常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合后形成溶液a,等浓度的盐酸与NaOH溶液等体积混合后形成溶液b,水的电离程度a>b。
③常温下,AgCl在同物质的量浓度的氨水和NaCl溶液中的溶解度比较,前者大。
④若将适量CO2通入0.1 mol/LNa2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化) 2c(CO32-)+ c(HCO3ˉ)= 0.1 mol/L
⑤常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:Ka·Kh=Kw
| A.①②④⑤ | B.②④⑤ | C.②⑤ | D.①③⑤ |
您最近一年使用:0次
2016-12-09更新
|
499次组卷
|
4卷引用:2020届高三化学化学二轮复习——常考题型:沉淀溶解平衡及其影响因素【精编24题】
名校
7 . 25℃时,H2SO3及其钠盐的溶液中,H2SO3、HSO3-、SO32-的物质的量分数(α)随溶液pH变化关系如下图所示,下列叙述错误的是
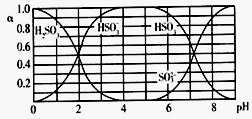

| A.溶液的pH=5时,硫元素的主要存在形式为HSO3- |
| B.当溶液恰好呈中性时:c(Na+)>c(SO32-)+c(HSO3-) |
C.向pH=8的上述溶液中滴加少量澄清石灰水,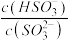 的值增大 的值增大 |
| D.向pH=3的上述溶液中滴加少量稀硫酸,α(HSO3-)减小 |
您最近一年使用:0次
2016-12-09更新
|
873次组卷
|
6卷引用:2015届山东临沂市高三5月模拟考试(一)理综化学试卷
名校
8 . 常温下,现有 0.1 mol·L-1的 NH4HCO3 溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与 pH 的关系如下图所示。下列说法正确的是
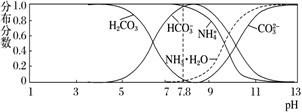

A.当溶液的 pH=9 时,溶液中存在下列关系:c( )>c( )>c( )>c(NH3 ·H2O)>c( )>c(NH3 ·H2O)>c( ) ) |
B.NH4HCO3 溶液中存在下列守恒关系:c( )+c(NH3·H2O)+c(H+)=c(OH-)+2c( )+c(NH3·H2O)+c(H+)=c(OH-)+2c( )+c(H2CO3) )+c(H2CO3) |
C.往该溶液中逐滴滴加氢氧化钠时, 和 和  浓度均逐渐减小 浓度均逐渐减小 |
| D.通过分析可知常温下 Kb(NH3·H2O)大于 Ka1(H2CO3) |
您最近一年使用:0次
2016-12-09更新
|
864次组卷
|
7卷引用:2015届浙江省杭州第二中学高三仿真考理综化学试卷



