名校
1 . 已知常温下水溶液中 、
、 、
、 、HB、
、HB、 的分布分数δ[如
的分布分数δ[如 ]随pH变化曲线如图1;溶液中
]随pH变化曲线如图1;溶液中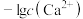 和
和 关系如图2.用
关系如图2.用
 溶液滴定20.00mL
溶液滴定20.00mL
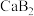 溶液,下列说法错误的是
溶液,下列说法错误的是

 、
、 、
、 、HB、
、HB、 的分布分数δ[如
的分布分数δ[如 ]随pH变化曲线如图1;溶液中
]随pH变化曲线如图1;溶液中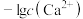 和
和 关系如图2.用
关系如图2.用
 溶液滴定20.00mL
溶液滴定20.00mL
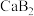 溶液,下列说法错误的是
溶液,下列说法错误的是
| A.曲线d表示δ(HB) |
B. 的水解平衡常数 的水解平衡常数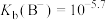 |
| C.滴定过程中溶液会变浑浊 |
D.滴定过程中始终存在: |
您最近一年使用:0次
2023-04-10更新
|
1860次组卷
|
12卷引用:重庆市七校2023-2024学年高三上学期开学考试化学试题
重庆市七校2023-2024学年高三上学期开学考试化学试题河北省石家庄市部分学校2023届高中毕业年级教学质量检测(二)(一模)化学试题河北省邢台市2022-2023学年高三下学期4月第一次模拟考试化学试题(已下线)专题15 水溶液中的离子平衡山东省东营市第一中学2023届高三下学期二模化学试题东北育才学校高中部2023届高三下学期适应性考试化学试题湖南省长郡中学2024届高三上学期月考卷(一)化学试题湖南省长沙市长郡中学2024届高三上学期9月月考化学试题江西省宜丰中学创新部2023-2024学年高二上学期第一次(10月)月考化学试题四川省宜宾市叙州区第一中学校2023-2024学年高二上学期12月月考化学试题(已下线)化学(九省联考考后提升卷,河南卷)-2024年1月“九省联考”真题完全解读与考后提升(已下线)热点18 电解质溶液图像分析
2022高三·全国·专题练习
2 . 甘氨酸 是人体必需氨基酸之一、在
是人体必需氨基酸之一、在 时,
时, 、
、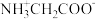 和
和 的分布分数【如
的分布分数【如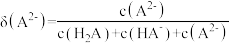 】与溶液
】与溶液 关系如图。下列说法错误的是
关系如图。下列说法错误的是
 是人体必需氨基酸之一、在
是人体必需氨基酸之一、在 时,
时, 、
、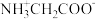 和
和 的分布分数【如
的分布分数【如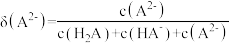 】与溶液
】与溶液 关系如图。下列说法错误的是
关系如图。下列说法错误的是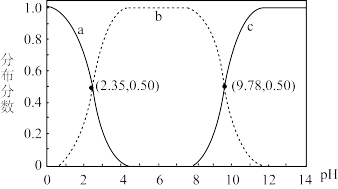
| A.甘氨酸具有两性 |
B.曲线c代表 |
C.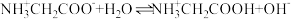 的平衡常数 的平衡常数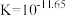 |
D.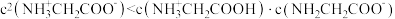 |
您最近一年使用:0次
2022-07-06更新
|
12721次组卷
|
32卷引用:吉林省长春市第二实验中学2023-2024学年高二下学期开学考试化学试题
吉林省长春市第二实验中学2023-2024学年高二下学期开学考试化学试题(已下线)专题10 水溶液中的离子平衡-2022年高考真题模拟题分项汇编(已下线)2022年辽宁省高考真题化学试题(部分试题)2022年辽宁高考真题化学试题(已下线)2022年辽宁省高考真题变式题(11-15)(已下线)第23讲 盐类水解 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)北京市第二中学2022-2023学年高三上学期12月考化学试题(已下线)专题21 电解质溶液图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 题型专攻4 电解质溶液各类图像的分析(已下线)素养卷05 电解质溶液中微粒变化图像题-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)专题11 水溶液中的离子平衡图像(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(已下线)回归教材重难点09 盘点溶液中的“四大”平衡-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)专题四 电解质溶液图象(练)(已下线)查补易混易错04 化学反应原理部分-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)2022年辽宁高考真题化学试题变式题(选择题11-15)江苏省连云港市东海县2022-2023学年高二下学期期中考试化学试题(已下线)题型26 电离平衡常数、水解平衡常数及其应用图像四川省成都市树德中学2022-2023学年高二下学期5月月考化学试题(已下线)专题16 水溶液中的离子平衡(已下线)专题16 水溶液中的离子平衡(已下线)第15练 水溶液中的离子平衡图像分析 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)微专题(9) 利用图像判断溶液粒子浓度关系(已下线)考点26 弱电解质的电离(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题12 水溶液中的离子反应与平衡-2023年高考化学真题题源解密(全国通用)第三章 水溶液中的离子反应与平衡 第三节 盐类的水解 第2课时 影响盐类水解的因素 水解原理的应用(已下线)微专题 水溶液中函数图像的分析第1讲 弱电解质的电离平衡(已下线)考点3 盐类水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)辽宁省大连市第十二中学2023-2024学年高二上学期12月学情反馈化学试题(已下线)题型14 电解质溶液-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)湖北省沙市中学2023-2024学年高三下学期3月月考化学试题福建省宁化市第一中学2023-2024学年高三下学期3月质量检测化学试题
3 . 已知:联氨(N2H4)是二元弱碱(pKb1=6,pKb2=15;pK=-lgK),在水中的电离方式类似于氨气,常温下,向0.1mol·L-1N2H5Cl溶液通入HCl或加入NaOH固体(假设溶液总体积不变),溶液中c(N2H )随pOH变化的曲线如图所示,下列说法错误的是
)随pOH变化的曲线如图所示,下列说法错误的是

 )随pOH变化的曲线如图所示,下列说法错误的是
)随pOH变化的曲线如图所示,下列说法错误的是
A.N2H5Cl溶液c(N2H )>c(N2H4)>c(N2H )>c(N2H4)>c(N2H ) ) |
| B.b点加入NaOH(或HCl)的物质的量与d点加入HCl(或NaOH)物质的量相等 |
| C.水的电离程度:b>a |
D.若c(N2H )>c(N2H4),则pH小于3.5 )>c(N2H4),则pH小于3.5 |
您最近一年使用:0次
2022-03-22更新
|
1387次组卷
|
3卷引用:山东省济南第一中学2023届高三上学期开学考试化学试题
4 . 草酸(H2C2O4)及其化合物在医药、印染、塑料等方面扮演着重要角色,同时广泛应用于化学实验中。
(1)氧化还原滴定法是以溶液中氧化剂和还原剂之间的电子转移为基础的一种滴定分析方法,应用非常广泛。某草酸亚铁( )样品中含有草酸,某化学兴趣小组想用氧化还原滴定法测定该样品中
)样品中含有草酸,某化学兴趣小组想用氧化还原滴定法测定该样品中 的含量。实验方案如下:
的含量。实验方案如下:
Ⅰ.称量0.50g样品于锥形瓶中,加入适量稀硫酸溶解,水浴加热至70℃,加入足量 溶液,使其充分反应。
溶液,使其充分反应。
Ⅱ.向反应后的溶液中加入过量锌粉与稀硫酸,煮沸且完全反应后,用KSCN在点滴板上检验至溶液不变红,过滤至另一洁净的锥形瓶中,用0.0200mol/L的酸性高锰酸钾标准液滴定该溶液至终点,消耗高锰酸钾标准液16.00mL。
请回答下列问题:
①高锰酸钾标准液用___________ (填“酸式”或“碱式”)滴定管盛装,达到滴定终点的现象是___________ 。
②下列关于实验误差的说法正确的是___________ (填标号)。
A.步骤Ⅰ中,若加入的 溶液的量不足,则测得的
溶液的量不足,则测得的 含量偏高
含量偏高
B.步骤Ⅱ中,滴定前读数正确,滴定终点时仰视读数,测得的 含量偏低
含量偏低
C.步骤Ⅱ中,锥形瓶中有少量水未干燥,测得的 含量偏低
含量偏低
D.步骤Ⅱ中,过滤时间过长,可能导致测得的 含量偏低
含量偏低
③0.50g该样品中 的质量分数为
的质量分数为___________ (不考虑损耗)。
(2)常温下,改变0.1mol/L的 溶液的pH,溶液中
溶液的pH,溶液中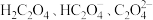 的物质的量分数(
的物质的量分数( )溶液pH的关系如图所示。回答下列问题:
)溶液pH的关系如图所示。回答下列问题:
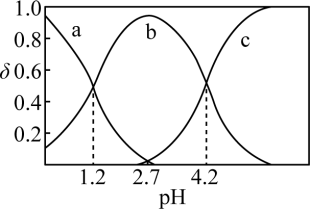
①曲线___________ (填“a”、“b”或“c”)代表 ,
, 时,溶液中
时,溶液中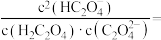
___________ 。
②pH从1.2增大至4.2的过程中,水的电离程度___________ (填“增大”、“减小”或“不变”)。
③ 溶液中存在的离子浓度大小关系为
溶液中存在的离子浓度大小关系为___________ 。
(1)氧化还原滴定法是以溶液中氧化剂和还原剂之间的电子转移为基础的一种滴定分析方法,应用非常广泛。某草酸亚铁(
 )样品中含有草酸,某化学兴趣小组想用氧化还原滴定法测定该样品中
)样品中含有草酸,某化学兴趣小组想用氧化还原滴定法测定该样品中 的含量。实验方案如下:
的含量。实验方案如下:Ⅰ.称量0.50g样品于锥形瓶中,加入适量稀硫酸溶解,水浴加热至70℃,加入足量
 溶液,使其充分反应。
溶液,使其充分反应。Ⅱ.向反应后的溶液中加入过量锌粉与稀硫酸,煮沸且完全反应后,用KSCN在点滴板上检验至溶液不变红,过滤至另一洁净的锥形瓶中,用0.0200mol/L的酸性高锰酸钾标准液滴定该溶液至终点,消耗高锰酸钾标准液16.00mL。
请回答下列问题:
①高锰酸钾标准液用
②下列关于实验误差的说法正确的是
A.步骤Ⅰ中,若加入的
 溶液的量不足,则测得的
溶液的量不足,则测得的 含量偏高
含量偏高B.步骤Ⅱ中,滴定前读数正确,滴定终点时仰视读数,测得的
 含量偏低
含量偏低C.步骤Ⅱ中,锥形瓶中有少量水未干燥,测得的
 含量偏低
含量偏低D.步骤Ⅱ中,过滤时间过长,可能导致测得的
 含量偏低
含量偏低③0.50g该样品中
 的质量分数为
的质量分数为(2)常温下,改变0.1mol/L的
 溶液的pH,溶液中
溶液的pH,溶液中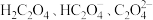 的物质的量分数(
的物质的量分数( )溶液pH的关系如图所示。回答下列问题:
)溶液pH的关系如图所示。回答下列问题:
①曲线
 ,
, 时,溶液中
时,溶液中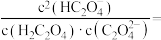
②pH从1.2增大至4.2的过程中,水的电离程度
③
 溶液中存在的离子浓度大小关系为
溶液中存在的离子浓度大小关系为
您最近一年使用:0次
2022-01-21更新
|
129次组卷
|
3卷引用:河南省许平汝联盟2021-2022学年高二下学期开学考试化学试题
5 . 氮及其化合物在生产、生活与环境中有着重要研究和应用价值。根据要求回答问题:
(1)CO和NO都是汽车尾气有害物质,它们能缓慢的反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g) △H=-746.5kJ·mol-1。已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ·mol-1,CO的燃烧热△H=_______ kJ·mol-1
(2)N2O4是一种强氧化剂,是重要的火箭推进剂之一。已知反应N2O4(g)⇌2NO2(g) △H>0,v(正)=k(正)·c(N2O4)、v(逆)=k(逆)·c2(NO2)。
①平衡后升高温度k(逆)/k(正)_______ (填“增大”、“不变”或“减小”)
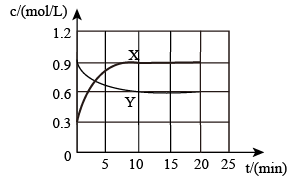
②将一定量N2O4和NO2的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化关系如图所示。反应从开始进行到10min时v(NO2)=_______ mol/(L·s)
③T℃时,向恒温密闭容器中充入nmolN2O4,维持总压强p0恒定,达平衡时,NO2的平衡分压p(NO2)=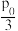 ,则该温度下该反应平衡转化率α(N2O4)=
,则该温度下该反应平衡转化率α(N2O4)=_______ ,保持温度不变,再向密闭容器中充入nmolN2O4,维持总压强为2p0,则在该温度下该反应的压强平衡常数(Kp)=_______ (用各气体物质的分压代替浓度的平衡常数叫压强平衡常数(Kp)。分压=总压×物质的量分数)
(3)氢叠氮酸(HN3)是无色有刺激性气味的液体,可作引爆剂。已知常温下向25.00mL0.1mol·L-1ROH溶液中逐滴滴加0.2mol·L-1的HN3溶液,溶液的pH与所加溶液的体积关系如下表(溶液混合时体积的变化忽略不计)。
①pH=9时溶液中c(N )
)_______ c(R+)(填“>”、“=”或“<”),pH=a时溶液中c(HN3)_______ c(N )(填“大于”“等于”或“小于”)
)(填“大于”“等于”或“小于”)
②HN3的Ka=_______ (精确值)
(4)N2O5是一种新型硝化剂。其制备装置如图所示。
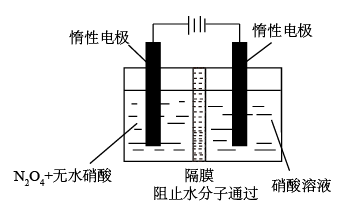
透过隔膜的粒子是_______ ,制取N2O5的电极反应式为_______
(1)CO和NO都是汽车尾气有害物质,它们能缓慢的反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g) △H=-746.5kJ·mol-1。已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ·mol-1,CO的燃烧热△H=
(2)N2O4是一种强氧化剂,是重要的火箭推进剂之一。已知反应N2O4(g)⇌2NO2(g) △H>0,v(正)=k(正)·c(N2O4)、v(逆)=k(逆)·c2(NO2)。
①平衡后升高温度k(逆)/k(正)
②将一定量N2O4和NO2的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化关系如图所示。反应从开始进行到10min时v(NO2)=

③T℃时,向恒温密闭容器中充入nmolN2O4,维持总压强p0恒定,达平衡时,NO2的平衡分压p(NO2)=
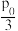 ,则该温度下该反应平衡转化率α(N2O4)=
,则该温度下该反应平衡转化率α(N2O4)=(3)氢叠氮酸(HN3)是无色有刺激性气味的液体,可作引爆剂。已知常温下向25.00mL0.1mol·L-1ROH溶液中逐滴滴加0.2mol·L-1的HN3溶液,溶液的pH与所加溶液的体积关系如下表(溶液混合时体积的变化忽略不计)。
| V(HN3)/mL | 0 | 12.50 | 12.75 | 25.00 |
| pH | 13 | 9 | 7 | a |
 )
) )(填“大于”“等于”或“小于”)
)(填“大于”“等于”或“小于”)②HN3的Ka=
(4)N2O5是一种新型硝化剂。其制备装置如图所示。

透过隔膜的粒子是
您最近一年使用:0次
解题方法
6 . 硫及其化合物在生产生活中有广泛的应用。请回答:
(1)室温下, 溶液呈碱性的原因是
溶液呈碱性的原因是___________ (用离子方程式表示)。
(2)下列关于硫及其化合物的说法,正确的是___________ (填字母)。
A.硫元素在自然界中只能以化合态形式存在
B. 通入紫色石蕊试液,先变红后褪色
通入紫色石蕊试液,先变红后褪色
C.酸雨是 的降水,主要是由污染物
的降水,主要是由污染物 、
、 造成
造成
D.浓硫酸中加入少量胆矾晶体,搅拌,固体逐渐变成白色
(3)光谱研究表明, 的水溶液中存在下列平衡:
的水溶液中存在下列平衡:
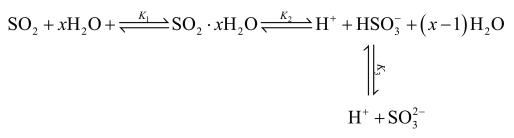
其中 、
、 、
、 为各步的平衡常数,且
为各步的平衡常数,且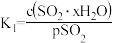 (
( 表示
表示 的平衡压强)。
的平衡压强)。
①当 的平衡压强为p时,测得
的平衡压强为p时,测得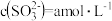 ,则溶液
,则溶液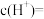
___________ 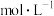 。
。
(用含p、a、 、
、 、
、 的式子表示)
的式子表示)
②滴加NaOH至 时,溶液中
时,溶液中 。如果溶液中
。如果溶液中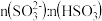
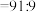 ,需加NaOH将溶液pH调整为约等于
,需加NaOH将溶液pH调整为约等于___________ 。
(4)“钙基固硫”是利用石灰石将燃煤烟气中的 转化为
转化为 。但高温时CO会与
。但高温时CO会与 反应而影响脱硫效率。相关反应如下:
反应而影响脱硫效率。相关反应如下:
Ⅰ.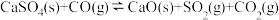
Ⅱ.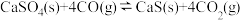
当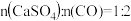 时,反应25min,体系中
时,反应25min,体系中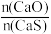 的比值随温度变化如表所示:
的比值随温度变化如表所示:
请结合题给反应过程能量图,说明:
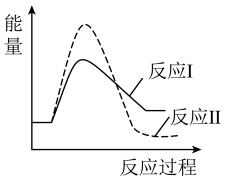
①750K→1250K时,比值随温度升高逐渐减小的原因是___________ 。
②1250K后,比值随温度升高逐渐增大的原因是___________ 。
(5)氨水也可吸收 :
: ,
,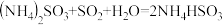 。能提高
。能提高 去除率的措施有
去除率的措施有___________ (填字母)。
A.增大氨水浓度 B.加热煮沸
C.降低烟气的流速 D.补充 ,将
,将 氧化为
氧化为
(1)室温下,
 溶液呈碱性的原因是
溶液呈碱性的原因是(2)下列关于硫及其化合物的说法,正确的是
A.硫元素在自然界中只能以化合态形式存在
B.
 通入紫色石蕊试液,先变红后褪色
通入紫色石蕊试液,先变红后褪色C.酸雨是
 的降水,主要是由污染物
的降水,主要是由污染物 、
、 造成
造成D.浓硫酸中加入少量胆矾晶体,搅拌,固体逐渐变成白色
(3)光谱研究表明,
 的水溶液中存在下列平衡:
的水溶液中存在下列平衡: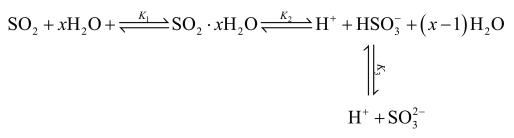
其中
 、
、 、
、 为各步的平衡常数,且
为各步的平衡常数,且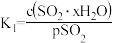 (
( 表示
表示 的平衡压强)。
的平衡压强)。①当
 的平衡压强为p时,测得
的平衡压强为p时,测得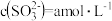 ,则溶液
,则溶液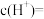
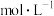 。
。(用含p、a、
 、
、 、
、 的式子表示)
的式子表示)②滴加NaOH至
 时,溶液中
时,溶液中 。如果溶液中
。如果溶液中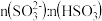
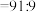 ,需加NaOH将溶液pH调整为约等于
,需加NaOH将溶液pH调整为约等于(4)“钙基固硫”是利用石灰石将燃煤烟气中的
 转化为
转化为 。但高温时CO会与
。但高温时CO会与 反应而影响脱硫效率。相关反应如下:
反应而影响脱硫效率。相关反应如下:Ⅰ.
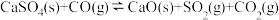
Ⅱ.
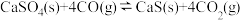
当
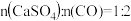 时,反应25min,体系中
时,反应25min,体系中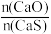 的比值随温度变化如表所示:
的比值随温度变化如表所示:| 温度 | 750K | 1250K | 1750K |
| 比值 | 3.57 | 1.08 | 3.42 |

①750K→1250K时,比值随温度升高逐渐减小的原因是
②1250K后,比值随温度升高逐渐增大的原因是
(5)氨水也可吸收
 :
: ,
,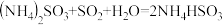 。能提高
。能提高 去除率的措施有
去除率的措施有A.增大氨水浓度 B.加热煮沸
C.降低烟气的流速 D.补充
 ,将
,将 氧化为
氧化为
您最近一年使用:0次



