名校
解题方法
1 . 一种脱除烟气中 并除去水溶液中
并除去水溶液中 的方法如下图甲所示。室温下用NaOH溶液吸收
的方法如下图甲所示。室温下用NaOH溶液吸收 ,过程中气体挥发和溶液体积的变化可忽略。吸收液中含硫微粒的浓度
,过程中气体挥发和溶液体积的变化可忽略。吸收液中含硫微粒的浓度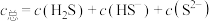 ,含硫微粒分布百分数如下图乙所示。已知室温时
,含硫微粒分布百分数如下图乙所示。已知室温时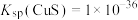

室温时,下列说法正确的是
 并除去水溶液中
并除去水溶液中 的方法如下图甲所示。室温下用NaOH溶液吸收
的方法如下图甲所示。室温下用NaOH溶液吸收 ,过程中气体挥发和溶液体积的变化可忽略。吸收液中含硫微粒的浓度
,过程中气体挥发和溶液体积的变化可忽略。吸收液中含硫微粒的浓度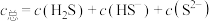 ,含硫微粒分布百分数如下图乙所示。已知室温时
,含硫微粒分布百分数如下图乙所示。已知室温时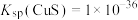

室温时,下列说法正确的是
A.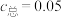 mol⋅L-1的吸收液中: mol⋅L-1的吸收液中: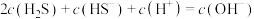 |
B. mol⋅L-1的吸收液中: mol⋅L-1的吸收液中: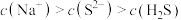 |
C.除铜后所得溶液中一定存在: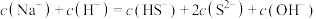 |
D.反应 的平衡常数 的平衡常数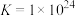 |
您最近一年使用:0次
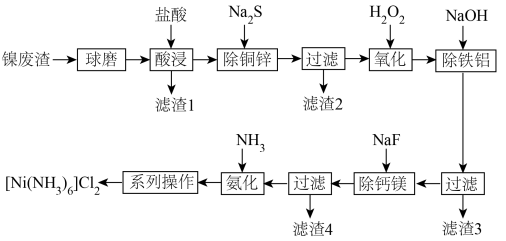
2 . [Ni(NH3)6]Cl2在有机合成中有广泛应用。以镍废渣(主要含Ni、CuO、FeO、ZnO、Al2O3、MgO、CaCO3和SiO2)为原料制备[Ni(NH3)6]Cl2的工艺流程如下。回答下列问题: 都不能氧化
都不能氧化 。
。
②25℃时,几种氢氧化物和氟化物的 如表所示:
如表所示:
③25℃时,几种金属硫化物的 如表所示:
如表所示:
(1)“酸浸”之前“球磨”,目的是___________ ,“酸浸”时适当加热可以提高反应速率,但是温度过高,速率反而减小,其原因是___________ 。
(2)“除铜锌”时,测得溶液中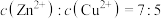 ,最先沉淀的离子是
,最先沉淀的离子是___________ (填离子符号,下同),若溶液中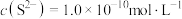 ,此时溶液中被除干净的离子是
,此时溶液中被除干净的离子是___________ (当溶液中某离子的浓度小于或等于 时,认为该离子已被除干净)。
时,认为该离子已被除干净)。
(3)Na2S溶液呈碱性的原因是___________ (用离子方程式表示)。
(4)“除铁铝”中, 时,
时,
___________  。
。
(5)已知常温下, ,则NaF的水解常数
,则NaF的水解常数
___________ ;“除钙镁”时,不能选用玻璃仪器,其原因是___________ 。
 都不能氧化
都不能氧化 。
。②25℃时,几种氢氧化物和氟化物的
 如表所示:
如表所示:| 物质 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 | CaF2 | MgF2 |
 | 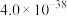 | 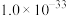 | 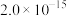 |  |  |
 如表所示:
如表所示:| 金属硫化物 | FeS | NiS | CuS | ZnS |
 | 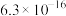 |  | 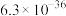 | 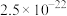 |
(1)“酸浸”之前“球磨”,目的是
(2)“除铜锌”时,测得溶液中
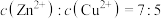 ,最先沉淀的离子是
,最先沉淀的离子是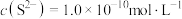 ,此时溶液中被除干净的离子是
,此时溶液中被除干净的离子是 时,认为该离子已被除干净)。
时,认为该离子已被除干净)。(3)Na2S溶液呈碱性的原因是
(4)“除铁铝”中,
 时,
时,
 。
。(5)已知常温下,
 ,则NaF的水解常数
,则NaF的水解常数
您最近一年使用:0次
2024-01-19更新
|
123次组卷
|
2卷引用:江西省部分学校2023-2024学年高三上学期12月月考化学试题
名校
3 . 已知常温下水溶液中 、
、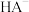 、
、 、HB、
、HB、 的分布分数δ[如
的分布分数δ[如 ]随pH变化曲线如图1;溶液中
]随pH变化曲线如图1;溶液中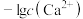 和
和 关系如图2.用
关系如图2.用
 溶液滴定20.00mL
溶液滴定20.00mL
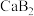 溶液,下列说法错误的是
溶液,下列说法错误的是

 、
、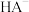 、
、 、HB、
、HB、 的分布分数δ[如
的分布分数δ[如 ]随pH变化曲线如图1;溶液中
]随pH变化曲线如图1;溶液中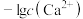 和
和 关系如图2.用
关系如图2.用
 溶液滴定20.00mL
溶液滴定20.00mL
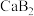 溶液,下列说法错误的是
溶液,下列说法错误的是
| A.曲线d表示δ(HB) |
B. 的水解平衡常数 的水解平衡常数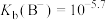 |
| C.滴定过程中溶液会变浑浊 |
D.滴定过程中始终存在: |
您最近一年使用:0次
2023-04-10更新
|
1860次组卷
|
12卷引用:湖南省长郡中学2024届高三上学期月考卷(一)化学试题
湖南省长郡中学2024届高三上学期月考卷(一)化学试题湖南省长沙市长郡中学2024届高三上学期9月月考化学试题江西省宜丰中学创新部2023-2024学年高二上学期第一次(10月)月考化学试题四川省宜宾市叙州区第一中学校2023-2024学年高二上学期12月月考化学试题河北省石家庄市部分学校2023届高中毕业年级教学质量检测(二)(一模)化学试题河北省邢台市2022-2023学年高三下学期4月第一次模拟考试化学试题(已下线)专题15 水溶液中的离子平衡山东省东营市第一中学2023届高三下学期二模化学试题东北育才学校高中部2023届高三下学期适应性考试化学试题重庆市七校2023-2024学年高三上学期开学考试化学试题(已下线)化学(九省联考考后提升卷,河南卷)-2024年1月“九省联考”真题完全解读与考后提升(已下线)热点18 电解质溶液图像分析
4 . 均苯三甲酸是一种重要的有机三元弱酸,可表示为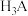 。向
。向 的
的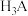 溶液中加入
溶液中加入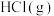 或
或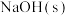 时(忽略溶液体积的变化),各微粒的分布系数
时(忽略溶液体积的变化),各微粒的分布系数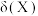 随溶液
随溶液 变化的曲线如图所示:
变化的曲线如图所示:
已知:①[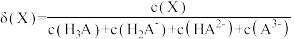 ,X为
,X为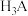 、
、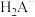 、
、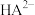 或
或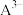 ]
]
②(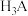
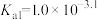 、
、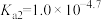 、
、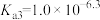 )
)
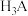 。向
。向 的
的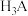 溶液中加入
溶液中加入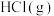 或
或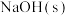 时(忽略溶液体积的变化),各微粒的分布系数
时(忽略溶液体积的变化),各微粒的分布系数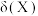 随溶液
随溶液 变化的曲线如图所示:
变化的曲线如图所示:已知:①[
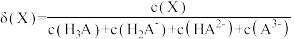 ,X为
,X为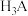 、
、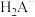 、
、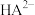 或
或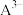 ]
]②(
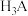
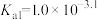 、
、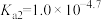 、
、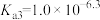 )
)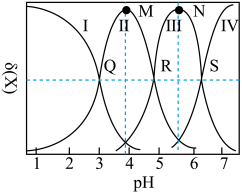
A.若用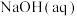 滴定 滴定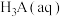 至恰好生成 至恰好生成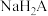 ,可选甲基橙做指示剂 ,可选甲基橙做指示剂 |
B.N点的 |
C.常温下,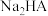 的水解常数 的水解常数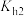 的数量级为 的数量级为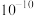 |
D.R点满足: |
您最近一年使用:0次
2022-11-25更新
|
1559次组卷
|
6卷引用:湖南省长沙市雅礼中学2022-2023学年高三上学期第五次月考化学试题
名校
解题方法
5 . 常温下,向0.1mol•L-1的乙二胺(H2NCH2CH2NH2)溶液中不断通入HCl气体,溶液中三种含氮微粒的物质的量分数δ与pOH的关系图如图。已知:①乙二胺为无色液体,有类似氨的性质,常温下Kb1=10-4.07,Kb2=10-7.15;②假设溶液体积保持不变。下列说法中不正确 的是{已知:pOH=-lgc(OH-)}
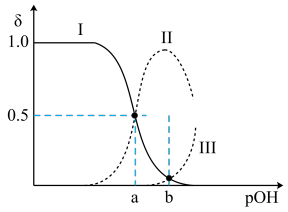

A.曲线Ⅱ代表的微粒符号为H2NCH2CH2NH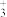 |
| B.b点的对应pOH=5.61 |
| C.pOH=a时,c(Cl-)>0.05mol•L-1 |
| D.在0.1mol•L-1H2NCH2CH2NH3Cl溶液中:c([H2NCH2CH2NH3]+)>c([H3NCH2CH2NH3]2+)>c(H2NCH2CH2NH2) |
您最近一年使用:0次
2022-10-08更新
|
1170次组卷
|
2卷引用:浙江省浙南名校联盟2022-2023学年高三上学期第一次联考化学试题
2022高三·全国·专题练习
6 . 甘氨酸 是人体必需氨基酸之一、在
是人体必需氨基酸之一、在 时,
时, 、
、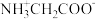 和
和 的分布分数【如
的分布分数【如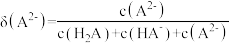 】与溶液
】与溶液 关系如图。下列说法错误的是
关系如图。下列说法错误的是
 是人体必需氨基酸之一、在
是人体必需氨基酸之一、在 时,
时, 、
、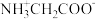 和
和 的分布分数【如
的分布分数【如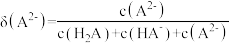 】与溶液
】与溶液 关系如图。下列说法错误的是
关系如图。下列说法错误的是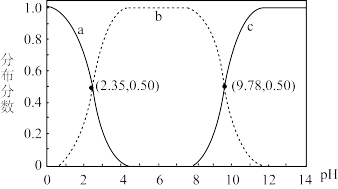
| A.甘氨酸具有两性 |
B.曲线c代表 |
C.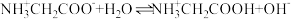 的平衡常数 的平衡常数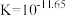 |
D.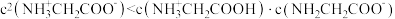 |
您最近一年使用:0次
2022-07-06更新
|
12721次组卷
|
32卷引用:北京市第二中学2022-2023学年高三上学期12月考化学试题
北京市第二中学2022-2023学年高三上学期12月考化学试题四川省成都市树德中学2022-2023学年高二下学期5月月考化学试题辽宁省大连市第十二中学2023-2024学年高二上学期12月学情反馈化学试题湖北省沙市中学2023-2024学年高三下学期3月月考化学试题福建省宁化市第一中学2023-2024学年高三下学期3月质量检测化学试题(已下线)专题10 水溶液中的离子平衡-2022年高考真题模拟题分项汇编(已下线)2022年辽宁省高考真题化学试题(部分试题)2022年辽宁高考真题化学试题(已下线)2022年辽宁省高考真题变式题(11-15)(已下线)第23讲 盐类水解 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题21 电解质溶液图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 题型专攻4 电解质溶液各类图像的分析(已下线)素养卷05 电解质溶液中微粒变化图像题-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)专题11 水溶液中的离子平衡图像(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(已下线)回归教材重难点09 盘点溶液中的“四大”平衡-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)专题四 电解质溶液图象(练)(已下线)查补易混易错04 化学反应原理部分-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)2022年辽宁高考真题化学试题变式题(选择题11-15)江苏省连云港市东海县2022-2023学年高二下学期期中考试化学试题(已下线)题型26 电离平衡常数、水解平衡常数及其应用图像(已下线)专题16 水溶液中的离子平衡(已下线)专题16 水溶液中的离子平衡(已下线)第15练 水溶液中的离子平衡图像分析 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)微专题(9) 利用图像判断溶液粒子浓度关系(已下线)考点26 弱电解质的电离(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题12 水溶液中的离子反应与平衡-2023年高考化学真题题源解密(全国通用)第三章 水溶液中的离子反应与平衡 第三节 盐类的水解 第2课时 影响盐类水解的因素 水解原理的应用(已下线)微专题 水溶液中函数图像的分析第1讲 弱电解质的电离平衡(已下线)考点3 盐类水解(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)题型14 电解质溶液-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)吉林省长春市第二实验中学2023-2024学年高二下学期开学考试化学试题
名校
解题方法
7 . 某化学兴趣小组探究FeCl3溶液和Na2SO3溶液的反应情况。
已知:K3[Fe(CN)6]可以和Fe2+生成蓝色沉淀,常用于Fe2+的检验。请回答相关问题。
[实验1]分别将100mL1.0mol·L-1的FeCl3溶液和Na2SO3溶液装入两个烧杯中,按图进行实验,观察到电流计指针发生偏转。
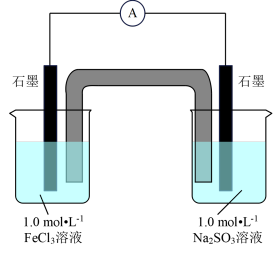
(1)请写出左侧烧杯中的电极反应式__ 。盐桥中的阳离子向__ (填“左侧”或“右侧”)烧杯中迁移。
[实验2]在试管1中加入2mL1.0mol·L-1Na2SO3溶液,然后再滴加两滴1.0mol·L-1FeCl3溶液,溶液中立刻变成红褐色。对试管1进行加热至沸腾,产生红褐色沉淀。取出几滴混合液,加K3[Fe(CN)6]溶液,无蓝色沉淀出现。整个过程中未观察到明显的气泡产生。
[实验3]在试管2中加入5mL1.0mol·L-1FeCl3溶液,然后再滴加1mL1.0mol·L-1Na2SO3溶液,溶液立刻变成红褐色。取出几滴混合液,加K3[Fe(CN)6]溶液,产生蓝色沉淀。
(2)实验3中生成蓝色沉淀的离子方程式为__ 。请设计实验证明SO 被氧化
被氧化__ 。
[反思与研讨]
资料显示:H2SO3的Ka1=1.7×10-2Ka2=6.0×10-8;Fe(OH)3的Ksp=4×10-38;反应2Fe3++ SO +H2O
+H2O 2Fe2++SO
2Fe2++SO +2H+的平衡常数K=1020.6。
+2H+的平衡常数K=1020.6。
(3)反应2Fe3++3SO +6H2O
+6H2O 2Fe(OH)3↓+3H2SO3的平衡常数K的数量级为
2Fe(OH)3↓+3H2SO3的平衡常数K的数量级为__ 。由此可判断FeCl3溶液和Na2SO3溶液发生__ (填“双水解”或“氧化还原”)反应的趋势更大。
已知:K3[Fe(CN)6]可以和Fe2+生成蓝色沉淀,常用于Fe2+的检验。请回答相关问题。
[实验1]分别将100mL1.0mol·L-1的FeCl3溶液和Na2SO3溶液装入两个烧杯中,按图进行实验,观察到电流计指针发生偏转。

(1)请写出左侧烧杯中的电极反应式
[实验2]在试管1中加入2mL1.0mol·L-1Na2SO3溶液,然后再滴加两滴1.0mol·L-1FeCl3溶液,溶液中立刻变成红褐色。对试管1进行加热至沸腾,产生红褐色沉淀。取出几滴混合液,加K3[Fe(CN)6]溶液,无蓝色沉淀出现。整个过程中未观察到明显的气泡产生。
[实验3]在试管2中加入5mL1.0mol·L-1FeCl3溶液,然后再滴加1mL1.0mol·L-1Na2SO3溶液,溶液立刻变成红褐色。取出几滴混合液,加K3[Fe(CN)6]溶液,产生蓝色沉淀。
(2)实验3中生成蓝色沉淀的离子方程式为
 被氧化
被氧化[反思与研讨]
资料显示:H2SO3的Ka1=1.7×10-2Ka2=6.0×10-8;Fe(OH)3的Ksp=4×10-38;反应2Fe3++ SO
 +H2O
+H2O 2Fe2++SO
2Fe2++SO +2H+的平衡常数K=1020.6。
+2H+的平衡常数K=1020.6。(3)反应2Fe3++3SO
 +6H2O
+6H2O 2Fe(OH)3↓+3H2SO3的平衡常数K的数量级为
2Fe(OH)3↓+3H2SO3的平衡常数K的数量级为
您最近一年使用:0次
2022-01-08更新
|
352次组卷
|
3卷引用:河南省洛阳市第一高级中学2023届高三上学期8月调研考试化学试题



